2. 山东省食品药品监督管理局, 山东 济南 250011
2. Shandong Food and Drug Administration, Jinan 250011, China
羚羊角Saigae Tataricae Cornu为牛科动物赛加羚羊Saiga tatarica Linnaeus的角,属于名贵中药材,性寒,味咸,归肝、心经,可平肝熄风、清肝明目、散血解毒,主治肝风内动、惊痫抽搐、妊娠子痫、高热痉厥、癫痫发狂、头痛眩晕、目赤翳障、温毒发斑、痈肿疮毒等症[1],其临床疗效卓著,在小儿高热等危重病症治疗中发挥着重要作用。由于野生资源逐年减少,赛加羚羊已被世界自然保护联盟(IUCN)列入了世界濒危动物红色名录,且标注为极濒危类目[2]。在资源减少、货源短缺、市场价格居高不下的情况下,加强中药制剂中羚羊角药材的检测尤为重要。目前,《中国药典》2010年版检测中药制剂是否含有羚羊角的方法,一是显微观察,二是薄层色谱,二者操作复杂,且结果受仪器和操作者的影响较大,因此寻找一种简便快捷、准确性高的检测方法非常有必要。DNA条形码(DNA barcoding)作为一种现代生物技术,是以DNA为基础的系统分类新方法之一,能够弥补传统形态学鉴定的某些局限,有效实现少量甚至微量样品中物种的鉴定[3, 4],并迅速在动植物甚至微生物领域发挥了卓越作用[5, 6, 7, 8, 9, 10],引起了国内外极大的关注和愈发深入的研究。目前国内外尚无以DNA条形码方法检识中药制剂中羚羊角的相关报道,本实验将该技术应用于中药制剂中羚羊角的检测,旨在为提高中药制剂质量控制技术水平提供新的思路与方法。
1 仪器设备、试剂与材料 1.1 仪器设备DNA样品粉碎研磨仪(Retsch,MM400,德国),水浴锅(上海申光,双列四孔,中国),梯度PCR扩增仪(Eppendorf,Mastercycler gradient,德国),离心机(Thermo,LEGEND MICRO 21,美国),移液器(Thermo,Scientific Finnpipette F1,美国),电泳仪(BIO-RAD,Power pac 300,美国),紫外凝胶成像仪(Syngene,英国),ABI 3730XL测序仪(Applied Biosystems Co.,美国)。
1.2 试剂血液/细胞/组织基因组DNA提取试剂盒(Tian-gen Biotech Co.,中国),2×Taq PCR Master Mix(Tian-gen Biotech Co.,中国),100 bp DNA Ladder Marker(Tian-gen Biotech Co.,中国),溴化乙锭(EB,ethidium bromide)。
1.3 材料羚羊角标准药材,编号LYBZ01YP(简称YP),中国食品药品检定研究院,批号1064-0301;羚羊角粉,编号LYDP01LA(简称LA),山东嘉泰中药饮片公司生产,批号121102,经山东中医药大学周凤琴教授鉴定为羚羊角Saigae Tataricae Cornu粉末;羚羊清肺散,编号LYZJ01AA(简称AA),哈尔滨儿童制药有限公司生产,批号110201;复方西羚解毒片,编号LYZJ01AB(简称AB),山东宏济堂制药集团有限公司生产,批号121010;羚羊感冒片,编号LYZJ01AC(简称AC),北京同仁堂科技发展股份有限公司生产,批号1120665;奇特羚羊清肺丸,编号LYZJ01AD(简称AD),赤峰天奇制药有限责任公司生产,批号20120408;羚羊角颗粒,编号LYZJ01AE(简称AE),吉林省健今药业股份有限公司生产,批号20120805;金羚感冒片,编号LYZJ01AF(简称AF),山东润华药业有限公司生产,批号121008;小儿七珍丸,编号LYZJ01AG(简称AG),山西双人药业有限责任公司生产,批号121104。以上除羚羊角标准药材购自山东省食品药品检验所外,其他样品均购自济南漱玉平民大药房有限公司。
2 方法 2.1 DNA提取各样品先以研钵研碎(糖衣片须先去糖衣),再以DNA样品粉碎研磨仪研磨2 min(30次/s),必要时可重复研磨2 min。研磨后,称取一定量,羚羊角对照品与羚羊角粉20~25 mg,其他制剂30~35 mg,每样品重复5次。采用DNA提取试剂盒进行提取,在每份称量好的样品中加缓冲液200 μL,振荡至彻底悬浮,然后加入蛋白酶K(Proteinase K)20 μL,56 ℃水浴8 h或过夜(水浴过程中颠倒离心管数次以混匀样品);简短离心后加缓冲液200 μL,70 ℃水浴10 min;加无水乙醇200 μL,充分振荡15 s;将所得溶液及絮状沉淀完全转移至吸附柱中,12 000 r/min离心30 s;加缓冲液500 μL,12 000 r/min离心30 s,弃废液;加入漂洗液700 μL,12 000 r/min离心30 s,弃废液;再次加入漂洗液700 μL,12 000 r/min离心30 s,弃废液;12 000 r/min空离30 s,弃废液,室温放置15 min;将吸附柱和所得产物转移至干净离心管中,于吸附柱上悬空滴加洗脱缓冲液70 μL,室温放置2~5 min,12 000 r/min离心2 min;收集离心得到的试液,并将收集到的试液悬空滴加至吸附柱,室温放置2~5 min,12 000 r/min离心2 min,以提高DNA得率。最后离心得到的试液即为所需的样品DNA,弃置吸附柱,编号后于-20 ℃冻存。
2.2 PCR扩增参考陈士林[11]方法。采用25 μL PCR反应体系:样品DNA模板2 μL,2×Taq PCR Master Mix 12.5 μL,正反向引物(COI:LCO1490、HCO2198;设计引物:0703-01、0703-02)分别1 μL,ddH2O 8.5 μL,以封口膜封盖体系后进行PCR扩增。PCR反应条件为COI体系:94 ℃预变性5 min,94 ℃变性1 min,45 ℃退火1.5 min,72 ℃延伸1.5 min,5个循环;94 ℃变性1 min,50 ℃退火1.5 min,72 ℃延伸1 min,35个循环;72 ℃再延伸5 min,4 ℃保存。设计引物体系:94 ℃预变性5 min,94 ℃变性1 min,53 ℃退火1.5 min,72 ℃延伸1.5 min,40个循环,72 ℃延伸5 min,4 ℃保存。所用引物均由北京六合华大基因合成,见表 1。
| 表 1 引物序列信息 Table 1 Primer sequence information |
其中,COI引物为动物DNA提取通用引物,0703为混合动物样品条件下专属性较强的特异性引物,以Primer5.0在赛加羚羊线粒体全基因组(gb|JN632700.1)中寻找COI序列设计并经验证。必要时可将PCR产物作为DNA模板重复进行PCR扩增程序,以提高样品浓度。PCR扩增产物经1%琼脂糖EB凝胶电泳检测,其长度用100 bp DNA Ladder Marker确定,有单一明亮条带的样品送北京六合华大基因科技股份有限公司青岛测序部进行纯化和双向测序。
2.3 序列比对测序信息返回后,采用CodonCode Aligner V2.06对所得峰图进行处理,将同一样品的5个序列数据拼接并校正,去除引物及低质量区域,每个样品均获得长度为658 bp的单一序列,且各序列均已上传至美国国立生物技术信息中心(简称NCBI),GenBank登录号为KF735178~KF735210。
在采用DNA条形码鉴定物种时,一般采用相似性搜索法BLAST-Based Method、距离法Distance-Based Method及建树法Tree-Based Method[12, 13],此外还有学者提出了PCI(probability of correct identification)[14]等方法。本实验采用了相似性搜索法和建树法2种方法。
3 结果与分析将各样品序列与赛加羚羊基因组的BLAST进行比对,结果显示,羚羊角标准药材及8个中药制剂样品DNA提取物与赛加羚羊线粒体全基因组(gb|JN632700.1)高度相似,相似度均达到98%以上,说明上述中药制剂中均含有赛加羚羊DNA组分,提示所用羚羊角为正品羚羊角。只有AD的相似度较低,仅为96%,因此不能排除后者有采用赛加羚羊近缘种的角作为原料的可能。为深入研究样品AD所用羚羊角与赛加羚羊之间的亲缘关系,本课题组进行了进一步的数据处理和分析。
采用DNAMAN对上述样品序列进行多序列比对并建树(同源树),因赛加羚羊是高鼻羚羊属中的唯一种,因而选择以同科近缘种灰小羚羊Sylvicapra grimmia(Huiling,gb|HQ644119.1)作为outgroup进行对照,结果见图 1。
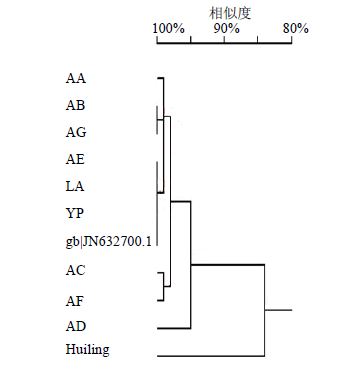 | 图 1 样品序列同源树图Fig. 1 Phylogenetic tree of sample sequence |
图 1结果显示,各样品序列和GenBank中下载的赛加羚羊序列能与outgroup完全分开并聚类成为一支,且支持率均≥70%,因此基本可以认定各样品均含有赛加羚羊DNA组分。各样品序列存在微小差异,可能与赛加羚羊因生活环境不同而导致的基因突变有关,其中AD与其他样品在进化距离上存在一定差异的原因尚需深入探究。
另通过MEGA5.2建NJ树(Neighbor-Joining Tree,bootstrap 1 000次重复)得到相同结果,并能显示更高精度的图像,可以观察到更全面的各样品序列差异程度,见图 2。
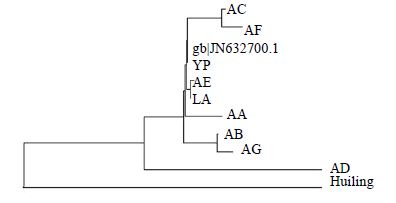 | 图 2 样品序列NJ树Fig. 2 NJ tree of sample sequence |
在MEGA5.2中,采用Kimura-2-parameter模型计算各样品序列间的遗传距离发现,各样品序列中种内遗传距离为0~0.064,平均遗传距离为0.020,种间遗传距离为0.167~0.195。可用于物种检验的理想DNA条形码应当具有足够小的种内变异,同时具有明显的种间变异,见表 2。结果显示,各序列数据中种间最小变异明显大于种内最大变异,因此,基于COI序列的Kimura-2-parameter模型可以用来检验中药制剂中的羚羊角。
4 讨论羚羊角在中药制剂中多以原药材粉碎配方入药,除药典中规定的显微鉴别和薄层鉴别是其主要检测方法外[15, 16, 17, 18, 19],还有蛋白电泳法[20]。显微鉴别主要是观察是否具有稍有光泽的不规则碎块,并均匀分布有裂缝状或长圆形空隙等;薄层鉴别是取样品和羚羊角对照药材,加石油醚加热回流1.5 h,滤过并挥去石油醚后加乙醇加热回流,滤过并蒸干,残渣以乙醇1 mL溶解,作为供试品溶液和对照药材溶液,以薄层色谱检验,于同一硅胶G薄层板上以正丁醇-冰醋酸-水(3∶1∶1)为展开剂,喷以茚三酮试液,加热至斑点清晰后,观察两者是否在相应位置显示相同颜色[1];蛋白电泳中正品羚羊角共有6条谱带,与伪品有一定区别。
| 表 2 序列距离矩阵分析表 Table 2 Distance-matrix analysis of each sequence |
以上几种方法均存在明显缺点,显微鉴别不仅对检验人员要求较高,而且羚羊角的显微特征均数远小于普通中药材,例如只占黄芩显微特征均数的一半不到[21];薄层鉴别难以与其他动物角类相区别,且重复性较差。由于对中药制剂中的羚羊角至今没有较为完善的检验方法,从而存在着检测漏洞。DNA条形码技术用于物种鉴定得到了国际认可和肯定,但主要集中于植物方面[22, 23],动物类研究较少,尤其以DNA条形码技术检验中药制剂中的动物类药材目前尚未见报道。本研究证明,以DNA条形码技术检验中药制剂中的动物类药材是可行的,且有需样量少、简单快速、重复性和稳定性高,且可通过现代技术平台实现与国际信息的共享等优点。但是,该技术对以整体动物入药的中药材是适用的,而对以某一器官入药的动物来讲,若以其他器官代用则容易导致检验错误,因此在具体工作中仍然需要配合使用其他方法,才能确保检验结果的准确性。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | Navinder J, Singh E J. Milner-Gulland. Monitoring ungulates in Central Asia:current constraints and future potential [J]. Fauna Flora Int, 2011, 45(1):38-49. |
| [3] | Hebe P D N, Stoeckle M, Zemlak T S, et al. Identification of birds through DNA barcode [J]. PLoS Biol, 2004, 2(10):1657-1663. |
| [4] | Kress W J, Wurdack K J, Zimmer E A, et al. Use of DNA barcodes to identify flowering plants [J]. Proc Natl Acad Sci USA, 2005, 2:8369-8374. |
| [5] | Paul D N H, Sujeevan R, Jeremy R. deWaard. Barcoding animal life:cytochrome coxidase subunit divergences among closely related species [J]. Proc R Soc Lond B, 2003, 270:96-99. |
| [6] | Hebert P D N, Cywinska A, Ball S L, et al. Bio-logical identifications through DNA barcodes [J]. Proc R Soc London Biol Sci, 2003a, 270:313-321. |
| [7] | Yancy H F, Zemlak T S, Mason J A, et al. Potential use of DNA barcodes in regulatory science:Applications of the regulatory fish encyclopedia [J]. J Food Prot, 2008, 71:210-217. |
| [8] | Chodon S, Damon P L, Dennis W, et al. DNA Barcoding in the Cycadales:testing the potential of proposed barcoding markers for species identification of Cycads [J]. PLoS One, 2007, 2(11):1-9. |
| [9] | 夏 至, 冯翠元, 高致明, 等. 黄芩及其同属近缘种的DNA条形码鉴定研究 [J]. 中草药, 2014, 45(1):107-112. |
| [10] | 石召华, 陈士林, 姚 辉, 等. 娑罗子基原物种的DNA条形码鉴定研究 [J]. 中草药, 2013, 44(18):2593-2599. |
| [11] | 陈士林. 中药DNA条形码分子鉴定 [M]. 北京:人民卫生出版社, 2012. |
| [12] | 陈士林, 宋经元, 姚 辉, 等. 药用植物DNA条形码鉴定策略及关键技术分析 [J]. 中国天然药物, 2009, 7(5):322-327. |
| [13] | 陈士林, 庞晓慧, 姚 辉, 等. 中药DNA条形码鉴定体系及研究方向 [J]. 世界科学技术-中医药现代化, 2011, 13(5):747-754. |
| [14] | Erickson D L, Spouge J, Resch A, et al. DNA barcoding in land plants:developing standards to quantify and maximize success [J]. Taxon, 2008, 57(4):1304-1316. |
| [15] | 李生华. 蒙药鲁曼12散的鉴别研究 [J]. 中国民族医药杂志, 2012, 9(9):36-37. |
| [16] | 金 卓, 丁 晴. 羚羊感冒胶囊中掺杂水牛角粉的鉴别 [J]. 安徽医药, 2007, 11(6):521-522. |
| [17] | 朴华英, 刘继平, 孙 朗. 羚羊清肺胶囊的质量标准研究 [J]. 中成药, 2001, 23(8):566-569. |
| [18] | 朱山寅. 息热静口服液的制备及质量控制 [J]. 中国药师, 2002, 5(10):600-601. |
| [19] | 梅 娇, 刘兴文. 脑血灵口服液制备方法改进及薄层色谱鉴别 [J]. 中国药业, 2011, 20(24):57-58. |
| [20] | 赵华英, 许欣荣, 陈永林, 等. 羚羊角及其伪品的蛋白电泳鉴别 [J]. 中国中药杂志, 1994, 19(9):524-525. |
| [21] | 洪 霞, 王利华. 中药显微定量的方法研究 [J]. 黑龙江医药科学, 2002, 25(3):40. |
| [22] | Chen S L, Yao H, Han J P, et al. Validation of the ITS2 region as a novel DNA barcode for identifying medicinal plant species [J]. PLoS One, 2010, 5(1):1-8. |
| [23] | Li D Z, Liu J Q, Chen Z D, et al. Plant DNA barcoding in China [J]. J System Evol, 2011, 49(3):165-168. |
 2014, Vol. 45
2014, Vol. 45


