2. 沈阳药科大学药学院, 辽宁 沈阳 110016
2. School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China
传统中药多采用口服给药方式,口服后药物所含成分或经消化道直接吸收入血;或经消化液、消化酶及肠内菌群的作用分解成次生代谢产物被吸收入血;或经肝微粒体酶代谢为活性代谢产物[1]。无论经过上述哪一种途径,其有效物质必须以血液为媒介输送到靶点,才能发挥相应的药效,因此,被吸收入血的成分才是中药的体内直接作用物质[2]。基于以上理论,日本学者田代真一于1988年提出了“血清药物化学”的概念[3]。近年来,血清药物化学研究方法引起了众多研究者的重视,并广泛将其运用于中药药效物质基础研究[4, 5, 6, 7, 8, 9],显示出了很好的应用前景。
栀子大黄汤(Zhizi Dahuang Decoction,ZDD)始载于《金匮要略》,由栀子、大黄、枳实、淡豆豉4味中药组成,是张仲景治疗酒黄疸的经典名方,现代临床应用广泛,对于酒精性肝炎、黄疸型肝炎、急慢性肝炎、急性胰腺炎、心系重症等具有确切疗效[10, 11, 12]。本实验室前期利用超快速液相色谱(UFLC)方法建立了ZDD的指纹图谱[13],但尚未见有关该方血清药物化学方面的研究。因此,本实验在前期体外分析的基础上,建立ZDD大鼠血清指纹图谱,初步确定其入血成分及其来源,从而为深入研究ZDD的效应物质奠定基础。
1 材料 1.1 实验仪器日本岛津LC—30AD UFLC色谱仪系统,包括二元高压梯度泵、在线真空脱气机、自动进样装置、SPD—20A型紫外检测器、柱温箱,LabSolutions色谱工作站;KQ—250DB数控超声波清洗器(昆山市超声仪器有限公司);AB135—S十万分之一天平(瑞士Mettler Toledo仪器有限公司);TGL—16高速台式冷冻离心机(沈阳杰龙仪器有限公司);XW—80A旋涡混合器(上海医科大学仪器厂);MTN—2800D氮吹浓缩仪(天津奥特赛恩斯仪器有限公司);VFD—2000真空冷冻干燥机(北京博医康实验仪器有限公司)。
1.2 试剂与药品色谱用乙腈和甲醇均购自美国Fisher公司,色谱用甲酸购自天津市科密欧化学试剂有限公司,水为二次蒸馏水,其他试剂均为分析纯。
对照品京尼平苷(批号110749-201115)、芦荟大黄素(批号110795-201007)和大黄酸(批号110757-200206)购自中国食品药品检定研究院,质量分数均大于98%。
栀子、大黄、枳实、淡豆豉药材均购自沈阳天益堂药店,经沈阳药科大学中药学院袁久志副教授鉴定栀子为茜草科植物栀子Gardenia jasminoides Ellis的干燥成熟果实,大黄为蓼科植物掌叶大黄Rheum palmatum L. 的干燥根和根茎,枳实为芸香科植物酸橙Citrus aurantium L. 的干燥幼果,淡豆豉为豆科植物大豆 Glycine max (L.) Merr. 的成熟种子的发酵加工品。
1.3 实验动物雄性SD大鼠,清洁级,体质量(200±20)g,由沈阳药科大学实验动物中心提供,实验动物生产许可证号SCXK(辽)2010-0001。将实验动物置于昼夜节律光照条件下,自由进食进水,室温在18~22℃,饲养1周以适应环境,每日触摸动物以适应实验人员的操作。
2 方法 2.1 体外供试品溶液的制备参照《金匮要略》原文,折合成现代剂量,按栀子-大黄-枳实-淡豆豉3∶1∶4∶8称取栀子(GJE)9 g、大黄(RPL)3 g、枳实(CAL)12 g、淡豆豉(SSP)24 g,用10倍量水浸泡30 min后,回流提取1 h,纱布滤过,药渣加10倍量水重复提取1次,合并2次滤液,经冷冻干燥制成ZDD冻干粉样品,密封置于干燥器中,备用。同法制备5批ZDD冻干粉样品,编号S1~S5,并计算各批次样品的出粉率(样品出粉率=所得冻干粉质量/生药总质量)。取ZDD冻干粉0.1 g(相当于生药约0.33 g),精密称定,置50 mL具塞碘量瓶中,加甲醇25 mL,称定质量,超声提取30 min后,放冷,再次称定质量,并用甲醇补足减失的质量,提取液经13 000 r/min离心10 min,上清液用0.22 μm微孔滤膜滤过,取续滤液作为体外供试品溶液。另按上述方法分别制备各缺味方及单味药的冻干粉样品及其体外供试品溶液。
2.2 混合对照品溶液的制备称取京尼平苷、芦荟大黄素和大黄酸对照品适量,精密称定,分别置于5 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,得各对照品储备液;精密吸取各对照品储备液适量,置于同一10 mL量瓶中,加甲醇稀释至刻度,摇匀,配制成质量浓度分别为京尼平苷500 μg/mL、芦荟大黄素4.1 μg/mL和大黄酸9.8 μg/mL的混合对照品溶液。
2.3 血清样品的采集取ZDD冻干粉适量,加水配成含生药1.6 g/mL的体内供试品溶液,同法制备各缺味方和单味药体内供试品溶液(浓度均按照ZDD药液浓度进行折算)。取雄性SD大鼠,禁食12 h(自由饮水),称体质量,随机分为10组,分别为空白组、ZDD全方给药组、4个缺味方给药组和4个单味药给药组,ZDD全方给药组5只,其余各组3只。空白组ig给予蒸馏水;ZDD全方给药组分别ig给予由5批ZDD冻干粉样品制备的体内供试品溶液;其余各给药组分别ig给予栀子、大黄、枳实、淡豆豉、缺栀子、缺大黄、缺枳实和缺淡豆豉方的体内供试品溶液。按照1 mL/100 g单次给药。各组分别于给药后1 h摘眼球取血,室温下静置30 min,然后在13 000 r/min条件下离心3 min,取上清液,-80 ℃冷藏备用。
2.4 血清样品的处理取血清2mL,加3倍量乙腈,涡旋混合5 min,离心(13 000 r/min)5 min,取上清液在氮气流下吹干(30 ℃),残渣加100 μL甲醇复溶,超声3 min,涡旋1 min,离心(13 000 r/min)3 min,取上清液,备用,供UFLC分析。
2.5 色谱条件色谱柱:Shimadzu Shim-pack XR-ODS(75 mm×3.0 mm,2.2 μm);流动相:乙腈(A)-0.1%甲酸水溶液(B);梯度洗脱:0~8 min,5%~8% A;8~21 min,8%~17% A;21~24 min,17%~18% A;24~33 min,18%~40% A;33~38 min,40%~90% A;体积流量1.0 mL/min;检测波长254 nm;柱温35 ℃;进样量5 μL。
2.6 方法学考察 2.6.1 精密度试验取同一份ZDD血清样品供试品溶液,连续进样6次,记录色谱图,结果各共有峰的相对保留时间的RSD均小于0.4%,相对峰面积的RSD均小于2.8%,表明仪器精密度良好。
2.6.2 重复性试验取同一批次ZDD血清样品,按上述血清样品处理方法制备6份供试品溶液,进样分析,记录色谱图,结果各共有峰的相对保留时间的RSD均小于0.8%,相对峰面积的RSD均小于3.0%,表明方法重复性良好。
2.6.3 稳定性试验将同一份ZDD血清样品供试品溶液,分别于0、2、4、8和12 h进样分析,记录色谱图,结果各共有峰的相对保留时间的RSD均小于0.6%,相对峰面积的RSD均小于3.0%,表明供试品溶液在测定的12 h内稳定性良好。
2.7 ZDD及其血清中成分的分析取3批ZDD体外供试品溶液,以及5批ZDD血清样品在相同的色谱条件下进样分析,建立UFLC色谱图,比较分析确定入血成分。进而,通过各缺味方、各单味药体外供试品溶液及其血清样品的测定,综合比较分析相应的色谱图,确定各入血成分的生药来源。
3 结果与讨论实验对最佳采血时间进行了考察,分别于ig后0.17、0.5、1、2、3、4 h取血,结果表明,给药后1 h的血清样品中,ZDD的血中移行成分最多,且各成分色谱峰响应值较高,最适于分析,因此,选定1 h为最佳采血时间。
通过指纹图谱的方法研究分析了ZDD的入血成分,结果表明,大鼠ig给予ZDD后血中出现了21个移行成分(图 1),与体外样品比较可知,其中9个为体外成分直接吸收入血,即2、7、8、13~15、17~19号峰所对应的成分为ZDD中所含的原型成分,而其他12个成分色谱峰推测为复方原型成分经代谢转化而生成的代谢产物。经与混合对照品溶液色谱图对照可知,原型成分中的2、18、19号峰分别为京尼平苷、芦荟大黄素和大黄酸。2和13号峰(原型成分)转运入血后的相对含量明显下降,其原因可能是二者在大鼠体内部分代谢转化为其他化学成分,例如,已有报道显示京尼平苷(2号峰)在肠道β-葡萄糖苷酶的作用下代谢为京尼平[14];而19号峰(大黄酸)入血后的相对含量则有较大的提高,分析其原因可能是其他蒽醌类成分在体内经肠道菌群代谢转化成为大黄酸,其代谢机制尚需进一步探讨。此外,ZDD体外样品中响应较高的原型成分I和II在血清样品中并未被检出,推测二者转运入血能力较弱或是在体内代谢为其他药效活性成分。
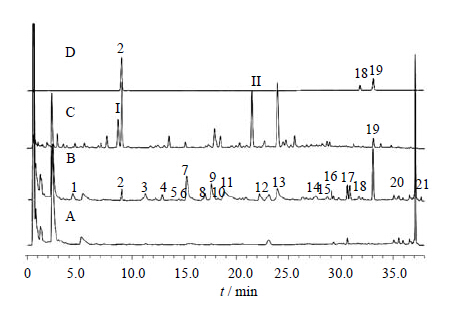 | 2-京尼平苷 18-芦荟大黄素 19-大黄酸,下图同 2-geniposide 18-aloe emodin 19-rhein,following figures are same图 1 空白血清 (A)、ZDD含药血清 (B)、ZDD (C) 和混合Fig. 1 UFLC of blank serum (A),serum after ZDD treatment (B),ZDD (C),and mixed reference substances (D) |
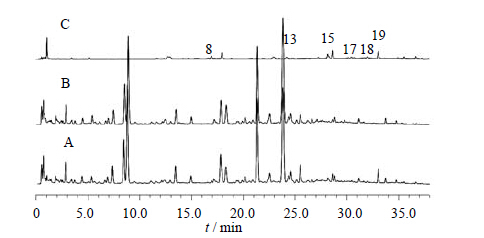
综合比较ZDD、ZDD缺味方及各单味药的体外样品和给药后血清样品色谱图可知(表 1):2号峰为栀子所含成分直接入血而形成,20号峰为栀子吸收入血后的代谢成分(图 2、3);15、17~19号峰为大黄所含成分直接入血而形成,10、12、16号峰为大黄入血后形成的代谢产物(图 4、5);6号峰为枳实所含成分入血代谢后产生(图 6、7);7号峰为淡豆豉所含成分直接入血而形成,3~5、11号峰为淡豆豉入血后形成的代谢产物(图 8、9);1、8、13号峰为大黄和枳实共同产生的入血成分;9号峰为大黄和淡豆豉中所含成分入血代谢产生;14号峰为枳实和淡豆豉共同产生的入血成分;21号峰为大黄、枳实和淡豆豉3味药材共同产生的代谢物。栀子虽为方中主药,但其对复方血中移行成分的贡献却相对较小,分析原因可能一方面是由于栀子所含成分多为极性较大的化合物,血清样品中受干扰较大,另一方面,推测栀子在ZDD中的作用并非主要依靠自身成分入血来发挥,而很有可能是通过调节其他组成药味中所含有效成分的溶出及转运入血来发挥药效。
| 表 1 血中各移行成分的药材归属与判断 Table 1 Medicinal material assignment and identification of blood transitional constituents |
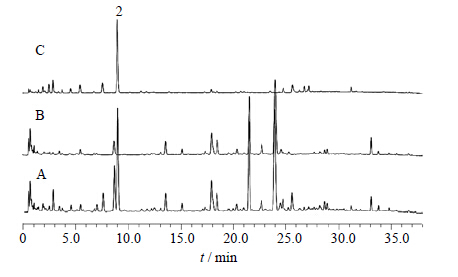 | 图 2 ZDD (A)、ZDD缺栀子 (B) 和栀子 (C) 体外供试品溶液的UFLC图Fig. 2 UFLCof in vitro samples of ZDD(A),ZDD decoction without GJE (B),and GJE decoction (C) |
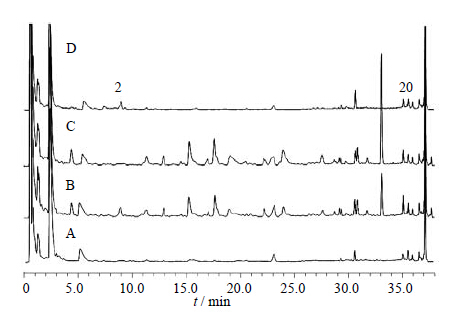 | 图 3 空白血清 (A)、ZDD含药血清 (B)、ZDD缺栀子含药血清(C) 和栀子含药血清 (D) 的UFLC图Fig. 3 UFLC of blank serum (A),serum after ZDD treatment (B),serum after ZDD treatment without GJE (C),and serum after GJE treatment (D) |
 | 图 4 ZDD (A)、ZDD缺大黄 (B) 和大黄 (C) 体外供试品溶液的UFLC图Fig. 4 UFLCof in vitro samples of ZDD(A),ZDD decoction without RPL (B),and RPL decoction (C) |
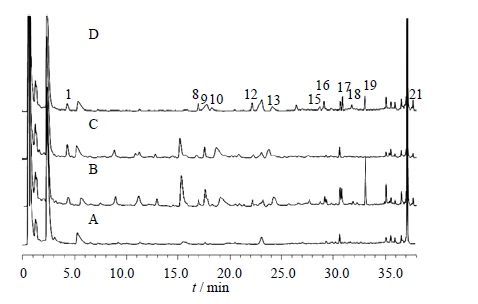 | 图 5 空白血清 (A)、ZDD含药血清 (B)、ZDD缺大黄含药血清(C) 和大黄含药血清 (D) 的UFLC图 Fig. 5 UFLC of blank serum (A),serum after ZDD treatment (B),serum after ZDD treatment without RPL (C),and serum after RPL treatment (D) |
 | 图 6 ZDD (A)、ZDD缺枳实 (B) 和枳实 (C) 体外供试品溶液的UFLC图Fig. 6 UFLCin vitro samples of ZDD (A),ZDD without CAL (B),and CAL (C) |
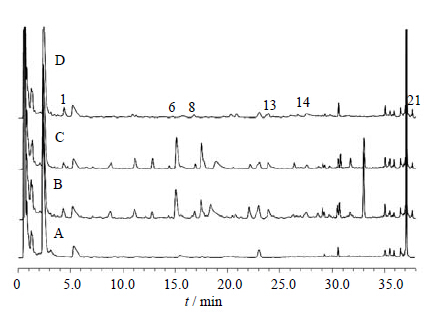 | 图 7 空白血清 (A)、ZDD含药血清 (B)、ZDD缺枳实含药血清(C) 和枳实含药血清 (D) 的UFLC图 Fig. 7 UFLC of blank serum (A),serum after ZDD treatment (B),serum after ZDD treatment without CAL (C),and serum after CAL treatment (D) |
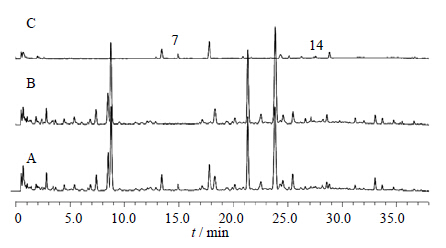 | 图 8 ZDD (A)、ZDD缺淡豆豉 (B) 和淡豆豉 (C) 体外供试品溶液的UFLC图Fig. 8 UFLCof in vitro samples of ZDD(A),ZDD without SSP (B),and SSP (C) |
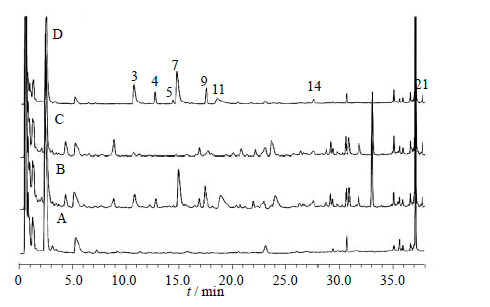 | 图 9 空白血清 (A)、ZDD含药血清 (B)、ZDD缺淡豆豉含药血清(C) 和淡豆豉含药血清 (D) 的UFLC图Fig. 9 UFLC of blank serum (A),serum after ZDD treatment (B),serum after ZDD treatment without SSP (C),and serum after SSP treatment (D) |
中药血清药物化学研究旨在通过血中移行成分的分析最终确定中药的药效物质基础。本实验依据中药血清药物化学研究思路,运用UFLC法对大鼠口服ZDD后的血中移行成分进行分析,初步阐明了ZDD含药血清中的部分化学成分及其来源,为该方体内药效物质的研究奠定了基础。然而,药物血清化学成分的分析存在着含量低、组分多、分离难的特点,LC法仅适用于血清中有紫外吸收的成分,且灵敏度较低,亦无法对代谢产物进行定性[6]。因此,有待于结合LC-MSn等更为灵敏的分析手段,进一步探究ZDD的体内效应物质。
| [1] | 杜武勋,朱明丹,肖学风,等. 复方中药药效物质基础研究及其今后应该注意的问题 [J]. 时珍国医国药,2013,24(3):692-694. |
| [2] | 王喜军. 中药及中药复方的血清药物化学研究 [J]. 世界科学技术-中药现代化,2002,4(2):1-4. |
| [3] | 贺玉琢. 日本汉方药"血清药理学"、"血清化学"的研究概况 [J]. 国外医学:中医中药分册,1998,20(5):3-7. |
| [4] | 吴芳芳,王喜军,韩 莹,等. 基于UPLC-HDMS技术的生脉散血清药物化学初步研究 [J]. 世界科学技术-中药现代化,2010,12(4):657-665. |
| [5] | 陶金华,狄留庆,濮雪莲,等. 通塞脉微丸血清药物化学的初步研究 (I) [J]. 中草药,2011,42(7):1267-1270. |
| [6] | 李文兰,陈 奇,白 晶,等. 基于HPLC-DAD-ESI/MS技术分析八珍汤在大鼠体内的代谢化学成分 [J]. 中国药学杂志,2011,46(6):422-425. |
| [7] | 罗志江,徐 彦,吴建英,等. 虎杖指纹图谱及其抗氧化活性的谱-效关系研究 [J]. 西南大学学报:自然科学,2012,34(1):138-143. |
| [8] | 孙 琴,马 丽,李 兰,等. 板蓝根中红细胞凝集效应组分的谱效关系研究 [J]. 中草药,2012,43(1):125-131. |
| [9] | 郭 辉,刘 晓,蔡 皓,等. 大黄附子汤血清药物化学初步研究 [J]. 中草药,2013,44(5):528-531. |
| [10] | 刘通英,张统水. 栀子大黄汤加减治疗黄疸45例 [J]. 中国中医药现代远程教育,2009,7(7):90. |
| [11] | 黄仰模,林昌松. 金匮要略临床发挥 [M]. 北京:科学出版社,2010. |
| [12] | 何庆勇. 栀子大黄汤治疗心系重症经验 [J]. 世界中西医结合杂志,2013,8(7):740-741. |
| [13] | 唐 峥,毕开顺,韩 飞,等. 栀子大黄汤UFLC指纹图谱研究 [J]. 中草药,2014,45(3):367-372. |
| [14] | Akao T,Kobashi K,Aburada M. Enzymic studies on the animal and intestinal bacterial metabolism of geniposide [J]. Biol Pharm Bull,1994,17(12):1573-1576. |
 2014, Vol. 45
2014, Vol. 45


