2. 中国中医科学院中药研究所, 北京 100700;
3. 西南交通大学生命科学与工程学院, 四川 成都 610031;
4. 河北大学药学院, 河北 保定 071002;
5. 中国药科大学药学院, 江苏 南京 210009
2. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China;
3. Life Science & Engineering College of South-west Jiao-tong University, Chengdu 610031, China;
4. College of Pharmacy, Hebei University, Baoding 071002, China;
5. Department of Pharmaceutics, China Pharmaceutical University, Nanjing 210009, China
千金子为大戟科植物续随子Euphorbia lathyris L. 的干燥成熟种子,具有泻下逐水、破血消癥的功效;用于二便不通、水肿、痰饮、积滞胀满、血瘀经闭;外治顽癣、赘疣等症[1]。现代研究表明千金子的药理作用主要有利尿、致泻、抗肿瘤、抗菌、镇痛、抗炎等作用[2]。千金子有小毒,对胃肠道有很强的刺激作用,可以产生峻泻,强度为蓖麻油的3倍,致泻成分为千金子甾醇[3],《中国药典》2010年版将千金子甾醇作为其定量测定指标[1],但其在肠道内的吸收和转运机制尚不明确,极大地限制了千金子在临床上的应用。
Caco-2细胞来源于人结肠癌上皮细胞,当其生长达到融合后细胞可自发分化形成极性,形成了具有紧密连接细胞单层,形态学上类似小肠吸收细胞。近几十年来,Caco-2细胞模型广泛用于研究药物在肠道中的吸收,是研究外源性化合物肠道吸收和毒性很好的体外模型[4]。本实验首次采用Caco-2细胞模型研究千金子甾醇的吸收机制,并研究时间、浓度、抑制剂对千金子甾醇转运的影响。
1 材料 1.1 细胞Caco-2细胞购于中国医学科学院基础医学研究所基础医学细胞中心。
1.2 试药与试剂MEM/EBSS培养液、0.25%胰蛋白酶(含EDTA)、0.01 mol/L磷酸盐缓冲盐(PBS)、胎牛血清(FBS)、非必需氨基酸(NEAA),均来源于Cellgro(美国Mediatech公司),青霉素-链霉素(Amresco,美国),二甲基亚砜(DMSO,Sigma,美国);碱性磷酸酶检测试剂盒(碧云天生物技术研究所);盐酸维拉帕米(中国食品药品检定研究院,批号100223-200102);千金子甾醇对照品(中国食品药品检定研究院,批号111789-200901);汉黄芩素(质量分数>98%,上海源叶生物科技有限公司,批号YS0925SA13),噻唑蓝(MTT,Sigma公司,美国);甲醇、乙腈为质谱纯;醋酸乙酯为分析纯,千金子甾醇样品(自提,质量分数>95%)。
1.3 仪器3111 CO2培养箱(Thermo公司,美国);HFease 1800生物安全柜(上海力康医疗设备有限公司);IX71倒置荧光显微镜(Olympus公司,日本),Eppendorf5810R高速冷冻离心机(Eppendorf公司,德国);Millicell-ERS跨膜电阻仪(Millipore公司,美国);M5多功能酶标仪(SpectraMax公司,美国),Transwell板3460(Corning公司,美国);DW—86L728医用低温保存箱(青岛海尔特种电器有限公司);UPLC-MS/MS(Waters公司,美国),Milli-Q纯水机(Millipore公司,美国)。
2 方法 2.1 细胞培养Caco-2细胞接种于25 cm2的细胞培养瓶中,加入5 mL MEM/EBSS培养基,含10%胎牛血清、1%非必需氨基酸、1%青霉素-链霉素(100 U/mL)双抗液。于37 ℃的5% CO2恒温培养箱中培养。隔3天换1次液,每4~7天用胰蛋白酶消化传代。
2.2 千金子甾醇细胞毒性实验采用MTT法检测不同浓度千金子甾醇对Caco-2细胞的毒性。取对数生长期的Caco-2细胞以1×105/mL的密度接种于96孔培养板,每孔体积为200 μL,按“2.1”项培养条件培养3 d。细胞分为实验组、阴性对照组和空白组,实验组加入不同浓度的千金子甾醇,使其终浓度为10、20、50、80、100、150、200 μmol/L(DMSO终体积分数<1%),空白组不加细胞仅加培养基,阴性对照组加入细胞、培养基和DMSO(终体积分数1%)。按“2.1”项下培养条件培养4 h后,每孔加入MTT(5 g/L)溶液20 μL,PBS溶液180 μL,37 ℃继续培养4 h,终止培养,小心吸弃上清液,每孔加入100 μL DMSO,振荡10 min,使结晶物溶解。用酶标仪在570 nm和630 nm处测定各组吸光度(A)值,实验重复3次。选取细胞存活率≥90%的药物浓度作为非细胞毒剂量,确定剂量范围,用于下一步实验[5]。

将消化后的Caco-2细胞混悬液接种于Transwell培养板的多聚碳酸酯膜中,细胞种植密度为4×104/mL,单层细胞于21~23 d分化形成,用跨膜电阻仪检测跨膜电阻,各孔跨膜电阻值均大于700 Ω·cm2[6],符合实验要求。
2.4 千金子甾醇的跨膜转运实验 2.4.1 样品溶液的配制精密称取样品千金子甾醇5.5 mg,用DMSO溶解至1 mL,配制成10 mmol/L的千金子甾醇储备液。用空白培养液稀释,配制成浓度为10、20、30、40、50 μmol/L(DMSO终体积分数<1%)的千金子甾醇溶液。
2.4.2 跨膜转运实验实验前测定每孔跨膜电阻值,弃去电阻值不符合要求的孔。对于药物从细胞绒毛面(AP)侧到基底(BL)侧的转运:移取含药培养液0.5 mL加入AP侧作为供给池,同时BL侧加入1.5 mL空白培养液作为接收池;对于药物从BL侧到AP侧的转运:将含药培养液1.5 mL加入BL侧作为供给池,空白培养液0.5 mL加入AP侧作为接收池。分别用10、20、30、40、50 μmol/L的千金子甾醇作为供试药物,将加好药物溶液和空白接收液的Transwell板置于37 ℃的5% CO2恒温培养箱中培养,分别在0.5、1.0、1.5、2.0、2.5 h从接收池中吸取200 μL接收液,同时补足相同体积的空白培养液,转运完后,测量各孔电阻,各孔跨膜电阻值均无明显差异,实验平行3次。
取接收液200 μL,加入5 μg/L汉黄芩素内标溶液50 μL,涡旋混匀3 min,加入500 μL醋酸乙酯涡旋3 min,12 000 r/min离心10 min,吸取上层醋酸乙酯400 μL,再加入500 μL醋酸乙酯涡旋3 min,12 000 r/min离心10 min,吸取上层醋酸乙酯500 μL,合并2次萃取液,氮气吹干,加200 μL流动相复溶,12 000 r/min离心15 min,用UPLC-MS/MS进行分析,计算表观渗透系数(Papp)。
2.4.3 P-糖蛋白(P-gp)抑制剂盐酸维拉帕米对千金子甾醇跨膜转运的影响实验前测定每孔跨膜电阻值,弃去电阻值不符合要求的孔。将含20 μmol/L盐酸维拉帕米的培养液0.5 mL加入AP侧孵育30 min,弃去盐酸维拉帕米溶液。AP侧加入药物浓度为30 μmol/L的培养液0.5 mL作为供给池,BL侧加入1.5 mL空白培养液作为接收池。其余操作同“2.4.2”项。
2.5 UPLC-MS/MS分析方法的建立 2.5.1 色谱条件ACQUITY UPLCTM BEH C18柱(50 mm×2.1 mm,1.7 μm);流动相为甲醇(A)-0.1%甲酸(B),梯度洗脱程序:0~0.5 min,30% A;0.5~0.8 min,30%~80% A;0.8~2.5 min,80% A;2.5~3.0 min,80%~30% A;体积流量0.4 mL/min,检测波长为275 nm,检测柱温度30 ℃,进样室温度4 ℃,色谱图见图 1。
 | 图 1 对照品+内标 (A) 和样品+内标 (B) 的总离子流图Fig. 1 Total ion chromatogram of reference substance + internal standard (A) and sample + internal standard (B) |
离子源为电喷雾电离源(ESI);离子化方式为正离子模式;扫描方式为多离子反应检测(MRM);千金子甾醇用于定量分析离子对为m/z 553→297,内标汉黄芩素定量分析离子对为m/z 285→270。
2.5.3 对照品储备液的配制精密称取千金子甾醇对照品5.5 mg,用DMSO溶解至1 mL,配制成10 mmol/L的千金子甾醇对照品储备液。
2.5.4 汉黄芩素内标溶液的配制精密称取汉黄芩素5.0 mg,用DMSO溶解至1 mL,配制成5 mg/mL储备液。精密吸取10 μL储备液,于10 mL量瓶中用甲醇定容至刻度,得5 mg/L内标溶液。吸取5 mg/L内标溶液10 μL,于10 mL量瓶中用甲醇定容至刻度,得5 μg/L内标溶液,备用。
2.5.5 汉黄芩素线性关系考察内标溶液的配制取千金子甾醇对照品储备液适量,用细胞培养液稀释至10、100、200、400、600、800、1 000 nmol/L(DMSO终体积分数<1%),取上述溶液200 μL与50 μL内标溶液混匀,按“2.4.1”项下处理。以浓度为横坐标,对照品与内标峰面积比为纵坐标,计算得线性方程Y=49.609 X-10.469,r=0.995 5;结果表明千金子甾醇在10~1 000 nmol/L线性关系良好。
2.5.6 精密度、重复性试验分别配制10、400、1 000 nmol/L低、中、高浓度对照品溶液,重复进样6次,结果浓度的RSD值分别为2.8%、3.4%、2.1%。分别配制低、中、高浓度样品溶液各6份,进样测定,结果浓度的RSD值分别为5.2%、3.5%、8.7%。
2.5.7 稳定性试验分别制备低、中、高浓度样品溶液各3份,在0、2、4、8、24 h进样测定,结果RSD值均在15%以内,表明千金子甾醇溶液在24 h内稳定[7]。
2.5.8 回收率和基质效应考察取空白培养液,用醋酸乙酯萃取,得醋酸乙酯萃取液,分别配制加有5 μg/L汉黄芩素内标的低、中、高浓度千金子甾醇样品(n=6),于30 ℃氮吹仪下吹干,加入流动相200 μL涡旋溶解,12 000 r/min离心10 min,取上清液进样测定,根据标准曲线获得浓度C1。用培养液分别配制低、中、高浓度千金子甾醇样品(n=6),按“2.4.2”项下方法处理,进样测定,根据标准曲线获得浓度C2。另取流动相配制低、中、高浓度的千金子甾醇溶液,按“2.4.2”项下方法处理,进样测定,根据标准曲线获得浓度C3。计算基质效应(C1/C3)和回收率(C2/C1)。低、中、高浓度千金子甾醇样品基质效应分别为109.0%、105.9%、102.1%,回收率分别为88.1%、89.2%、90.7%。
2.6 数据分析Caco-2细胞模型Papp值越大,通透率越高,按以下公式计算Papp和表观渗透率(PDR)[8]。

采取SPSS软件进行数据处理,用t检验对两组数据进行处理比较,结果均以x±s表示。
3 结果 3.1 千金子甾醇实验浓度的筛选千金子甾醇浓度为10~50 μmol/L时,培养4 h后细胞存活率均大于90%,表明千金子甾醇的安全浓度是0~50 μmol/L。
3.2 不同浓度千金子甾醇在Caco-2细胞模型上的吸收不同浓度千金子甾醇在Caco-2细胞模型上累积透过量随时间变化曲线见图 2和3。由AP侧→BL侧转运的变化曲线可以看出,千金子甾醇的初始浓度越高转运时间越长,其转运量也越高,即千金子甾醇的转运量与初始浓度和时间呈正相关,具有浓度和时间依赖性,表明千金子甾醇的跨膜转运机制至少有被动转运的存在。图 3为低、中、高浓度千金子甾醇由BL侧→AP侧转运的变化曲线,可以看出千金子甾醇10、30 μmol/L时,随时间的增加,累积透过量增加,而浓度为50 μmol/L时,在1.5 h后有趋于饱和的趋势,表明在由BL侧→AP侧转运的外排过程中可能有主动转运的参与。分别计算10、30、50 μmol/L浓度下的Papp值和PDR值,见表 1。结果表明10 μmol/L浓度时PDR值为1.35,小于1.5,而在30和50 μmol/L浓度时PDR值均小于1,表明此时以被动转运为主。综合上述结果千金子甾醇在Caco-2细胞模型中的转运以被动转运为主,并且可能有载体介导的药物外排。
 | 图 2 时间和浓度对千金子甾醇从AP侧到BL侧转运的影响Fig. 2 Effectsof time and concentration on transport of euphobiasteroid from AP side to BL side |
 | 图 3 不同浓度千金子甾醇从BL侧到AP侧透过量随时间变化趋势Fig. 3 Trends of euphobiasteroid with different concentration from BL side to AP side over time |
| 表 1 千金子甾醇Papp和PDR测定结果 Table 1 Determination of Papp and PDR values of euphobiasteroid. |
图 4为加入P-gp抑制剂盐酸维拉帕米后30 μmol/L千金子甾醇的累积透过量随时间变化的曲线,加入盐酸维拉帕米后,千金子甾醇跨膜转运速率和转运量明显上升,表明在P-gp抑制剂盐酸维拉帕米的作用下,P-gp的外排功能受到了抑制,外排作用减弱,千金子甾醇由AP侧→BL侧转运增加,表明千金子甾醇可能为P-gp的底物。表 2为2种情况下在150 min内整个转运过程的Papp值和PDR值,统计分析表明2种情况下PDR值无明显差异。
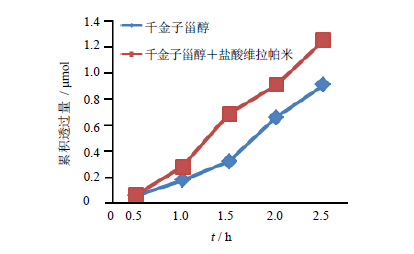 | 图 4 盐酸维拉帕米对千金子甾醇累积透过量的影响Fig. 4 Effectsof verapamil hydrochloride on cumulative permeation volume of euphobiasteroid |
| 表 2 盐酸维拉帕米对千金子甾醇Papp和PDR的影响 Table 2 Effectsof verapamil hydrochloride on Papp and PDR values of euphobiasteroid. |
吸收是药物发挥药效和产生毒性的关键环节,Caco-2细胞模型是目前国内外公认的研究药物肠吸收较理想的体外模型,该模型上存在多种药物代谢酶和部分主动转运蛋白,其中P-gp被普遍认为是药物转运的生化屏障,在药物的体内处置过程中发挥着重要的作用,可以更可靠真实地反映药物的吸收情况[9, 10, 11]。因此本实验通过Caco-2细胞模型研究千金子甾醇的吸收机制,对全面阐释千金子肠道毒性的作用机制有一定的借鉴意义。
不同浓度千金子甾醇的Papp均介于1×10−5~1×10−6,表明其在肠道中的吸收为中等吸收[12]。随着浓度的增加由AP侧→BL侧的转运量也增加,具有浓度依赖性。而对于由BL侧→AP侧的转运,低浓度时PDR>1,较高浓度时PDR<1,可以推测在千金子甾醇的转运过程中有主动转运的参与,此时主动转运和被动转运同时影响着千金子甾醇的吸收,随着浓度的增大,主动转运逐渐趋于饱和,此时千金子甾醇的吸收主要以被动转运主导。在加入外排转运蛋白P-gp抑制剂盐酸维拉帕米后,由AP侧→BL侧转运的Papp明显增加,进一步证实了千金子甾醇转运过程中主动转运的存在,而且这种主动转运的载体可能为P-gp。因而千金子甾醇在肠道中的吸收转运以被动转运为主,一定程度上又受到主动转运体的外排作用,但其主动转运机制还有待进一步研究。
| [1] | 中国药典[S].一部. 2010. |
| [2] | 孙洪峰. 千金子化学成分研究[D]. 长春: 吉林大学, 2009. |
| [3] | 江苏新医学院. 中药大辞典[M]. 第2版. 上海: 上海科学技术出版社, 1985. |
| [4] | Sambuy Y, Feruzza S, Ranaldi G, et al. Intestinal cell culture models: applications in toxicology and pharmacology[J]. Cell Biol Txicol, 2001, 17(4/5): 301-317. |
| [5] | 陈秀峰, 黄洁丽, 马骏. 呋塞米在Caco-2细胞单层模型中的跨膜转运研究[J]. 临床药学, 2008, 18(2): 59-61. |
| [6] | Guan M, Zhu Q L, Liu Y, et al. Uptake and transport of a novel anticancer drug-delivery sustem: lactosylnorcantharidin-associated N-trimethyl chitosan nanoparticles across intestinal Caco-2 cell monolayers[J]. Int J Nanomed, 2012, 7: 1921-1929. |
| [7] | 付洪瑜. 续随二萜酯药代动力学研究[D]. 广州: 广州中医药大学, 2013. |
| [8] | 高坤, 孙进, 何仲贵. Caco-2细胞模型在口服药物吸收研究中的应用[J]. 沈阳药科大学学报, 2005, 22(6): 469-474. |
| [9] | 杨秀伟, 郭洁, 徐嵬. 芍药苷类化合物在人源肠Caco-2细胞单层模型中的吸收转运研究[J]. 中草药, 2013, 44(15): 2097-2104. |
| [10] | 戚娟, 郭涛, 李海燕, 等. 黄连多组分在Caco-2细胞单层模型的吸收及其相互作用[J]. 中草药, 2013, 44(13): 1801-1806. |
| [11] | 刘薇, 杨珂, 王一飞, 等. UPLC法检测染料木黄酮在Caco-2单细胞层模型上的吸收特征[J]. 药物评价研究, 2013, 36(2): 127-131. |
| [12] | Yee S. In vitro permeability across Caco-2 cells (colonic) can predict in vivo (small intestinal) absorption in man-fact or myth[J]. Pharm Res, 1997, 14(6): 763-766. |
 2014, Vol. 45
2014, Vol. 45


