2. 中国人民解放军第三〇二医院, 北京 100039
2. 302 Military Hospital of China, Beijing 100039, China
灵芝为多孔菌科真菌赤芝Ganoderma lucidum (Leyss. ex Fr.) Karst. 或紫芝Ganoderma sinense Zhao,Xu et Zhang的干燥子实体。灵芝在我国已有悠久的药用历史,具有补中益气、扶正固本、滋补强壮、延年益寿等功效[1]。灵芝含有多种化学成分,其中灵芝三萜(GT)是灵芝的主要有效成分之一,主要包括灵芝酸、赤芝酸、灵芝醇、灵芝内酯等[2, 3, 4]。现代药理研究表明GT具有保肝、抗肿瘤、镇痛、抗氧化、抑制组胺释放等作用[5]。本课题组在前期研究中发现GT类化合物具有抗冻伤作用[6]。该类化合物有较高的脂溶性,理论上较易通过亲脂性的生物膜,但其溶解度小和溶出速率慢导致透皮吸收差,从而影响其药效的发挥。
纳米混悬凝胶(NS-gel)是基于纳米混悬体系的分子凝胶[7],即向纳米混悬溶液中加入凝胶剂形成透明稳定的三维网状结构。纳米混悬凝胶不但具有凝胶剂的生物相容性好、黏附性好、局部给药后易吸收,对皮肤和黏膜无刺激性等优点[8],而且具有纳米混悬剂的优势,如可提高难溶性药物的可润湿性、饱和溶解度及溶解速度[9]。
本实验为提高GT在皮肤局部的生物利用度,将其制成灵芝三萜纳米混悬凝胶剂(GT-NS-gel)。在本研究中,以卡波姆940为主要载体,卵磷脂为促渗透剂,制备GT-NS-gel,采用Box-Behnken设计-效应面法优化GT-NS-gel处方,并将优化的处方与灵芝三萜凝胶剂(GT-gel)在透皮吸收与皮肤滞留方面进行比较。 1 仪器与材料
UV—8453型紫外分光光度仪,美国安捷伦;透皮扩散池,北京金科利达电子科技有限公司;GYB40—10S高压均质机,上海华东高压均质机厂;JHBE—20A高速探头超声仪,河南金鼐科技发展有限公司;Winner801纳米激光粒度仪,济南微纳颗粒仪器股份有限公司;Design-Expert 8.0.5试验设计软件,卡贝信息技术有限公司。
灵芝子实体,由北京协和药厂提供(产地:浙江临安药材生产基地;批号20130301),经中国人民解放军第三〇二医院袁海龙研究员鉴定为赤芝Ganoderma lucidum (Leyss. Ex Fr.) Karst. 的干燥子实体;GT(自制,以灵芝酸A为对照品,经紫外分光光度计测定质量分数为78%);灵芝酸A对照品(质量分数大于98%,天津一方科技公司,批号101110);聚山梨酯80(Sigma公司,批号20131211)、Poloxamer F68(北京凤礼精求商贸有限责任公司,批号20120212);卡波姆940(广州博峰化学有限公司,批号20130902);三乙醇胺(天津市永大化学试剂有限公司,批号20130401);大豆卵磷脂(上海太伟药业有限公司,批号20140201);高氯酸(北京世纪拓鑫精细化工有限公司,批号20130401);丙二醇、香草醛、冰醋酸(北京化工厂,批号分别为20130325、20090508、20130618);Na2S(西陇化工股份有限公司,批号20111124)。
雄性SD大鼠,体质量(200±20)g,SPF级,由军事医学科学院实验动物中心提供,动物许可证号2012-(军)2012-0004。 2 方法与结果 2.1 GT-NS的制备
称取GT原料药3g、聚山梨酯80 0.6 g、Poloxamer F68 0.3 g,加入100 mL蒸馏水,充分搅拌混匀,13 300 r/min高速探头超声5次,每次1 min,在120 MPa条件下高压乳匀20圈,得质量浓度为30 mg/mL的GT-NS。 2.2 GT-NS的表征 2.2.1 粒径的测定
取适量GT-NS,加蒸馏水稀释。采用激光粒度仪测量GT-NS的粒径,重复3次。结果见图 1,结果表明GT-NS平均粒径为(283±7)nm(n=3),多分散度指数(PDI)为0.124±0.015(n=3)。
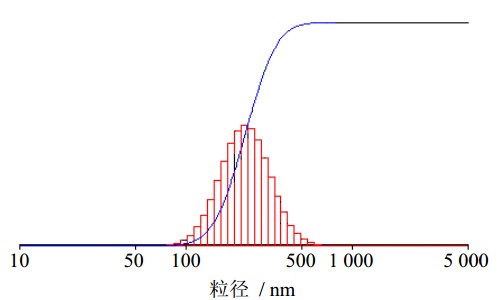 | 图 1 GT-NS的粒径分布图 Fig. 1 Particle size distribution of GT-NS |
取GT原料药和GT-NS加适量蒸馏水稀释后,然后滴加至锡箔纸上,常温条件下放置,待溶剂挥干后,于扫描电镜(SEM)下观察其形态并拍摄照片。结果见图 2。由图 2可见,GT原料药在扫描电镜下呈不规则块状,粒子大小在5~50 μm;GT-NS粒子大小较均匀。
 | 图 2 GT原料药 (A) 和GT-NS (B) 扫描电镜图 Fig. 2 SEM images of raw GT (A) and GT-NS (B) |
取20 mL GT-NS混悬液2份,分别加蒸馏水稀释至30 mL和60 mL,得质量浓度分别为20、10 mg/mL的GT-NS混悬液。各取纳米混悬液20 mL,加入溶胀24 h的卡波姆940(5~10 mg/g)、卵磷脂(0~80 mg/g)、丙二醇50 mg/g混匀后,边搅拌边加入20%三乙醇胺适量,调pH值至5.5~6.5,加适量蒸馏水至20 g,即得不同载药量的GT-NS-gel。 2.4 GT-gel的制备
GT-gel的处方与GT-NS-gel优化后处方相同,具体制备方法如下:取处方量的GT分散在蒸馏水中,加入溶胀24h的卡波姆940、卵磷脂及丙二醇混匀后,边搅拌边加入20%三乙醇胺适量,调pH值至5.5~6.5,加水使其载药量与优化后的GT-NS- gel相同,即得GT-gel。 2.5 UV法测定灵芝三萜[10]
精密称取灵芝酸A对照品10.4 mg置于50 mL量瓶中,加无水乙醇适量使溶解,定容,摇匀,即得0.208 mg/mL灵芝酸A对照品溶液。精密吸取灵芝酸A对照品溶液0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 mL,分别置10 mL具塞试管中(同时吸取无水乙醇0.8 mL作为空白对照),置沸水浴中挥干溶剂,再依次分别加入新配制的5%香草醛-冰醋酸溶液0.5 mL、高氯酸0.8 mL,密塞,置60 ℃水浴中加热15 min,取出,置冰水浴中冷却5 min,然后分别加冰醋酸5 mL,摇匀,以无水乙醇作为空白对照,在543 nm处测定吸光度(A)值,以灵芝酸A质量(μg)为横坐标(X),A值为纵坐标(Y),得到回归方程为Y=0.007 1 X-0.070 1,r=0.999 2,结果表明灵芝酸A在20.8~166.4 μg呈现良好的线性关系。 2.6 体外释放实验
采用Franz扩散池研究GT-NS-gel的体外释放情况。取单层透析袋(截留相对分子质量7 000)放置在供给池和接收池之间,用夹子将两者夹紧固定,接收池中加入新配的含20%乙醇的磷酸盐缓冲液(pH 6.8),使透析袋内表面完全浸润在其中,保证无气泡,扩散面积为1.77 cm2,接收池总体积为22.5 mL。设定温度(32.0±0.5)℃,转速500 r/min。供给池上方加入0.5 g GT-NS-gel后,开始计时。在给药24 h后取样1 mL,8 000 r/min离心10 min,取上清液,以空白接收液为对照,按照“2.5”项下方法测定并计算释放率。 2.7 体外皮肤滞留实验
取SD大鼠,乙醚麻醉后用10%的Na2S溶液脱去腹部毛,断颈处死后立即剪下腹部皮肤,除去皮下组织、血管及脂肪,用生理盐水反复冲洗。将皮肤固定在扩散池上,角质层朝上,用含20%乙醇的磷酸盐缓冲溶液(pH 7.4)作为接收液[11],转速为100 r/min,扩散面积为1.77 cm2,接收池总体积为22.5 mL,32 ℃水浴循环。取0.5 g GT-NS-gel紧密贴敷在鼠皮上。24 h后将皮肤从扩散池上取下,用棉签擦去残留制剂,用蒸馏水冲洗,滤纸吸干水分,剪下有效吸收皮肤面积,置于5 mL离心管中,用一定量的乙醇浸泡探头超声破碎,8 000 r/min离心10 min,取上清液,以空白接收液为对照,按照“2.5”项下方法测定并计算皮肤滞留量。 2.8 效应面法优化GT-NS-gel处方 2.8.1 实验设计与结果
在预试验及文献研究结果的基础上[12, 13],以卡波姆940的质量浓度(A)、载药量(B)和卵磷脂的质量浓度(C)为考察因素,以24 h GT-NS-gel体外累积释放率(Y1,最大值为优)和24 h皮肤滞留量(Y2,最大值为优)为指标,采用3因素3水平的Box-Behnken设计优化GT-NS- gel处方。实验安排及结果见表 1。
| 表 1 Box-Behnken试验安排及结果 Table 1 Experimental arrangement and results of Box-Behnken design-response surface methodology |
基于Box-Behnken实验设计的内容和结果见表 2。采用Design-Expert 8.0.5软件对表 2数据进行拟合分析,以Y1和Y2为指标进行二项式方程拟合,得到的二次多元回归方程分别为Y1=48.8-5.49 A+4.11 B-8.42 C+1.81 AB+0.22 AC-0.96 BC+3.44 A2-0.83 B2-2.99 C2(R2=0.983 5,校正R2=0.962 4,P<0.000 1);Y2=405.67-32.31 A+54.19 B+176.22 C+8.37 AB-3.61 AC+24.24 BC-57.55 A2+7.86 B2-70.96 C2(R2=0.983 5,校正R2=0.962 4,P<0.000 1)。
| 表 2 二次项回归方程系数显著性检验 Table 2 Significance of coefficients in second order regression equation |
2个拟合方程的相关系数说明该模型拟合程度良好,可对GT-NS-gel处方进行分析与预测。由表 2回归系数的显著性检验得到,模型Y1中卡波姆940的一次项、二次项,卵磷脂质量浓度的一次项、二次项,药物浓度一次项都达到显著水平(P<0.05),其他项不显著。模型Y2中卡波姆940的一次项、二次项,药物浓度一次项,卵磷脂质量浓度一次项、二次项都达到显著水平(P<0.05),其他项不显著。删除对指标无显著性影响的项,得到二项式方程如下:Y1=48.8-5.49 A+4.11 B-8.42 C+3.44 A2-2.99 C2(R2=0.983 5,校正R2=0.962 4,P<0.000 1);Y2=405.67-32.31 A+54.19 B+176.22 C-57.55 A2-70.96 C2(R2=0.983 5,校正R2=0.962 4,P<0.000 1)。 2.8.4 效应面分析
选择对各指标有显著影响的2个因素,另一因素设为中心点值,采用Design-Expert 8.0.5软件绘制相应的曲面图,见图 3。
 | 图 3 各因素对响应值影响的三维效应曲面图 Fig. 3 3D Response surface plot for effects of different factors |
图 3-A~C表明,卡波姆940的质量浓度、载药量和卵磷脂的质量浓度都是影响24 h GT-NS-gel体外累积释放率的主要因素(A,P<0.000 1;B,P=0.000 2;C,P<0.000 1)。体外累积释放率与卡波姆940的质量浓度和卵磷脂的质量浓度成负相关,与载药量成正相关。图 3-D表明,卡波姆940对24 h皮肤滞留量的影响随其用量而变化(A,P=0.021 2)。卡波姆940在用量小的范围内(5~7.5 mg/g),药物的滞留量变化不大,在用量大的范围(7.5~10 mg/g),用量增加,皮肤滞留量略有下降,在0.75 mg/g时滞留量最大。图 3-E表明,皮肤滞留量随着载药量的增大而增加(B,P=0.000 2)。图 3-F表明,磷脂的用量对24 h皮肤滞留量具有极显著影响(C,P<0.000 1),其用量越大,滞留量越大。 2.8.5 优选处方的预测与验证
采用Design-Expert 8.0.5实验设计软件,按Y1最大值,Y2最大值设定目标,得到的优选处方条件为A=5 mg/g,B=30 mg/g,C=47.2 mg/g。依据该处方制备了3批GT- NS-gel,测定各响应指标。模型对各指标的预测值Y1、Y2分别为57.37%和468.39 μg/cm2。实际测量值分别(56.28±2.16)%和(472.89±8.74)μg/cm2(n=3)。结果显示实际测量值与模型预测值接近,表明该模型的预测性良好。 2.9 优化GT-NS-gel与GT-gel的比较
先按照“2.7”项下“将皮肤固定在扩散池上……,32 ℃水浴循环”操作,然后分别取0.5 g GT-NS-gel和GT-gel紧密贴敷在大鼠皮肤上后,在1、2、3、5、7、9、12、24 h分别从接收池内取样5 mL,同时补充等量的接收液。所取样品8 000 r/min离心10 min,取上清液,以空白接收液作为对照,按照“2.5”项下方法测定并计算累积透过量(Qn)。Qn的计算按照以下公式进行。
Qn=(VrCn+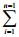 VsCi) / A
VsCi) / A
Qn为第n次取样时的累积透过量(μg/cm2),Vr代表接收液的体积(22.5 mL),Cn为每个取样点质量浓度(μg/mL),Vs为取样体积(5 mL),Ci为第i次取样测得的接收液中药物质量浓度(μg/mL),A为扩散渗透面积(cm2)
以Qn值为纵坐标,时间t为横坐标进行线性回归,所得方程分别为YGT-NS-gel=2.228 2 t+1.032 1(R2=0.968 3)及YGT-gel=0.685 3 t-0.524 8(R2=0.916 7),其斜率即为透皮速率常数Jss[μg/(cm2∙h)]。由方程可知JssGT-NS-gel=2.228 2 μg/(cm2∙h),Jss GT-gel=0.685 3 μg/(cm2∙h),GT-NS-gel的渗透速率是GT-gel的3倍多。
皮肤的滞留量按照“2.7”项下方法计算。结果见图 4。结果表明,24 h后GT-NS-gel和GT-gel的Qn分别为(50.73±4.97)μg/cm2和(14.79±3.45)μg/cm2,皮肤滞留量分别是(475.89±10.74)μg/cm2和(101.32±7.02)μg/cm2。可见,优化后的GT-NS-gel体外Qn和皮肤滞留量分别是GT-gel的3.43倍和4.70倍。
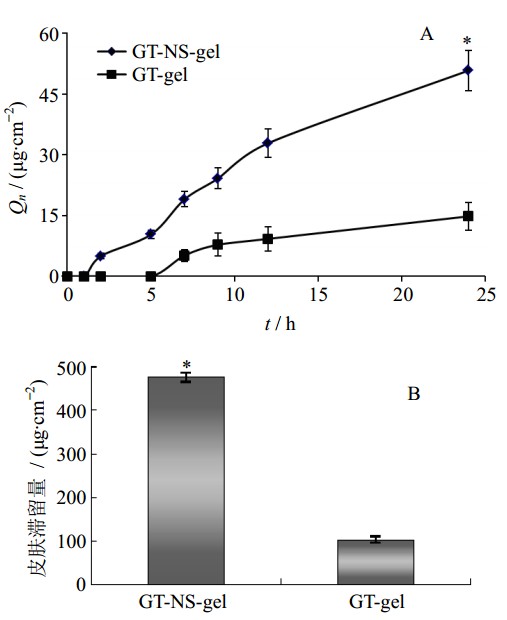 |
与GT-gel比较:*P<0.05 *P< 0.05 vs GT-gel 图 4 GT-NS-gel和GT-gel的体外透皮吸收 (A)和皮肤滞留量(B)(x±s n=3) Fig. 4 Amountof GT-NS-gel and GT-gel penetrating through skin (A) and in skin (B)(x±s n=3) |
卡波姆是一种常用的水溶性聚合物凝胶基质,当其与皮肤接触时,能够迅速润湿皮肤,增加皮肤的水合作用,有利于药物的吸收,其用量直接影响凝胶的黏度和释药性能[14]。在预实验中,0.5%~1%的卡波姆940形成的凝胶剂外观及黏度均合适。GT的加入量对其在凝胶中的分散均与程度和体外释放有影响。卵磷脂能改变角质层结构,促进药物在皮肤中滞留[12],因此本研究以卵磷脂为促透剂。丙二醇是常用的保湿剂[13],其常用量为5%~10%[15],所以本实验选择卡波姆940、载药量及卵磷脂用量为考察因素。药物从制剂中溶出是药物起效的第一步,GT治疗冻伤在局部起效,增加药物在皮肤的滞留量,有利于提高其局部生物利用度,因此,本实验选择24 h体外累积释放率和皮肤滞留量为考察指标。通过效应面法优化得到的处方具有良好体外释放和透皮滞留效果。
卡波姆940的用量增加,凝胶的黏度增加,阻碍药物的释放;药物包埋于凝胶内,凝胶内的磷脂不溶于水,也会阻碍药物释放;而凝胶内载药量增加使药物浓度梯度增大,可促进药物的释放。因此,GT体外累积释放率与卡波姆940的质量浓度和卵磷脂的质量浓度成负相关,与载药量成正相关。24 h皮肤滞留量随着卡波姆940用量的增加先变化不大之后略有下降,说明一定黏度的卡波姆940会阻碍药物的释放,进而进入皮肤的药量下降;皮肤滞留量随着载药量的增大而增加,药物用量增加使体外释放量增加,皮肤滞留量也随之增加;皮肤滞留量随着磷脂的用量增加而增加,一方面是因为磷脂能够破坏角质层的结构,使得皮肤的通透性增加,另一方面磷脂是皮肤细胞的重要组成部分,能够促进亲脂性的药物滞留在皮肤层。
在本研究中,GT-NS-gel 24 h药物累积透过量和皮肤滞留量分别为(50.73±4.97)μg/cm2和(475.89±10.74)μg/cm2,滞留量是透过量的9.38倍。将GT-NS-gel与GT-gel相比,24 h体外累积透过量增加了2.43倍,皮肤滞留量增加了3.70倍。说明将药物粒径降至纳米级别,不但提高了药物的饱和溶解度和溶出速率,而且增强与皮肤各层的黏附性,增加了滞留量[7]。将纳米混悬液进一步分散在凝胶基质中,可以减少纳米粒的聚集而增加稳定性。同时体系黏度的增加能够增加药物在皮肤表面的保留时间,有利于药物的经皮渗透和皮肤深层的滞留作用,将纳米混悬与凝胶剂结合,能够有效地增加药物在皮肤中的滞留量,提高药物在皮肤局部的生物利用度,以便其发挥抗冻伤作用。
| [1] | 陈若芸, 于德泉. 灵芝三萜化学成分研究进展 [J]. 药学学报, 1990, 25(12): 940-953. |
| [2] | 牛君仿, 方正, 王红庚, 等. 灵芝有效化学成分研究进展 [J]. 河北农业大学学报, 2002, 25(增刊): 51-54. |
| [3] | 王赛贞, 林冬梅, 林占熺, 等. RP-HPLC和UV-VIS法测定灵芝不同收获期的多糖肽和灵芝酸 [J]. 药物评价研究, 2012, 35(3): 190-193. |
| [4] | 董虹玲, 赵娜夏, 商倩, 等. 赤芝子实体中三萜酸类成分及其抗人乳腺癌SKBR3细胞增殖活性 [J]. 现代药物与临床, 2013, 28(2): 132-137. |
| [5] | 罗俊, 林志彬. 灵芝三萜类化合物药理作用研究进展 [J]. 药学学报, 2002, 37(7): 574-578. |
| [6] | 韩晋, 周旭, 袁海龙, 等. 复方灵芝乳膏对兔耳轻度冻伤治疗作用的初步研究 [J]. 中国药学杂志, 2012, 47(9): 689-692. |
| [7] | Venkataraman M, Nagarsenker M. Silver sulfadiazine nanosystems for burn therapy [J]. AAPS Pharm Sci Tech, 2013, 14(1): 254-264. |
| [8] | 张宁, 徐艳敏, 仁燕冬, 等. 外用凝胶剂研究进展 [J]. 黑龙江医药, 2010, 23(1): 92-93. |
| [9] | 岳鹏飞, 万晶, 胡鹏翼, 等. 中药固体化纳米混悬给药系统的研究进展与思考 [J]. 中草药, 2012, 43(4): 626-629. |
| [10] | 贺俊杰, 陈彦, 杜萌, 等. 灵芝多组分微乳一步制备方法的探索 [J]. 药学学报, 2013, 48(3): 441-446. |
| [11] | Li B, Ge Z Q. Nanostructured lipid carriers improve skin permeation and chemical stability of idebenone [J]. AAPS Pharm Sci Tech, 2012, 13(1): 276-283. |
| [12] | Bentley M V L B, Kedor E R M, Vianna R F, et al. The influence of lecithin and urea on the in vitro permeation of hydrocortisone acetate through skin from hairless mouse [J]. Int J Pharm, 1997, 146: 225-262. |
| [13] | 郭红叶, 伊博文, 闫小平, 等. 新型辅料卡波姆在凝胶剂中应用现状 [J]. 中国实验方剂学杂志, 2013, 19(17): 371-374. |
| [14] | 施海英, 陈钧, 费超群, 等. 水飞蓟宾缓释凝胶剂的制备及体外释药特性研究 [J]. 中成药, 2013, 35(3): 491-494. |
| [15] | 郭红叶, 闫小平, 伊博文, 等. 均匀设计法优选祛斑凝胶剂基质处方 [J]. 中国中药杂志, 2013, 38(23): 4076-4078. |
 2014, Vol. 45
2014, Vol. 45


