2. 国家中医药管理局中药炮制原理解析重点研究室, 辽宁 大连 116600;
3. 辽宁省中药炮制工程技术研究中心, 辽宁 大连 116600
2. Key Laboratory of Processing Theory Analysis of State Administration of TCM, Dalian 116600, China;
3. Engineering Technology Research Center of TCM Processing of Liaoning Province, Dalian 116600, China
五味子为木兰科植物五味子Schisandra chinensis (Turcz.) Baill. 的干燥成熟果实,收敛固涩,益气生津,补肾宁心[1]。《本草纲目》记载五味子“入补药熟用,入嗽药生用”,即五味子“生熟异用”。近年来关于五味子及其炮制品补益作用的研究有部分报道,主要是对免疫系统的影响[2]及抗衰老、抗氧化[3]等方面。明《本草经疏》载五味子“劳伤羸瘦,补不足,强阴,益男子精”,现代药理研究也证明五味子有补肾助阳的功效[4,5,6]。故本课题组对生、熟五味子的补肾阳作用进行研究,比较五味子、醋五味子、酒五味子对肾阳虚小鼠的影响,以说明五味子“入补药熟用”的炮制原理,为五味子“生熟异用”研究及临床合理应用提供依据。
1 材料 1.1 药品与试剂五味子,购自辽宁丹东大梨树五味子GAP基地,由辽宁中医药大学药学院王冰教授鉴定为木兰科植物五味子Schisandra chinensis (Turcz.) Baill. 的干燥成熟果实;醋五味子:取净五味子加米醋(100∶20)拌匀,闷润1.5 h,蒸制5 h,50 ℃干燥至恒定质量;酒五味子:取净五味子加黄酒(100∶20)拌匀,闷润1 h,蒸制4 h,50 ℃干燥至恒定质量;腺嘌呤(购自北京索来宝科技有限公司,批号201208012);桂附地黄丸(北京同仁堂药业,批号1016341);皮质醇、睾酮、肌酐(Cr)ELISA试剂盒(上海科兴商贸有限公司)。
1.2 动物昆明种雄性小鼠,体质量22~30 g,由大连医科大学实验动物中心提供,许可证号SCXK(辽)2008-0002,普通饲料,定时定量喂食,自由饮水。
1.3 仪器离心机(上海安亭科学仪器厂),分析天平(上海天平仪器厂),酶标仪(上海赛默飞世尔仪器有限公司),石蜡切片机(德国LEICA公司),BX51生物显微镜(日本奥林巴斯)。
2 方法 2.1 供试液制备五味子水煎液制备:取五味子粗粉,加10倍量水,浸泡0.5 h,回流提取3次,每次1 h,合并水煎液,浓缩,得五味子水煎液(含五味子醇甲0.40 mg/g),将水煎液分别配成22.5、45.0、90.0 mg/mL。
醋五味子、酒五味子水煎液制备:分别取醋五味子、酒五味子粗粉,同五味子水煎液制备方法制成醋五味子水煎液(含五味子醇甲0.42 mg/g)、酒五味子水煎液(含五味子醇甲0.45 mg/g)。
阳性对照药液制备:取桂附地黄丸,加纯净水制成67.5 mg/mL混悬液。
2.2 分组与给药将小鼠随机分为12组:对照组,模型组,桂附地黄丸(1.35 g/kg)组,生五味子低、中、高剂量(生药0.45、0.90、1.80 g/kg,其中低剂量相当于临床常用量)组,醋五味子低、中、高剂量(生药0.45、0.90、1.80 g/kg)组,酒五味子低、中、高剂量(生药0.45、0.90、1.80 g/kg)组,每组10只。除对照组ig等体积生理盐水外,其他组均ig腺嘌呤(150 mg/kg),连续15 d。造模成功后,桂附地黄丸组与五味子各给药组ig相应药液,对照组和模型组ig等体积生理盐水,给药体积20 mL/kg,连续20 d。每3天称体质量,记录观察精神行为状况。
2.3 检测指标末次给药后小鼠禁食不禁水,24 h后摘眼球取血,离心取血清,-20 ℃保存备用。严格按照试剂盒说明书提供方法,经过稀释、加样、温育、洗涤、显色后于450 nm处测定吸光度(A)值,计算皮质醇、睾酮、Cr水平。
分离小鼠精囊腺、睾丸、肾脏,将精囊腺、睾丸用生理盐水洗净,滤纸拍干,于分析天平称定质量,计算脏器指数(脏器指数=脏器质量 / 小鼠体质量×1 000)。肾脏与睾丸取材后,用福尔马林浸泡,经脱水、透明、浸蜡、包埋、脱蜡、染色等步骤制成病理切片,在显微镜下观察。
2.4 统计学分析数据均以x±s表示,应用SPSS 12.0统计软件进行单因素方差分析,组间比较采用t检验。
3 结果 3.1 小鼠一般情况观察模型组小鼠体毛疏松,蜷缩弓背,形体消瘦,反应迟钝,畏寒扎堆,小便增多,伴有“满月脸”,呈现较典型的肾阳虚症状,其肾脏多体积增大,颜色苍白,表面呈颗粒状。而对照组小鼠毛发整洁,活泼好动,眼睛有神,肾脏形态正常。各给药组中,桂附地黄丸组、酒五味子各剂量组、生五味子及醋五味子的中剂量组小鼠状态良好,与对照组相似;但生五味子、醋五味子的低、高剂量组有部分小鼠出现肾阳虚症状。
3.2 对肾阳虚小鼠血清皮质醇、睾酮和Cr的影响与对照组比较,模型组小鼠血清皮质醇、睾酮水平显著降低(P<0.01),Cr水平显著升高(P<0.01);与模型组比较,各给药组小鼠血清皮质醇、睾酮水平不同程度升高(P<0.05、0.01),Cr水平降低(P<0.05、0.01)。各炮制品中,酒五味子组效果最好,生五味子组与醋五味子组之间差异不显著;不同剂量组中,对皮质醇、睾酮的影响,均以中剂量组效果最好。结果见表 1。
| 表 1 五味子对肾阳虚小鼠血清皮质醇、睾酮、Cr水平的影响 (x±s,n=10) Table 1 Effectsof Schisandrae Fructus on levels of cortisol,testosterone,and creatinine in serum of kidney-yang deficiency mice (x±s,n=10) |
结果表明,与对照组比较,模型组小鼠的睾丸、精囊腺的脏器指数显著降低(P<0.05、0.01),各给药组小鼠脏器指数较模型组有明显改善,其中醋五味子组中、高剂量组对小鼠睾丸指数的影响最为明显(P<0.01),酒五味子的中、高剂量组及醋五味子的低剂量组对小鼠精囊腺的脏器指数影响较大(P<0.01)。结果见表 2。
| 表 2 五味子对肾阳虚小鼠睾丸和精囊腺脏器指数的影响(x±s,n=10) Table 2 Effectsof Schisandrae Fructus on viscera indexes of seminal vesicle and testicle of kidney-yang deficiency mice (x±s,n=10) |
对照组镜下所见肾脏结构清楚,肾小球结构形态完整,肾小管上皮细胞、管腔大小正常,肾小球系膜细胞稍增生,系膜区稍增宽。模型组镜下所见肾脏形态、结构破坏,肾小球萎缩,近端、远端小管不规则,管腔变大,结构模糊,肾小球内可见弥散性大量的炎性细胞,肾小球系膜细胞增生,系膜区增宽,被膜增厚。各给药组情况较模型组有所改善,但组间差异不十分明显,见图 1。
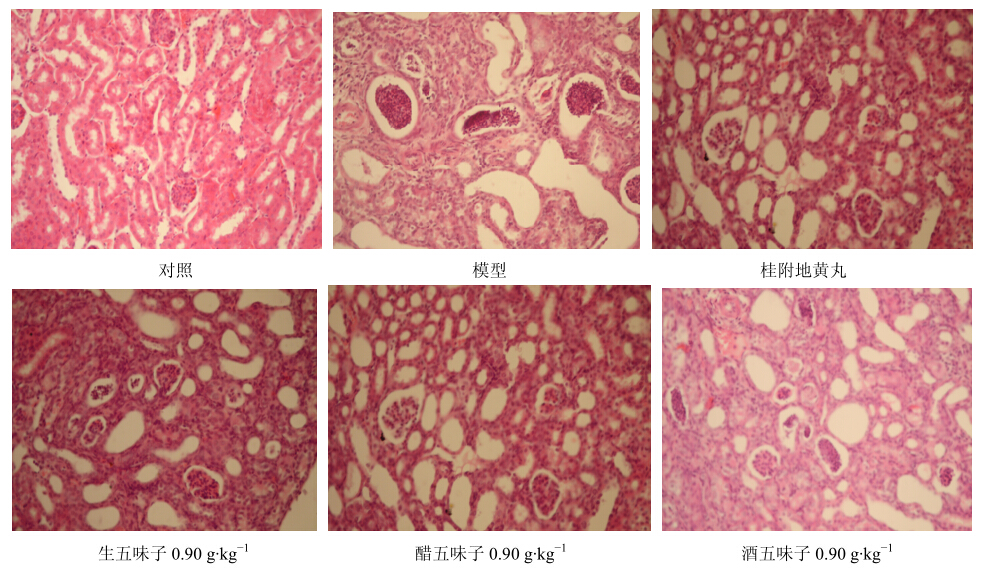
| 图 1 五味子对小鼠肾脏形态学改变的影响 Fig.1 Effect of Schisandrae Fructuson morphological changes in kidneys of mice |
对照组镜下所见睾丸组织形态、结构清晰完整,曲细精管上皮细胞排列紧密有序,横切面呈圆形或椭圆形,各期生精细胞形态大小正常,管腔内可见大量精子,各级生精细胞按次序规则排列于管壁上,染色质清晰,核仁明显,成熟的精子很多,支持细胞规则分布于生精细胞之间,睾丸间质少,间质细胞圆形或椭圆形,散在或群集于间质之中。模型组主要病理变化为管壁萎缩,生精细胞排列次序破坏,生精细胞变性、坏死以及变性的精子细胞或精母细胞融合形成多核巨细胞,间质渗出液增多,局灶性损害,呈特殊的“斑点样”表现,即病变与正常生精小管交错存在,主要表现为生精上皮退行性病变,细胞层数减少,排列疏松、紊乱,精子发生停滞,大量生精细胞脱落于管腔中。各给药组情况较模型组有所改善,但组间差异不十分明显,见图 2。
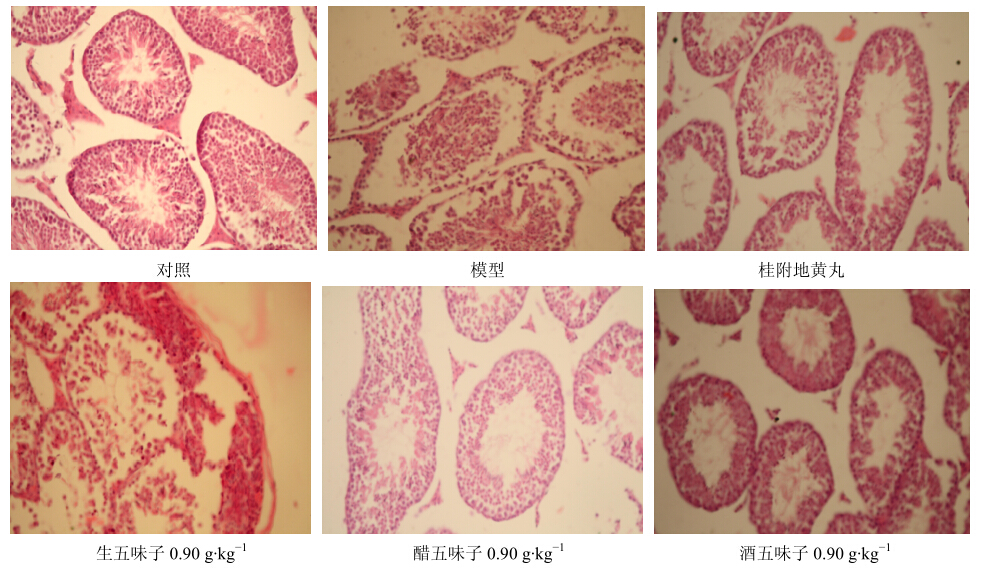
| 图 2 五味子对小鼠睾丸形态学改变的影响 Fig.2 Effect of Schisandrae Fructuson morphological changes in testis of mice |
五味子为临床常用中药,益肾固精,炮制后更有“入补药熟用”的记载。1977年以来历版《中国药典》收载五味子、醋五味子,而酒五味子为传统炮制品种,在唐宋时期就已有记载[7],在1963年版《中国药典》中有收载,同时也被现行《全国中药炮制规范》所收载,故本实验选择五味子、醋五味子、酒五味子进行比较研究。
腺嘌呤是广泛应用于临床的抗肿瘤类药物,是一种含氮杂环嘌呤类化合物,化学名为6-氨基嘌呤,是合成维生素B4(腺嘌呤磷酸盐)的主要原料,最终代谢产物为尿酸。研究表明,腺嘌呤可经消化道吸收入血,在肝内形成极难溶于水的2,8-二羟基腺嘌呤,2,8-二羟基腺嘌呤在肾内大量沉积形成结晶,阻塞、压迫肾小管引起肾小管上皮损伤和肾间质肉芽肿性炎症,晚期出现肾小管间质纤维化,造成肾功能损害[8]。经腺嘌呤诱导后的动物模型可出现食欲下降、饮水量增多、尿量增多、畏寒、体毛稀疏、失去光泽等,符合中医学肾阳虚的典型体征,是祖国医学广泛认可的肾阳虚证模型的诱导药物[9],优于糖皮质激素、甲状腺激素造模[10,11]。本实验中,给予腺嘌呤20 d后,模型组小鼠无论是外观状态,还是皮质醇、睾酮、Cr水平,以及精囊腺、睾丸脏器指数等均表明实验造模成功。
本研究结果表明五味子及其炮制品均能改善小鼠腺嘌呤中毒后的激素水平,并提高睾丸与精囊腺的脏器指数,其机制可能为改善睾丸的血液循环,增强睾丸功能,对下丘脑-垂体-肾上腺(HPA)轴有兴奋作用,从而皮质醇、睾酮水平升高,并减轻腺嘌呤对肾脏功能的损害,从而使Cr水平降低。
组织病理切片结果亦表明五味子及其炮制品对肾阳虚小鼠肾脏、睾丸具有一定程度的保护作用,但因实验周期较短,对于腺嘌呤所致的损伤,治疗作用不十分明显,今后研究中,可考虑适当延长实验周期,观察长时间给药后的治疗作用。
本研究表明,五味子各炮制品中,对性激素的影响(如皮质醇、睾酮),均为中剂量组最好,其原因可能为中药成分复杂,当中剂量时某种成分能够促进性激素分泌,而高剂量时,可能有另一种成分对性激素分泌有抑制作用,从而使整体作用降低,故五味子及其炮制品未表现出较明显的量效关系。提示在临床应用于治疗肾阳虚时应注意五味子剂量的确定。
对激素水平的影响研究表明,酒五味子作用最优。关于五味子“入补药熟用”之说见于明代,而醋五味子是近代新增品种,故古代“入补药熟用”的理论应该是指酒五味子,与本实验结果一致。提示在临床上用于治疗肾阳虚时,应首选酒五味子。
在今后的研究工作中,将对五味子补益作用的物质基础进行研究,为生制五味子的合理应用提供药理和化学方面的研究依据。
| [1] | 辛玲, 孙辉.硬紫草研究概况 [J].中国医药技术经济与管理, 2008, 11(2): 63-68. |
| [2] | 宋艳华, 孙辉, 张爱华, 等.紫草的研究进展 [J].中医药学报, 2013, 41(4): 985-987. |
| [3] | 李治建, 周凡, 斯拉甫·艾白, 等.紫草药理作用研究进展 [J].中国中医药信息杂志, 2010, 17(11): 110-113. |
| [4] | 黄志纾, 张敏, 马林, 等.紫草的化学成分及其药理活性研究概况 [J].天然产物研究与开发, 1999, 12(1): 73-81. |
| [5] | Papageorgioua V P, Assimopoulou A N, Sammanidou I N, et al.Recent advances in chemistry, biology and biotechnology of alkannin and shikonins [J].Curr Org Chem, 2006, 10(16): 2123-2142. |
| [6] | Papageorgiou V P, Assimopoulou A N, Couladouros E A, et al.The chemistry and biology of alkannin, shikonin, and related naphthazarin natural products [J].Angew Chem (Int Ed Engl), 1999, 38(3): 270-301. |
| [7] | Ghia J E, Blennerhassett P, Deng Y, et al.Ghia, Reactivation of inflammatory bowel disease in a mouse model of depression [J].Gastroenterology, 2009, 7(137): 2280-2288. |
| [8] | Keohane J, Mahony C, Mahony L, et al.Irritable bowel syndrome type symptoms in patients with inflammatory bowel disease: a real association or reflection of occult inflammation [J].Am J Gastroenterol, 2010, 105: 1789-1794. |
| [9] | Braegger C P, Nicholls S, Murch S H, et al.Tumour necrosis factor alpha in stool as a marker of intestinal inflammation [J].Lancet, 1992, 339(8785): 89-91. |
| [10] | Reimund J M, Wittersheim C, Dumont S, et al.Increased production of tumor necrosis factor-alpha interleukin-1 beta, and interleukin-6 by morphologically normal intestinal biopsies from patients with Crohn's disease [J].Gut, 1996, 39(5): 684-689. |
| [11] | Bischo V, Lorentz A, Schwengberg S, et al.Mast cells are an important cellular source of tumor necrosis factor á in human intestinal tissue [J].Gut, 1999, 44: 643-652. |
| [12] | Evans R C, Clarke L, Heath P, et al.Treatment of ulcerative colitis with an engineered human anti-TNF- alpha antibody CDP571 [J].Aliment Pharmacol Ther, 1997, 11: 1031-1035. |
| [13] | Yuan H, Ji W S, Wu K X, et al.Anti-inflammatory effect of diammonium glycyrrhizinate in a rat model of ulcerative colitis [J].World J Gastroenterol, 2006, 12: 4578-4581. |
| [14] | Rutgeerts P, Vermeire S, van Assche G.Biological therapies for inflammatory bowel diseases [J].Gastroenterology, 2009,7(136): 1182-1197. |
| [15] | Harpaz N, Polydorides A D.Colorectal dysplasia in chronic inflammatory bowel disease: pathology, clinical implications, and pathogenesis [J].Arch Pathol Lab Med, 2010, 134(6): 876-895. |
| [16] | De Silva S, Devlin S, Panaccione R.Optimizing the safety of biologic therapy for IBD [J].Nat Rev Gastroenterol Hepatol, 2010, 7(2): 93-101. |
| [17] | Staniforth V, Wang S Y, Shyur L F, et al.Shikonins, phytocompounds from Lithospermumerythrorhizon, inhibit the transcriptional activation of human tumor necrosis factor a promoter in vivo [J].J Biol Chem, 2004, 7(279): 5877-5885. |
| [18] | 中国药典 [S].一部.2010. |
| [19] | Morris G P, Beck P L, Herridge M S, et al.Hapten-induced modelof chronic inflammation and ulceration in the rat colon [J].Gastroenterology, 1989, 96: 795-803.[20] Shorter R G, Huizenga K A, Spencer R J.A workinghypothesis for the etiology and pathogenesis of nonspecific inflammatory bowel disease [J].Am J Dig Dis, 1972, 17: 1024-1032. |
 2014, Vol. 45
2014, Vol. 45


