2. 福建农林大学园林学院, 福建 福州 350002
2. College of Landscape Architecture, Fujian Agriculture and Forestry University, Fuzhou 350002, China
草珊瑚(又名肿节风、九节茶、接骨木)为常用中药,系金粟兰科(Chloranthaceae)草珊瑚属Sarcandra Gardn.植物草珊瑚Sarcandra glabra (Thunb.) Nakai的全草[1],主要分布于福建、浙江、江西、安徽等省区[2, 3]。草珊瑚是一种广谱中药材,全株可入药,具有很高的药用价值。《中国药典》2005年版列为法定药材使用,同时,以草珊瑚为原料的草珊瑚片、血康口服液、复方草珊瑚含片也已收入《中国药典》2010年版,草珊瑚注射液被部颁标准中药14册收载,还被广泛应用于食品、饮料、保健品、日用化工等方面,随着用途的日益拓宽,草珊瑚原料需求不断增加,市场前景十分广阔。近几年来,草珊瑚野生资源急剧减少,药材质量参差不齐,因此对其进行质量鉴定,收集优良种质,通过人工栽培提高草珊瑚药材来源的稳定性是保障草珊瑚资源可持续利用,以及相关制药业可持续发展的必然要求[4]。而目前草珊瑚相关研究主要集中在生物活性成分分析方面,运用DNA指纹图谱的方法进行其药效成分与遗传多态性的相关性研究尚未见报道,而DNA分子水平评价可以从遗传背景出发判断种质材料之间的差异,为种质资源的评价提供更加稳定、可靠的参考依据,还可为进一步分子辅助育种,及其药物有效成分代谢相关基因的定位奠定基础。因此很有必要进行其DNA指纹图谱与其活性成分相关性的分析。
简单序列重复区间扩增多态性分子标记(inter-simple sequence repeat,ISSR)是近年来发展起来的十分有效的分子标记技术,具有稳定、多态性高,简便及易操作等优点,被视为理想的遗传标记方法[4]。目前已在多种动植物的亲缘关系、种质鉴定、遗传作图、基因定位、遗传多样性等研究方面得到应用[4, 5, 6, 7, 8, 9]。传统药用植物种质资源的鉴定评价方法依赖于宏观特征,如叶片形状等,但可用的形态性状少且受环境影响大,因此需要高效、准确、不受环境因素影响的鉴定技术。ISSR技术不会受到环境因素的影响,因此在中药材真伪品种的鉴定和道地药材的鉴别上有很大的优势[10]。
本实验以ISSR多态性谱带为基础,利用Excel程序,绘制出18份草珊瑚种质资源的DNA指纹图谱,并进行其DNA指纹图谱与其品质相关性的分析,为进一步的分子辅助育种及药物有效成分代谢相关基因的分析进行初步的探讨。
1 仪器与材料PCR仪(Eppendorf,型号5332),电泳系统(北京市六一仪器厂,型号DYY—12),低温冷冻离心机(Eppendorf,型号5810R),凝胶成像分析仪(BIO-RAD ChemiDoc XRS),微量移液器(Eppendorf)。
CTAB提取液,TAE缓冲液,琼脂糖(Promega公司),溴化乙锭(Fluka公司),DNA Taq聚合酶(Takara公司),三氯甲烷、无水乙醇、异丙醇均为国产分析纯。
本研究实验样品是由福建中医药大学梁一池教授鉴定并收集的采自不同产地的18批样品,为金粟兰科植物草珊瑚Sarcandra glabra (Thunb.) Nakai,集中种植于福建中医药大学时珍园,本课题组已通过HPLC特征指纹图谱分析方法对这18个草珊瑚样品的7个活性成分进行了分析[11],并按优、良、中、差把18个样品进行了分级,随机编号,见表 1。
|
|
表 1 18份样品信息 Table 1 Basic information of 18 samples |
采取样品的嫩叶,采用本研究室改良的CTAB法提取草珊瑚幼嫩叶片的基因组DNA,用1%琼脂糖凝胶电泳检测。然后对所提取的草珊瑚DNA进行纯化。
2.2 多态性ISSR引物筛选及供试材料的ISSR分析以18个样品的基因组DNA为模板,对UBC801~900共100个ISSR引物进行多态性筛选,ISSR引物购自上海生工生物技术有限公司。在冰上建立20 μL的ISSR-PCR反应体系:40 ng模板DNA、0.2 mmol/L dNTPs、2.5 mmol/L Mg2+、1.0 U Taq DNA聚合酶、0.4 μmol/L引物。ISSR-PCR扩增程序为94 ℃预变性5 min;94 ℃45 s,31~50 ℃ 1.5 min,72 ℃1.5 min,35个循环;72 ℃10 min;10 ℃保存。退火温度因扩增产物的效果而调整。PCR产物经1.8%的琼脂糖凝胶电泳分离,EB染色检测。然后对18份草珊瑚样品进行标记分析,获得扩增谱带。
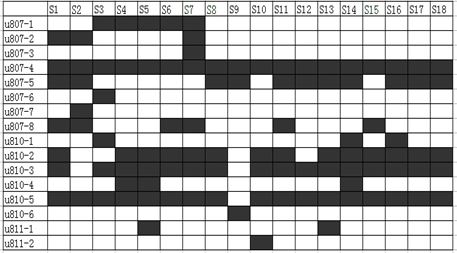
2.3 扩增带谱的编号及草珊瑚DNA指纹图谱的绘制对于18份草珊瑚样品的ISSR 扩增谱带,只分析清晰可辨的电泳条带。对于每条ISSR引物的扩增产物,按照扩增条带的相对分子质量从大到小编号和读取。如引物UBC807扩增出相对分子质量最大的条带编为u807-1,以此类推,将PCR扩增谱带以Excel表格中黑框表示,把电泳结果的图形资料转换成Excel表格中的黑白框的带谱图资料,将每个ISSR引物对18份草珊瑚样品的扩增结果记录为一张Excel表格,以方便进行运算分析。通过运算分析,构建出可以辨别18份草珊瑚资源的DNA指纹图谱。
2.4 草珊瑚DNA指纹图谱与质量相关性分析为寻找与质量级别相关性的特征条带,即只在特定某一级别或某一级别以上的样品中出现的条带,对所获得的所有多态性谱带逐一与18份草珊瑚样品的质量级别进行对比分析,筛选与某一质量级别相关性的特殊条带。
3 结果与分析 3.1 供试材料DNA提取与多态性ISSR引物筛选采用本实验室已建立的改良CTAB法提取草珊瑚总DNA,采用已优化的ISSR-PCR扩增体系,以S1~S18共18份草珊瑚样品的基因组DNA为模板,对UBC801~UBC900共100个ISSR引物进行多态性筛选,采用1.8%的琼脂糖凝胶电泳分离扩增产物,共选出23个多态性较理想的ISSR引物(表 2)。
|
|
表 2 23条ISSR引物扩增条带数与多态性比率 Table 2 Numbers and ratios of polymorphic bands amplified by 23 ISSR primers |
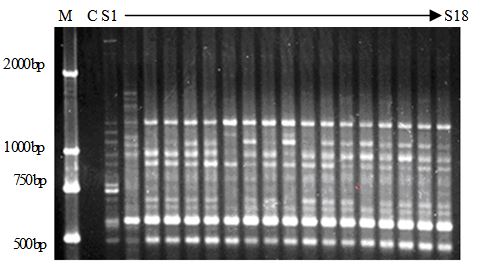
利用筛选出的23条多态性引物对18个草珊瑚样品进行ISSR分析,图 1为引物UBC881对18个草珊瑚样品的扩增结果。从图中可以看出,18个草珊瑚样品的ISSR-PCR扩增条带清晰,可将部分不同产地的草珊瑚样品区分开。对于ISSR扩增谱带,只分析清晰可辨的电泳条带。结果表明,23条多态性ISSR引物,共扩增出198条谱带,平均每个引物扩增出8条谱带,其中多态性谱带184条,多态性条带比率为92.9%,表明供试的草珊瑚资源遗传多样性较丰富。根据ISSR-PCR扩增电泳结果,对每条引物将18个草珊瑚样品的PCR扩增谱带以Excel 表格中黑白框表示(图 2),在Excel 表格中依次录入23条ISSR引物扩增结果,以方便进行后续的各种分析,在筛选出的23个ISSR多态性引物中,单条引物不能完全区分18个草珊瑚样品,每个多态性引物分别能扩增出3~15条多态性条带,如引物UBC825能扩增出15条多态性条带,不同引物能够区分的草珊瑚资源数不同。
|
图 1 18个草珊瑚样品UBC881引物扩增结果
Fig. 1 Amplification results of primer UBC881 in 18 S. glabra resources
M-Marker C-阴性对照 S1~S18-草珊瑚样品 M-Marker C-negative control S1—S18-S. glabra sample |
|
图 2 扩增谱带筛选绘制的部分结果图
Fig. 2 Screening results of amplified bands
黑框表示含有引物条带,下图同 Blank means primer strap |
由于没有筛选到单独一条引物可以直接鉴别18个草珊瑚样品,利用所有带谱以黑白框的形式录入Excel表格所形成的汇总表,分析扩增产物多态性条带的数量和所能区分的样品数目,选用UBC811、UBC825引物中的7个位点为一个组合,UBC827、UBC834、UBC842共3条引物中的7个位点为另一个组合,分别建立了2张可以区分18个供试草珊瑚样品的基因组的DNA指纹图谱,所构建指纹图谱见图 3。构建DNA指纹图谱的5个ISSR引物的有关信息见表 2。

|
图 3 18份草珊瑚样品的基因组DNA指纹图谱标准模式图 Fig. 3 Standard mode images of genome DNA fingerprints of 18 S. glabra samples |
通过HPLC特征指纹图谱分析方法对这18个草珊瑚样品的7个活性成分进行分析,并按优、良、中与差把18个样品进行了分级,见表 1。为寻找与质量级别相关性的特征条带,即只在特定的某一级别或某一级别以上的样品中出现的条带,以分析特征条带与活性成分的相关性,对所获得的184条多态性谱带逐一与18个草珊瑚样品的质量级别进行对比分析,筛选得到u844-6条带与样品质量有一定相关性,只在中、高质量级别的S6及S9样品中出现该条带,而不在差级别的样品中出现,但没有筛选获得能够完全鉴别某一等级的特异性条带,而这一相关性的条带是否具有特异性,还必须进一步进行研究确认。
4 讨论本研究只选取清晰可辩的ISSR-PCR扩增条带进行统计分析,以确保分析结果的可靠性。ISSR在不同品种间扩增效果存在较大差异,不同引物在受试样品中,最高可扩增出15条带,最低的只扩增出5条带,其中没有筛选到一条引物可以完全区别18个供试样品,为降低成本和提高检测效率,在构建DNA指纹图谱时,遵循利用尽量少的引物及标记分开尽量多的品种原则,从所获得的所有带谱中筛选标记多态性较好的引物及标记,组成了只需2个引物7个标记,或3个引物7个标记的DNA指纹图谱。
另外,本研究尝试利用筛选到的多态性引物对其DNA指纹与其品质的相关性进行分析,初步筛选到与受试的草珊瑚品质具有一定相关性的条带,但是由于样本量比较少,这些条带是否具有特异性,需要进一步分析,一是可以通过扩大样本量进行分析,二是可以通过选出活性成分差异最大的2份个体进行杂交,通过后代群体的品质变异与相关性条带的分析,进行确认或重新筛选与分析。由于ISSR标记利用的是非特异引物,其扩增条带的稳定性是相对的,如在进一步的研究中可以确认与其品质紧密相关的标记,可将ISSR标记中特异性的多态性条带回收、克隆和测序,然后转化成SCAR标记。
本研究尝试为受试的草珊瑚种质资源的评价提供DNA指纹的参考依据,并对进一步利用这些资源进行分子辅助育种,或其药物有效成分代谢相关基因的定位进行初步探讨。
| [1] | 中国植物志编辑委员会. 中国植物志 (第二十卷)[M]. 北京: 科学出版社, 1982. |
| [2] | 周浙昆. 金粟兰科的起源、演化及其分布[J]. 云南植物研究, 1993, 15(4): 3212-3311. |
| [3] | 徐珞珊, 徐国钧. 中国药材学[M]. 北京: 中国医药科技出版社, 1996. |
| [4] | 倪开诚, 闵 芳, 郭卫东, 等. 采用ISSR分子标记进行草珊瑚8个种源的遗传多样性分析[J]. 中草药, 2008, 39(9): 1392-1396. |
| [5] | 徐 莉, 赵桂仿. 微卫星DNA标记技术及其在遗传多样性研究中的应用[J]. 西北植物学报, 2002, 22(3): 714-722. |
| [6] | 张青林, 罗正荣. ISSR及其在果树上的应用[J]. 果树学报, 2004, 21(1): 54-58. |
| [7] | 潘敏慧, 冯振月, 田志强, 等. 家蚕胚胎细胞系的DNA指纹图谱分析[J]. 分子细胞生物学报, 2006, 39(6): 537-543. |
| [8] | 阳 翠, 刘 萍, 刘姣蓉, 等. 苦豆子ISSR标记的遗传多样性分析[J]. 中草药, 2013, 44(10): 1323-1327. |
| [9] | 王果平, 樊丛照, 李晓瑾, 等. 基于ISSR的新疆贝母属植物遗传多样性研究[J]. 中草药, 2013, 44(7): 887-890. |
| [10] | 李 婷. 枇杷叶的ISSR遗传差异分析及化学成分含量相关性[M]. 福州: 福建中医药大学, 2011. |
| [11] | 林培玲, 曾建伟, 梁一池, 等. 草珊瑚药材HPLC特征指纹图谱研究[J]. 中国中药杂志, 2013, 38(6): 856-860. |
 2014, Vol. 45
2014, Vol. 45


