2. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001;
3. 中国人民解放军军事医学科学院微生物流行病研究所 免疫学研究室, 北京 100071
2. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China;
3. Department of Immunology, Institute of Microbiology and Epidemiology, Academy of Military Medical Sciences, Beijing 100071, China
手足口病是一种由病毒引起的儿童传染病,A16型柯萨奇病毒(human coxsackievirus A16 strain,CoxA16)是主要的感染源之一[1]。CoxA16常引起患儿口腔和四肢等部位出现疱疹,同时合并高热。患儿若没有得到及时而有效的治疗,CoxA16可进一步感染中枢神经系统[2]和呼吸系统[3,4],进入重型/危重型感染阶段,该阶段的患儿有较大的致残或致死风险。针对CoxA16感染,目前并没有特效药物或疫苗获批上市,通常采用对症治疗的思路对患儿进行救治;因此,开发对CoxA16具有治疗作用的药物十分必要。
热毒宁注射液是江苏康缘药业股份有限公司研发的中药注射液,由青蒿Artemisia annua L.、栀子Gardenia jasminoides Ellis和金银花Lonicera japonica Thunb. 3味中药组成,具有清热、疏风、解毒的功效,常用于外感风热所致感冒、咳嗽,症见高热、微恶风寒等症。大量的临床观察数据表明,热毒宁注射液对手足口病具有明确的疗效[5,6,7,8,9],因此,该制剂先后被卫生部和国家中医药管理局纳入《手足口病诊疗指南(2010年版)》和《中医药治疗手足口病临床技术指南(2012年版)》;然而,目前关于热毒宁注射液抗CoxA16作用的临床前研究尚不多见。因此,本研究围绕热毒宁注射液对CoxA16的体内外抗病毒作用进行了评价,为其临床应用提供依据。
1 材料 1.1 细胞非洲绿猴肾细胞(Vero),由中国人民解放军军事医学科学院微生物流行病研究所免疫学研究室提供。取传代次数为130~145的细胞用于实验。
1.2 实验动物5日龄SPF级ICR乳鼠,体质量2.8~3.5 g;购自北京华阜康生物科技股份有限公司,合格证号11401300003923,许可证号SCXK(京)2009-0007。动物实验过程的所有操作都按照中国科技部2006年颁布的《关于善待动物的指导性意见》进行。
1.3 药物热毒宁注射液,由江苏康缘药业股份有限公司提供,每瓶含生药2.6 g/mL,批号12024,临用前用M199培养基(体外实验用)或生理盐水(体内实验用)配制;利巴韦林注射液,购自山东鲁抗辰欣药业有限公司,批号11092910411,临用前用生理盐水配制。
1.4 病毒CoxA16,TS10/08,GenBank登录号JX068829,由中国人民解放军军事医学科学院微生物流行病研究免疫学研究室提供。病毒临用前用M199培养基(含2.5%胎牛血清)稀释至75 TCID50或50 TCID50(体外实验)以及1×106 TCID50(体内实验)。
1.5 试剂M199培养基,购自Hyclone公司,批号NYG0924;胎牛血清,购自Gibco公司,批号8131650。MTS细胞增殖定量检测试剂盒,购自Promega公司,批号0000064219;生理盐水(0.85% NaCl),由中国人民解放军军事医学科学院微生物流行病研究所科研条件处提供。
1.6 仪器Multiskan FC微孔板读数仪,购自Thermo Scientific公司;CK40—F200倒置显微镜,购自Olympus公司;MCO—15AC二氧化碳培养箱,购自Forma Scientific公司;NU—440—600E生物安全柜,购自NUAIR公司。
2 方法 2.1 MTS法考察热毒宁注射液对Vero细胞的毒性Vero细胞接种于96孔板,每孔约10 000个细胞,Vero细胞分别以M199培养基(对照组)和含热毒宁注射液的M199培养基(热毒宁注射液以生药52.00 mg/mL连续2倍梯度稀释,共10个梯度)处理。每个处理设4个复孔,每孔培养液中含2.5%胎牛血清。细胞在37 ℃、二氧化碳培养箱中培养3 d后,按照MTS细胞增殖定量检测试剂盒说明书测定波长490 nm处的吸光度值(A490),以对照组A490为100%,计算各处理的细胞存活率。
2.2 热毒宁注射液体外抗CoxA16活性参照文献报道的方法[10]并略作修改,Vero细胞随机分为10组:对照组,模型组(仅接种75 TCID50或50 TCID50 CoxA16)和8个热毒宁注射液组(对接种病毒的Vero细胞分别按生药5.0、4.0、3.5、3.0、2.5、2.0、1.5、1.0 mg/mL的剂量给药)。细胞处理及细胞存活率测定方法同“2.1”项。
2.3 热毒宁注射液对5日龄ICR乳鼠的急性毒性5日龄ICR乳鼠随机按窝分为2组:对照组(生理盐水)和热毒宁注射液组(生药26 g/kg),每组各含2窝,每窝含10只乳鼠。热毒宁注射液组的其中1窝乳鼠单次ip给药0.1 mL,另1窝乳鼠每日ip给药0.1 mL,连续给药13 d。观察各组乳鼠的饮食、活动、精神状态等大体指标,共观察13 d。
2.4 热毒宁注射液体内抗CoxA16活性5日龄ICR乳鼠随机按窝分为7组:对照组、模型组、热毒宁4个剂量(生药2.6、1.3、0.65、0.325 g/kg)组、利巴韦林(10 mg/kg)阳性对照组,每组含10只乳鼠。参照文献方法[11]制备模型:每只乳鼠ip接种CoxA16,滴度为1×107 TCID50/mL,接种量0.1 mL,对照组以生理盐水代替。造模结束后2 h,各给药组ip给药0.1 mL,每日给药1次,共连续给药13 d,对照组以生理盐水代替。每日记录乳鼠死亡数、活鼠体质量和临床分值,统计乳鼠死亡率、平均生存时间、每日生存率、体质量变化率(以第1天体质量为“1”)和临床分值。临床评分标准参照文献方法[11]进行评价,略有修改:0分,正常;1分,行为异常,离群;2分,竖毛、易激、狂躁;3分,仅上肢麻痹僵硬,运动能力减弱,体质量下降;4分,下肢或四肢完全瘫痪、共济失调,失去运动能力;5分,濒死;6分,死亡。
2.5 统计学处理
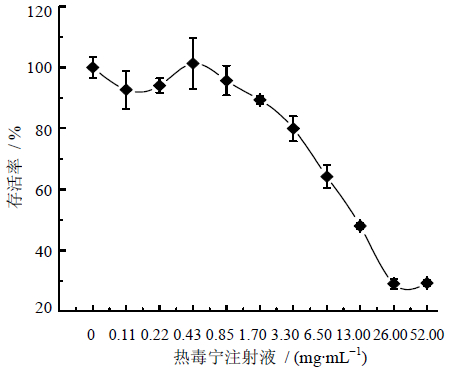
所有数据均用SPSS 19.0统计软件处理,实验数据以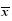 ±s表示,组间数据比较采用单因素方差分析,组间两两比较采用最小显著性差异法检验。
±s表示,组间数据比较采用单因素方差分析,组间两两比较采用最小显著性差异法检验。
本研究探讨了热毒宁注射液对Vero细胞的毒性作用,结果见图 1。热毒宁注射液质量浓度不高于生药3.3 mg/mL时,细胞毒性较弱,Vero细胞存活率大于80%;热毒宁注射液质量浓度大于生药6.5 mg/mL时,具有较强的细胞毒性,Vero细胞存活率随热毒宁注射液质量浓度提高而明显降低。热毒宁注射液对Vero细胞的半数抑制浓度(IC50)为生药12.38 mg/mL。
 | 图 1 热毒宁注射液对Vero细胞存活率的影响(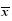 ±s,n=4)
Fig. 1 Effect of Reduning Injection on survival rate of Vero cells ( ±s,n=4)
Fig. 1 Effect of Reduning Injection on survival rate of Vero cells (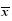 ±s,n=4) ±s,n=4)
|
热毒宁注射液(生药26 g/kg)单次ip给药或连续ip给药13 d均未引起乳鼠死亡,同时乳鼠饮食和活动正常,精神状态未见异常,无离群或竖毛等现象。表明在正常情况下,生药26 g/kg及以下剂量的热毒宁注射液对5日龄ICR乳鼠没有明显的急性毒性。根据上述结果,热毒宁注射液在儿童中应用的每日等效安全剂量为生药2.23 g/kg,与本品说明书中标明的儿童用药剂量相一致。
3.3 热毒宁注射液对CoxA16感染的Vero细胞的抗病变作用在Vero细胞模型上,热毒宁注射液具有抑制CoxA16增殖,缓解Vero细胞病变,维持Vero细胞活力的作用。如图 2所示,与单独接种75 TCID50 CoxA16模型组比较,热毒宁注射液(生药5.0 mg/mL)显著提高接毒细胞存活率达56.7%(P<0.05),保护率达31.9%;与单独接种50 TCID50 CoxA16模型组比较,热毒宁注射液(生药5.0 mg/mL)显著提高接毒细胞存活率达66.0%(P<0.05),保护达36.3%。此外,其他各质量浓度的热毒宁注射液对接毒细胞存活率也有不同程度的明显提高。结果表明热毒宁注射液对CoxA16接种的Vero细胞具有明显的抗病毒作用。
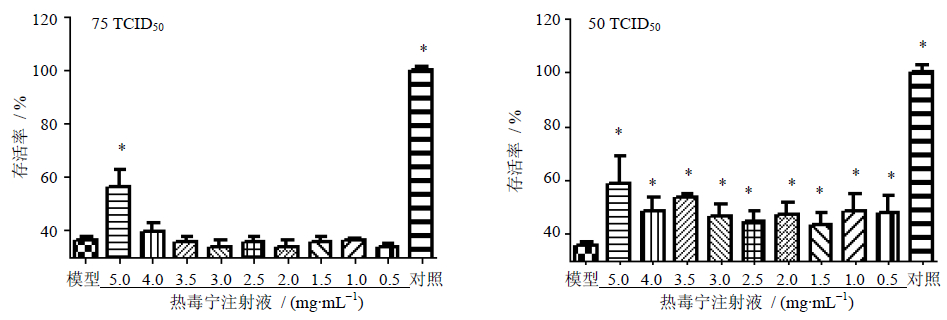 | 与模型组比较:*P<0.05 *P < 0.05 vs model group图 2 热毒宁注射液对CoxA16感染的Vero细胞存活率的影响(  ±s,n=4)
Fig. 2 Effect of Reduning Injection on survival rate of Vero cells infected by CoxA 16 virus ( ±s,n=4)
Fig. 2 Effect of Reduning Injection on survival rate of Vero cells infected by CoxA 16 virus ( ±s,n=4) ±s,n=4)
|
在5日龄ICR乳鼠模型上,热毒宁注射液对剂量为1×106 TCID50的CoxA16病毒具有治疗作用。如表 1和图 3-A所示,热毒宁注射液具有与阳性药物利巴韦林注射液相似的药效,减少CoxA16病毒导致的乳鼠死亡,延长乳鼠的存活时间。其中,热毒宁注射液生药2.6 g/kg组的乳鼠全部存活,生存时间延长54.8%(P<0.05);同时显著缓解病毒导致的生长抑制,提高乳鼠体质量(图 3-B,P<0.05)。其他各剂量的热毒宁注射液也具有类似的药效,不同程度地缓解病毒导致的乳鼠死亡,延长乳鼠存活时间,并提高乳鼠体质量。
|
|
表 1 热毒宁注射液对CoxA16感染的乳鼠死亡率及生存时间的影响( ±s,n=10)
Table 1 Effect of Reduning Injection on mortality and survival time of suckling mice infected by CoxA16virus ( ±s,n=10)
Table 1 Effect of Reduning Injection on mortality and survival time of suckling mice infected by CoxA16virus (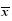 ±s,n=10) ±s,n=10)
|
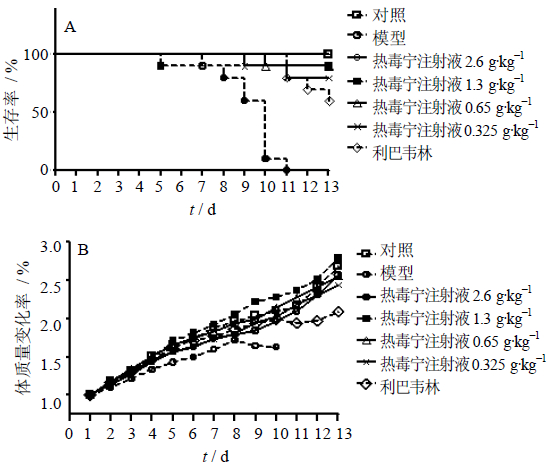 | 图 3 热毒宁注射液对CoxA16感染乳鼠生存率(A)和体制量(B)的影响 (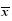 ±s,n=10)
Fig. 3 Effects of Reduning Injection on survival rate (A) and body weight (B) of sucking mice infected by CoxA16 virus ( ±s,n=10)
Fig. 3 Effects of Reduning Injection on survival rate (A) and body weight (B) of sucking mice infected by CoxA16 virus (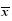 ±s,n=10) ±s,n=10)
|
另一方面,热毒宁注射液对CoxA16引起的各种症状也有明显的治疗作用。如图 4-A所示,乳鼠ip 1×106 TCID50 CoxA16 8 d后,形体消瘦,双下肢呈明显的急驰性瘫痪,运动能力下降,并出现竖毛的现象;乳鼠摄食量明显下降、精神萎靡、活动量减少,肛门部位有较多稀便等污秽物。而热毒宁注射液(生药2.6 g/kg)组乳鼠饮食正常、形体健壮、四肢无异常、精神和行动活跃、毛色光亮、二便正常。同时,如图 4-B所示,在乳鼠临床症状的赋分评价中也具有类似的趋势。乳鼠感染CoxA16后出现手足口病症状,并逐步恶化,直至死亡(达到6分);而热毒宁注射液改善了攻毒乳鼠的临床症状,降低临床分值,其中,生药2.6 g/kg剂量组的乳鼠仅出现离群、竖毛和易惊等症状(临床分值为1~2分)。因此,在5日龄ICR乳鼠模型中,热毒宁注射液对CoxA 16病毒具有治疗作用。
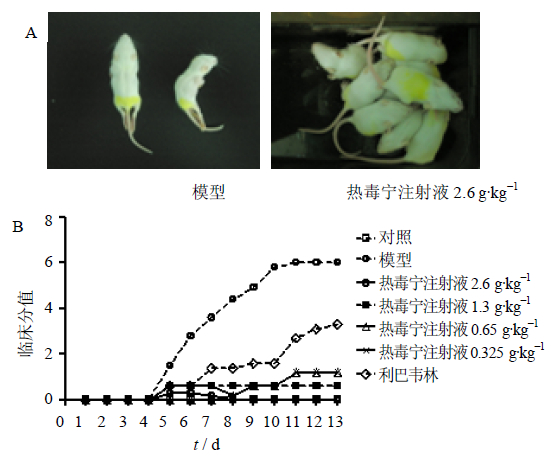 | 图 4 热毒宁注射液对CoxA16感染乳鼠临床症状的影响 (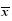 ±s,n=10)
Fig. 4 Effect of Reduning Injection on clinical symptoms of suckling mice induced by CoxA16 virus ( ±s,n=10)
Fig. 4 Effect of Reduning Injection on clinical symptoms of suckling mice induced by CoxA16 virus (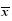 ±s,n=10) ±s,n=10)
|
本研究分别采用Vero细胞和5日龄ICR乳鼠作为体外和体内药效评价模型,确定了热毒宁注射液对2种模型的非致死剂量范围,排除了药物自身毒性对药效评价的干扰;本研究体外实验最大用药剂量生药5.0 mg/L和体内实验最大用药剂量生药2.6 g/kg分别在对细胞和动物模型非致死剂量范围内。
中药制剂是治疗手足口病的有效策略之一[12],热毒宁注射液的原料药栀子和金银花常用于制备治疗手足口病的中药制剂[13]。本研究表明,热毒宁注射液明显抑制CoxA16导致的细胞病变效应[14],提高细胞活力。有研究表明热毒宁注射液中的单体成分咖啡酸具有明显的体外抗CoxA16作用[15,16],据此推断热毒宁注射液的抑病毒作用可能与咖啡酸有关。然而,本研究中并未发现利巴韦林具有明显的体外抗病毒作用[17],推测可能与利巴韦林的细胞毒性有关[18,19]。此外,热毒宁注射液对流感病毒FM1和H1N1、呼吸道合胞病毒、人鼻病毒N36以及腺病毒-3等病毒均具有体外抑制作用[20,21,22,23,24,25],证实热毒宁注射液具有体外抗病毒作用。
1~7日龄乳鼠对手足口病病毒比较敏感,乳鼠接种病毒后逐步出现生长缓慢、减重、四肢僵硬及瘫痪的症状,并最终死亡[26]。本研究表明,与抗病毒药物利巴韦林类似[17],热毒宁注射液明显缓解CoxA16导致的乳鼠死亡,延长乳鼠生存时间;针对存活乳鼠,热毒宁注射液解除病毒引起的生长抑制,显著改善小鼠临床症状,降低临床分值。同时,热毒宁注射液的效果明显好于利巴韦林也是值得注意的。研究表明,热毒宁注射液明显降低柯萨奇B3病毒性心肌炎导致的BALb/c小鼠死亡[27],在临床研究中,热毒宁注射液对其他病毒病[28,29,30]也具有确切的疗效。因此,热毒宁注射液对CoxA16的体内药效是确实可信的。
综上所述,本研究结果表明热毒宁注射液在体内外具有抗CoxA16的作用,能够与临床观察及应用的结论[5,6,7,8,9]相互印证。热毒宁注射液抗CoxA16活性成分及其具体机制正在进行深入研究。
| [1] | WHO. Report on the Hand, Foot and Mouth Disease Outbreak in Fuyang City, Anhui Province and the Prevention and Control in China [R]. Geneva: WHO, 2008. |
| [2] | Singh S, Chow V T, Phoon M C, et al. Direct detection of enterovirus 71 (EV71) in clinical specimens from a hand, foot, and mouth disease outbreak in Singapore by reverse transcription-PCR with universal enterovirus and EV71-specific primers [J]. J Clin Microbiol, 2002, 40: 2823-2827. |
| [3] | Chang L Y, Huang C Y, Lin T Y. Fulminant neurogenic pulmonary oedema with hand, foot and mouth disease [J]. Lancet, 1998, 352: 367-368. |
| [4] | Chang L Y, Lin T Y, Hsu K H, et al. Clinical features and risk factors of pulmonary oedema after enterovirus 71-related hand, foot and mouth disease [J]. Lancet, 1999, 354: 1682-1686. |
| [5] | 王咏梅. 热毒宁联合利巴韦林治疗小儿手足口病疗效观察 [J]. 中国药物与临床, 2011, 11(1): 106-107. |
| [6] | 贾 燕. 热毒宁注射液联合利巴韦林注射液治疗小儿手足口病疗效观察 [J]. 临床合理用药, 2011, 4(8A): 55-56. |
| [7] | 邵启民, 严娟娟. 热毒宁注射液治疗200例手足口病的疗效观察 [J]. 中国现代医生, 2011, 49(4): 31-33. |
| [8] | 文九芳, 张先平, 王宗喜, 等. 热毒宁注射液治疗手足口病的Meta分析 [J]. 中国药师, 2012, 15(4): 521-525. |
| [9] | 詹国媛, 董淑红, 刘艳薇, 等. 热毒宁注射液治疗手足口病的疗效及安全观察 [J]. 中国医药指南, 2010, 26 (8): 117-118. |
| [10] | Wang J, Chen X, Wang W, et al. Glycyrrhizic acid as the antiviral component of Glycyrrhiza uralensis Fisch. against coxsackievirus A16 and enterovirus 71 of hand foot and mouth disease [J]. J Ethnopharmacol, 2013, 147: 114-121. |
| [11] | 李 仲, 任庆杰, 门 丽, 等. EV71型手足口病乳鼠动物模型的建立及免疫、内分泌及病理特征研究 [J]. 免疫学杂志, 2012, 28(10): 867-871. |
| [12] | Cao H, Liu Z, Steinmann P, et al. Chinese herbal medicines for treatment of hand, foot and mouth disease: a systematic review of randomized clinical trials [J]. Eur J Integr Med, 2012, 4(1): e85-e111. |
| [13] | Chen X, Wang C, Xu L, et al. A laboratory evaluation of medicinal herbs used in china for the treatment of hand, foot, and mouth disease [J]. Evid Based Complement Alternat Med, 2013, doi: 10.1155/ 2013/ 504563. |
| [14] | Mizuta K, Abiko C, Goto H, et al. Enterovirus isolation from children with acute respiratory infections and presumptive identification by a modified microplate method [J]. Int J Infect Dis, 2003, 7(2): 138-142. |
| [15] | 张新庄, 萧 伟, 徐筱杰, 等. 利用网络药理学方法研究热毒宁注射液抗流感病毒的分子作用机制 [J]. 物理化学学报, 2013, 29(7): 1415-1420. |
| [16] | Wang C Y, Huang S C, Lai Z R, et al. Eupafolin and ethyl Acetate fraction of Kalanchoe gracilis stem extract show potent antiviral activities against enterovirus 71 and coxsackievirus A16 [J]. Evid Based Complement Alternat Med, 2013, doi: 10.1155/2013/591354. |
| [17] | Natsumeda Y, Yamada Y, Yamaji Y, et al. Synergistic cytotoxic effect of tiazofurin and ribavirin in hepatoma cells [J]. Biochem Biophys Res Commun, 1988, 153(1): 321-327. |
| [18] | Li W, Shen F, Weber G. Ribavirin and quercetin synergistically downregulate signal transduction and are cytotoxic in human ovarian carcinoma cells [J]. Oncol Res, 1999, 11(5): 243-247. |
| [19] | 冯旰珠, 周 锋, 黄 茂. 热毒宁对流感病毒FM1的抑制作用 [J]. 中国新药与临床杂志, 2007, 26(9): 663-667. |
| [20] | 王振中, 鲍琳琳, 孙 兰, 等. 热毒宁注射液抗甲型H1N1流感病毒作用机制研究 [J]. 中草药, 2014, 45(1): 90-93. |
| [21] | 冯旰珠, 周 锋, 黄 茂, 等. 热毒宁抗呼吸道合胞病毒 (RSV, Long株) 作用体外实验研究 [J]. 南京医科大学学报: 自然科学版, 2007, 27(9): 1009-1012. |
| [22] | 冯旰珠, 周 锋, 黄 茂, 等. 热毒宁注射液对人鼻病毒 (N36) 的体外抑制作用 [J]. 中国药科大学学报, 2008, 39(3): 262-266. |
| [23] | 冯旰珠, 周 锋, 黄 茂, 等. 热毒宁注射液对腺病毒-3的体外抑制作用 [J]. 中国新药与临床杂志, 2007, 26(8): 573-577. |
| [24] | 孙 兰, 刘艾林, 王振中, 等. 热毒宁注射液及其组分对流感病毒神经氨酸酶的抑制作用研究 [J]. 现代药物与临床, 2014, 29(1): 27-31. |
| [25] | 刘 娟, 李 康, 杨 静, 等. 肠道病毒71型 (EV71) ICR乳鼠动物模型的建立 [J]. 军事医学, 2011, 35(11): 862-866. |
| [26] | 吴 岚, 孟繁峥, 于 侠, 等. 热毒宁注射液治疗小鼠柯萨奇B3病毒性心肌炎的实验研究 [J]. 中国妇幼保健, 2009, 26(24): 3719-3721. |
| [27] | 陈朝霞, 冯 梅. 热毒宁注射液治疗小儿水痘疗效观察 [J]. 广西中医学院学报, 2007, 10(3): 49-50. |
| [28] | 廖裕洲, 郭伟忠, 卢素燕. 热毒宁注射液治疗小儿病毒性肺炎临床疗效观察 [J]. 中国现代药物应用, 2008, 2(19): 35-36. |
| [29] | 花良枝, 范玉荣. 热毒宁注射液治疗小儿轮状病毒性肠炎的疗效观察 [J]. 皖南医学院学报, 2010, 29(4): 288-290. |
 2014, Vol. 45
2014, Vol. 45


