2. 天津中医药大学, 天津 300193
2. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
姜黄素类化合物是从姜科植物姜黄Curcuma longa L.的根茎中提取的有效成分,主要包含姜黄素、去甲氧基姜黄素和双去甲氧基姜黄素,其结构见图 1。目前得到的姜黄素普遍为这3种成分的混合物。3种成分中,姜黄素占70%,也是姜黄素类化合物发挥药理作用的主要成分。由于姜黄素类化合物具有较强的药理活性,因此对其研究也较多。现代药理研究表明,姜黄素具有抗肿瘤、抗炎、抗氧化、清除自由基、抗微生物以及对心血管系统、消化系统等多方面药理作用[1, 2]。尤其在抗肿瘤方面,姜黄素具有逆转肿瘤多药耐药(MDR)、显著提高化疗药物对肿瘤细胞毒作用的独特优势,加之耐受性好、毒副作用小,美国国立癌症研究所(NCI)已将其列为第3代癌化学预防药[3],因此得到了全世界的广泛关注。
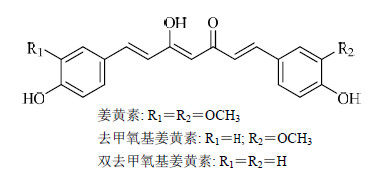 | 图 1 姜黄素类化合物的化学结构Fig.1 Chemical structures of curcuminoids |
但是,由于姜黄素的化学结构不稳定,体内代谢过程极快,其生物利用度极低,影响了此类药物的临床应用。姜黄素的化学稳定性较差,对pH值[4, 5, 6]、氧[7, 8]、光[9, 10]等均不稳定,这些条件致使其在弱碱性的生理环境中难以稳定存在,客观上造成了姜黄素在生物体内的不稳定性。对于姜黄素的体内过程,大量研究表明,不论是在实验动物[11, 12, 13]还是人体内[14, 15, 16, 17, 18, 19],姜黄素口服给药后,直接进入胃肠道,极少量通过门静脉进入外周血液循环,而且其在胃肠道中吸收较差,大部分未经吸收直接从粪便排出体外,少量吸收后从胆汁和肾脏消除。有文献报道,姜黄素原形在血浆、尿液、胆汁中的含量极低,不足0.01%[12]。因此可以推断,姜黄素药理作用的发挥,与其代谢产物极其相关。
通过各类研究归纳,姜黄素类化合物的体内代谢途径包括Ⅰ相还原代谢、Ⅱ相结合代谢以及自身氧化和细胞内的催化氧化代谢。相比于姜黄素的Ⅰ、Ⅱ相代谢,其自身氧化和催化氧化研究较少。为明确姜黄素生物利用度低的原因,探寻其发挥药理作用的物质基础,对姜黄素的体内代谢过程及其代谢产物进行综述。姜黄素的体内代谢途径见图 2。
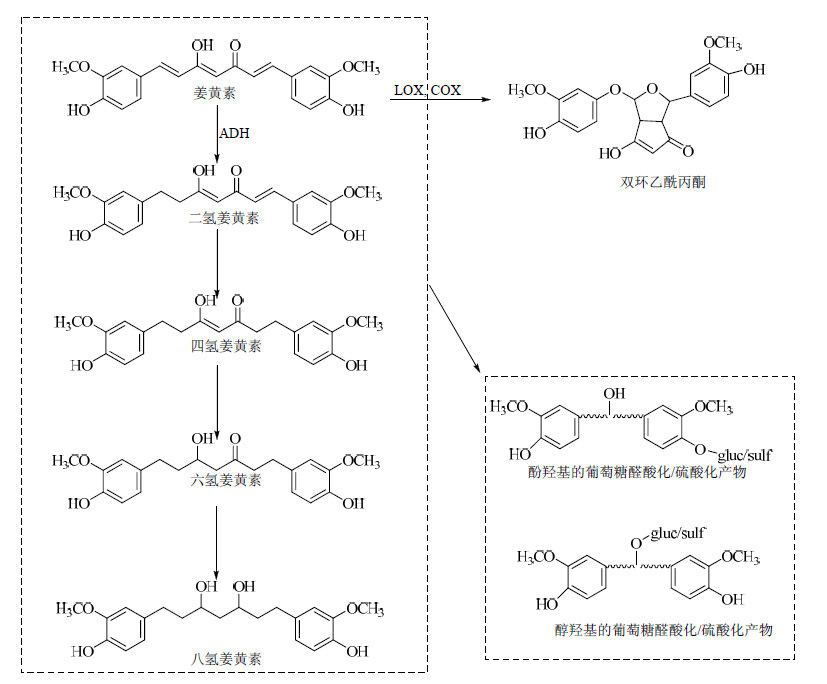 | 图 2 姜黄素的体内代谢途径Fig.2 Metabolic pathways in vivo of curcuminoid |
药物的Ⅰ相代谢包括氧化、还原、甲基化等,参与此类过程的代谢酶包括细胞色素CYP450酶、醇脱氢酶等,大部分药物经过Ⅰ相代谢后,极性增加,活性减弱(前体药除外)。
Holder等[11]在对姜黄素体内过程研究中通过质谱分析发现,姜黄素主要的Ⅰ相代谢产物包括四氢姜黄素(约占50%)和六氢姜黄素(约占42%),还有小量的阿魏酸。后续研究还检测到少量的二氢姜黄素和八氢姜黄素。从姜黄素的化学结构推断,姜黄素的Ⅰ相代谢是庚二烯-3,5-二酮结构中4个双键逐步加氢的过程。Hoehle等[20]通过大鼠肝微粒体孵育实验发现,姜黄素的Ⅰ相代谢中并未发现脱甲基化或羟基化的代谢产物,因此他推断,CYP450酶并未参与姜黄素的Ⅰ相代谢,而是由存在于肝脏和小肠细胞质内的ADH参与进行的。
Hoehle等[20]还通过研究证实,姜黄素的同系物去甲氧基姜黄素和双去甲氧基姜黄素,与姜黄素有着类似的Ⅰ相代谢途径,也是逐级产生一系列的加氢产物,而且六氢化产物较其他还原产物更为主要。
2 姜黄素的Ⅱ相代谢药物的Ⅱ相代谢主要是药物原形或其Ⅰ相代谢物在体内尿苷二磷酸葡醛酸转移酶(UGTs)、N-乙酰基转移酶(NATs)、甲基转移酶、谷胱甘肽-S-转移酶(GSTs)、磺基转移酶(SULTs)等作用下的官能团的结合反应,结合后极性增加而易于排出体外。
细胞和体内实验表明,姜黄素及其Ⅰ相代谢产物都具有酚羟基和醇羟基的结构,极易发生葡萄糖醛酸化或硫酸化的Ⅱ相结合反应。酚羟基较醇羟基更易结合葡萄糖醛酸,而且六氢姜黄素的葡萄糖醛酸化是血浆、组织或细胞中最主要的Ⅱ相代谢产物[11, 20-24]。Holder等[11]通过验证发现,姜黄素的最终代谢产物中95%都是以葡萄糖醛酸化的形式存在。Vareed等[16]在12名口服姜黄素的健康受试者血清中都检出葡萄糖醛酸化产物和硫酸化产物,比例为1.92∶1,实验中未得到混合型的结合产物。Sharma等[18]采用6名结肠癌患者连续4个月服用日剂量为3.6 g的姜黄素,血浆中游离姜黄素、葡萄糖醛酸化产物及硫酸化产物的比例为11∶16∶9,尿液中为4∶8∶1。两个临床试验的结果均说明葡萄糖醛酸化是较为主要的人体Ⅱ相代谢产物。
在Ⅱ相代谢的深入研究方面,Hoehle等[25]应用9种人体UGTs进行体外实验,研究发现姜黄素结构中酚羟基的葡萄糖醛酸化主要是由肝UGT1A1和肠UGT1A8、UGT1A10介导,而醇羟基的葡萄糖醛酸化由UGT1A9介导。六氢姜黄素对UGT1A9、2B7、1A8的活性较高。这些数据也间接反映出在人体中,姜黄素的胃肠道过程对其葡萄糖醛酸化起了至关重要的作用。同系物中比较,UGT底物的顺序为姜黄素>去甲氧基姜黄素>双去氧基姜黄素。因此占比例较多的姜黄素成分,其Ⅱ相结合反应产物更占优势。
相比于葡萄糖醛酸化产物,硫酸化产物的研究相对较少。Ireson等[23]应用人和大鼠肠组织和肝细胞模拟姜黄素的体内吸收代谢过程发现,姜黄素的葡萄糖醛酸化发生在肠道和肝微粒中,而硫酸化发生在肠道和肝细胞溶质中。在人体中,硫酸化的代谢主要通过苯磺酸转移酶SULT1A1和SULT1A3介导。此外,Usta等[26]研究表明,姜黄素可以通过GSTs产生麦氏加成反应,形成不稳定的结合物,最终降解成姜黄素的硫酸化产物。
Dempe等[27]应用Caco-2细胞实验评价包括姜黄素、Ⅰ相代谢产物(六氢姜黄素、八氢姜黄素)及Ⅱ相代谢产物(葡萄糖醛酸化和硫酸化产物)在其中的迁移趋势,以此来模拟姜黄素及其主要代谢产物在肠道的代谢和吸收。从表观渗透系数结果显示,姜黄素的自身吸收较差,生物利用度几乎为零,但是其还原和结合产物在Caco-2细胞中表现出一定的吸收。因此可以推断,姜黄素在体内所发挥的生物活性,更依赖于能达到靶部位的姜黄素代谢产物。
3 姜黄素的自氧化和催化氧化代谢各类文献对姜黄素类化合物的Ⅰ相还原反应和Ⅱ相结合反应报道较多,但是对于其氧化反应涉及较少。作为体内重要的抗氧化剂,姜黄素的自身氧化以及细胞内的催化氧化反应,对于其药理作用的发挥更应值得关注。
对于姜黄素的催化氧化和自氧化过程,Griesser等[7]通过化学实验和细胞实验分别证实,姜黄素中的庚二烯-3,5-二酮结构在碱性氧环境或环氧化酶(COX)及脂肪氧合酶(LOX)等催化酶作用下,可以形成甲基化醌中间体,再通过氧化、加水、脱水、重排等一系列反应,最终形成具有更为稳定的双环乙酰丙酮结构。图 3即为姜黄素发生自氧化或催化氧化的主要过程。
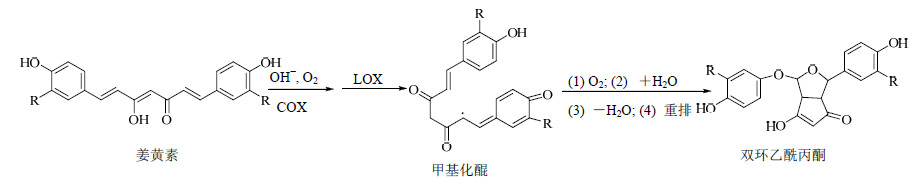 | 图 3 姜黄素的自氧化和催化氧化代谢Fig.3 Oxidation and catalytic oxidative metabolism of curcumin |
Gordon等[8]通过LC-ESI-MS/MS证实,姜黄素在弱碱性环境中也会产生双环乙酰丙酮。有报道称,甲基化醌中间体是许多酚类物质(如白藜芦醇等)抗肿瘤的物质基础,它可以和谷胱甘肽或体内的大分子(如蛋白质、DNA)形成加合物[28, 29, 30, 31],从而增强依托泊苷、丝裂霉素C等化疗药物的抗肿瘤活性。相比香草醛、阿魏酸等非酶降解产物,通过此类氧化反应生成的双环乙酰丙酮结构在体内代谢的地位可能更为重要,也是体内代谢研究的重点。
由此可以推断,姜黄素自氧化和在细胞内的催化氧化过程,对其药效的发挥,起着至关重要的作用。其氧化终产物双环乙酰丙酮的体内过程研究,能够更明确地揭示姜黄素产生抗肿瘤、抗氧化、清除自由基等一系列药理活性的原因。
4 结语姜黄素的代谢包括Ⅰ相逐级加氢还原、Ⅱ相结合反应、自氧化和细胞内的催化氧化反应。各级代谢产物稳定性较差,从而造成其在体内的快速代谢。但事实表明,姜黄素丰富的药理作用并未因其极低的生物利用度而有所减弱。因此可以推断,这些药理效应的产生可能并非完全依赖于姜黄素原型,也可能与分布于机体组织中的姜黄素同系物、代谢产物或降解产物有关,而对这些物质的生物活性报道较少[32]。姜黄素作为抗氧化剂,其自氧化过程不容忽视,且机体细胞中存在高活性的COX、LOX,其催化氧化也是机体内特有的过程,从自氧化和通过上述两种酶催化氧化生成的双环乙酰丙酮结构,在活体细胞中的量较高,加之甲基化醌中间体重要的药理作用,因此推断双环乙酰丙酮结构很可能是姜黄素发挥生物活性最主要的物质基础。对于此物质的药理活性及其对临床的贡献,值得更为深入的研究。
| [1] | Bengmark S, 刘 青. 植物源保护剂姜黄素的研究进展[J]. 现代药物与临床, 2009, 24(1): 22-31. |
| [2] | 罗廷顺, 李洪文, 刘正文, 等. 姜黄素的提取分离与药理作用研究进展[J]. 现代药物与临床, 2011, 26(2): 102-107. |
| [3] | Thiyagarajan S, Thirumalai K, Nirmala S, et al. Effect of curcumin on lung resistance-related protein (LRP) in retinoblastoma cells[J]. Curr Eye Res, 2009, 34(10): 845-851. |
| [4] | Wang Y J, Pan M H, Cheng A L, et al. Stability of curcumin in buffer solutions and characterization of its degradation products[J]. J Pharm Biomed Anal, 1997, 15(12): 1867-1876. |
| [5] | Roughley P J, Whiting D A. Experiments in the biosynthesis of curcumin[J]. J Chem Soc Perkin Trans 1, 1973: 2379-2388. |
| [6] | Tønnesen H H, Karlsen J. Studies on curcumin and curcuminoids[J]. Z Lebensm Untersu Forsch, 1985, 180(5): 402-404. |
| [7] | Griesser M, Pistis V, Suzuki T, et al. Autoxidative and cyclooxygenase-2 catalyzed transformation of the dietary chemopreventive agent curcumin[J]. J Biol Chem, 2011, 286(2): 1114-1124. |
| [8] | Gordon O N, Schneider C. Vanillin and ferulic acid: not the major degradation products of curcumin[J]. Trends Mol Med, 2012, 18(7): 361-364. |
| [9] | Tønnesen H H, Karlsen J, van Henegouwen G B, Studies on curcumin and curcuminoids. VIII. Photochemical stability of curcumin[J]. Z Lebensm Unters Forsch, 1986, 183(2): 116-122. |
| [10] | 赵 欣, 王爱里, 袁 园, 等. 姜黄中姜黄素, 去甲氧基姜黄素, 双去甲氧基姜黄素的光稳定性分析[J]. 中草药, 2013, 44(10): 1338-1341. |
| [11] | Holder G M, Plummer J L, Ryan A J. The metabolism and excretion of curcumin (1,7-bis-(4-hydroxy-3-methoxyphenyl)-1,6-heptadiene-3,5-dione) in the rat[J]. Xenobiotica, 1978, 8(12): 761-768. |
| [12] | Wahlström B, Blennow G. A study on the fate of curcumin in the rat[J]. Acta Pharmacol Toxicol (Copenh), 1978, 43(2): 86-92. |
| [13] | Ravindranath V, Chandrasekhara N, Absorption and tissue distribution of curcumin in rats[J]. Toxicology, 1980, 16(3): 259-265. |
| [14] | Vareed S K, Kakarala M, Ruffin M T, et al. Pharmacokinetics of curcumin conjugate metabolites in healthy human subjects[J]. Cancer Epidemiol Biomarkers Prev, 2008, 17(6): 1411-1417. |
| [15] | Lao C D, Ruffin M T, Normolle D, et al. Dose escalation of a curcuminoid formulation[J]. BMC Complement Altern Med, 2006, 6: 10. |
| [16] | Cheng A L, Hsu C H, Lin J K, et al. Phase I clinical trial of curcumin, a chemopreventive agent, in patients with high-risk or pre-malignant lesions[J]. Anticancer Res, 2001, 21(4B): 2895-2900. |
| [17] | Sharma R A, McLelland H R, Hill K A, et al. Pharmaco-dynamic and pharmacokinetic study of oral curcuma extract in patients with colorectal cancer[J]. Clin Cancer Res, 2001, 7(7): 1894-1900. |
| [18] | Sharma R A, Euden S A, Platton S L, et al. Phase I clinical trial of oral curcumin: biomarkers of systemic activity and compliance[J]. Clin Cancer Res, 2004, 10(20): 6847-6854. |
| [19] | Carroll R E, Benya R V, Turgeon D K, et al. Phase IIa clinical trial of curcumin for the prevention of colorectal neoplasia[J]. Cancer Prev Res (Phila), 2011, 4(3): 354-364. |
| [20] | Hoehle S I, Pfeiffer E, Sólyom A M, et al. Metabolism of curcuminoids in tissue slices and subcellular fractions from rat liver[J]. J Agric Food Chem, 2006, 54(3): 756-764. |
| [21] | Pan M H, Huang T M, Lin J K. Biotransformation of curcumin through reduction and glucuronidation in mice[J]. Drug Metab Dispos, 1999, 27(4): 486-494. |
| [22] | Asai A, Miyazawa T. Occurrence of orally administered curcuminoid as glucuronide and glucuronide/sulfate conjugates in rat plasma[J]. Life Sci, 2000, 67(23): 2785-2793. |
| [23] | Ireson C, Orr S, Jones D J, et al. Characterization of metabolites of the chemopreventive agent curcumin in human and rat hepatocytes and in the rat in vivo, and evaluation of their ability to inhibit phorbol ester-induced prostaglandin E2 production[J]. Cancer Res, 2001, 61: 1058-1064. |
| [24] | Ireson C R, Jones D J, Orr S, et al. Metabolism of the cancer chemopreventive agent curcumin in human and rat intestine.[J]. Cancer Epidemiol Biomarkers Prev, 2002, 11(1): 105-111. |
| [25] | Hoehle S I, Pfeiffer E, Metzler M. Glucuronidation of curcuminoids by human microsomal and recombinant UDP-glucuronosyltransferases[J]. Mol Nutr Food Res, 2007, 51(8): 932-938. |
| [26] | Usta M, Wortelboer H M, Vervoort J, et al. Human glutathione S-transferase-mediated glutathione conjugation of curcumin and efflux of these conjugates in Caco-2 cells[J]. Chem Res Toxicol, 2007, 20(12): 1895-1902. |
| [27] | Dempe J S, Scheerle R K, Pfeiffer E, et al. Metabolism and permeability of curcumin in cultured Caco-2 cells[J]. Mol Nutr Food Res, 2013, 57(9): 1543-1549. |
| [28] | Bodell W J, Ye Q, Pathak D N, et al. Oxidation of eugenol to form DNA adducts and 8-hydroxy-2'-deoxyguanosine: role of quinone methide derivative in DNA adduct formation[J]. Carcinogenesis, 1998, 19(3): 437-443. |
| [29] | Thompson D C, Thompson J A, Sugumaran M, et al. Biological and toxicological consequences of quinone methide formation[J]. Chem Biol Interact, 1993, 86(2): 129-162. |
| [30] | Thompson D C, Perera K, Krol E S, et al. o-Methoxy-4-alkylphenols that form quinone methides of intermediate reactivity are the most toxic in rat liver slices[J]. Chem Res Toxicol, 1995, 8(3): 323-327. |
| [31] | van der Woude H, Alink G M, van Rossum B E, et al. Formation of transient covalent protein and DNA adducts by quercetin in cells with and without oxidative enzyme activity[J]. Chem Res Toxicol, 2005, 18(12): 1907-1916. |
| [32] | Shen L, Ji H F. The pharmacology of curcumin: is it the degradation products?[J]. Trends Mol Med, 2012, 18(3): 138-144. |
 2015, Vol. 30
2015, Vol. 30


