2. 泸州老窖博士后科研工作站, 四川 泸州 646606
2. Luzhoulaojiao Postdoctoral Workstation, Luzhou 646606, China
冬虫夏草Cordyceps sinensis (Berk.) Sacc.是冬虫夏草菌寄生在鳞翅目蝙蝠蛾科幼虫或幼虫尸体形成的干燥复合体[1],与鹿茸、人参合称为我国三大补品,具有补肺益肾、止血化痰、止咳定喘之功效。现代药理研究表明,冬虫夏草提取物具有调节免疫、调血脂、抗肿瘤、抗菌、抗疲劳、抗肝纤维化[2]等多种效用,涉及免疫系统、心血管系统、新陈代谢等各个方面[3-7]。冬虫夏草在我国主要分布于青藏高原地区[8],海拔高度2 800 m以上的高寒草甸和灌木地带为冬虫夏草的集中分布区域[9-10]。目前市场上冬虫夏草混淆品较多,且多为虫草属近缘种,与正品冬虫夏草相似度高,现有《中国药典》定量要求难以进行有效鉴别,严重影响了临床用药的安全。有必要对冬虫夏草及其混淆品种所含的化学成分进行对比研究,以制定更适合冬虫夏草的质量控制标准[11-13]。
HPLC指纹图谱是近年来研究的热点,指纹图谱可以比较全面地反映中药所含化学成分的数量和种类,是国内外广泛接受的一种中药质量评价模式。王冰等[14]研究了冬虫夏草的指纹图谱,并用对照品指认了鸟苷、尿苷、肌苷、腺苷4个共有峰;赖宇红等[15]建立了西藏不同产区冬虫夏草水提液的高效液相色谱指纹图谱,指认出尿苷、肌苷、鸟苷,胸苷、腺苷、2-脱氧核苷6个特征成分。这些报道侧重于核苷类的指纹图谱建立,共有成分的鉴定采用对照品比对法,由于核苷类组分相似度较高,可能存在准确性的问题。目前应用高分辨串极质谱技术进行定性鉴定还鲜有研究报道。本研究针对以上局限,结合液质联用技术,选择多个产地多个批次的冬虫夏草及其常见混淆品种进行实验,建立冬虫夏草及其主要混淆品水溶性成分的指纹图谱,对其进行相似度评价和聚类分析,标定共有峰。进而利用四级杆飞行时间质谱鉴定共有峰的化学结构,为冬虫夏草的真伪鉴别提供科学依据。
1 材料、试剂与仪器 1.1 材料样品为定点采购于西藏、青海、四川、甘肃、云南、尼泊尔等地的多个冬虫夏草基原品种与混淆品种,见表 1。经国锦琳教授鉴定均留样保存于成都中医药大学中药材标准化教育部重点实验室。
|
|
表 1 样品信息 Table 1 Sample information |
1.2 试剂
磷酸二氢钠、磷酸氢二钠、甲酸为分析纯,购于成都市科龙化工试剂厂;乙腈、甲醇为色谱纯(美国Fisher公司);Millipore超纯水。胞嘧啶、尿嘧啶、胞苷、次黄嘌呤、鸟嘌呤、尿苷、胸腺嘧啶、腺嘌呤、肌苷、鸟苷、胸苷、腺苷、虫草素对照品购于中国食品药品检定研究院(质量分数≥98%)。
1.3 仪器Agilent1200型高效液相色谱仪配DAD二极管阵列检测器;Agilent 1290超高效液相色谱仪,Agilent6530型四级杆飞行时间质谱仪配电喷雾源;色谱柱:GL WondaSil C-18柱(250 mm×4.6 mm,5 μm),AgilentZorbax SB-C18(100 mm×4.6 mm,1.8 μm);AllegraX-22R型冷冻离心机(德国Beckman公司);SHB-Ⅲ型循环水式真空泵(郑州常成科工贸易有限公司);SB2200型超声机(上海Branson公司);Quintix224-1CN型万分之一电子天平(赛多利斯科学仪器北京有限公司)。
2 方法 2.1 对照品溶液的制备精密称取胸腺嘧啶0.48 mg、胞苷0.59 mg、腺苷0.68 mg、鸟苷0.42 mg、尿苷0.53 mg、鸟嘌呤0.43 mg、虫草素0.55 mg、尿嘧啶0.47 mg、肌苷0.46 mg、胸苷0.50 mg、胞嘧啶0.46 mg、次黄嘌呤0.50 mg、腺嘌呤0.49 mg于25 mL量瓶中,加入20%甲醇制刻度,制成含胸腺嘧啶19.2 μg/mL、胞苷23.6 μg/mL、腺苷27.2 μg/mL、鸟苷16.8 μg/mL、尿苷21.2 μg/mL、鸟嘌呤17.2 μg/mL、虫草素22.0 μg/mL、尿嘧啶18.8 μg/mL、肌苷18.4 μg/mL、胸苷0.20 μg/mL、胞嘧啶18.4 μg/mL、次黄嘌呤0.20 μg/mL、腺嘌呤19.6 μg/mL的混合对照品溶液,用0.22 μm微孔滤膜过滤后置于进样瓶中,即得。
2.2 供试品溶液的制备精密称取样品药材粉末0.5 g置于50 mL锥形瓶中,加入20%甲醇溶液20 mL,超声提取30 min,转移至50 mL离心管中5 000 r/min离心5 min,取上清液,0.22 μm微孔滤膜滤过,置于样品瓶中,即得供试品溶液。
2.3 色谱及质谱条件 2.3.1 色谱条件GL WondaSil C-18色谱柱(250 mm×4.6 mm,5 μm);检测波长260 nm;柱温25 ℃;体积流量0.8 mL/min;进样量20 μL;检测时间60 min;以乙腈(A)-0.1%甲酸水溶液(B)为流动相;梯度洗脱,0~10 min,2%~6% A;20~25 min,6%~8% A;25~35 min,8%~15% A;35~60 min,15%~60% A。
2.3.2 UPLC/Q-TOF-MS条件UPLC条件:色谱柱,AgilentZorbax SB-C18(100 mm×4.6 mm,1.8 μm);检测波长260 nm;柱温25 ℃;体积流量0.8 mL/min;进样量20 μL;检测时间60 min。流动相为乙腈(A)-0.1%甲酸水溶液(B);梯度洗脱,0~10 min,2%~6% A;10~25 min,6%~8% A;25~35 min,8%~15% A;35~60 min,15%~60% A。ESI离子源,气体温度325 ℃;干燥气体积流量5 mL/min;雾化压力137.9 kPa;毛细管电压3 500 V;喷雾电压2 000 V;鞘流气温度325 ℃;鞘流气体积流量7.5 mL/min。
3 结果与分析 3.1 指纹图谱方法学考察 3.1.1 重复性试验取同一批号样品(DCXC03)按照“2.2”项下条件制备供试品溶液,平行制备6份,按“2.3.1”项条件测定,记录色谱图。6张谱图经国家药典委员会的《中药色谱指纹图谱相似度评价系统》操作规范计算,相似度不小于0.999,各主要色谱峰相对保留时间及相对峰面积的RSD值分别小于0.2%和1.5%。
3.1.2 稳定性试验取同一批号样品(DCXC03)按照“2.2”项下条件制备供试品溶液,分别于0、2、4、8、12 h注入液相色谱仪,按“2.3.1”项条件测定,记录色谱图。5张谱图经国家药典委员会的《中药色谱指纹图谱相似度评价系统》操作规范计算,相似度不小于0.998,各主要色谱峰相对保留时间及相对峰面积的RSD分别小于0.5%和2.0%。
3.1.3 精密度试验取同一批号样品(DCXC03)按照“2.2”项下条件制备供试品溶液,连续进样6针,按“2.3.1”项条件测定,记录色谱图。6张谱图经国家药典委员会的《中药色谱指纹图谱相似度评价系统》操作规范计算,相似度不小于0.999,各主要色谱峰相对保留时间及相对峰面积的RSD值分别小于0.2%和1.5%。
3.2 HPLC指纹图谱的建立取31批药材粉末,按“2.2”项下方法制备供试品溶液,按“2.3.1”项下方法检测。将检测结果导入软件《中药色谱指纹图谱相似度评价系统》(2004A版),即得31批虫草药材HPLC指纹图谱(图 1)。
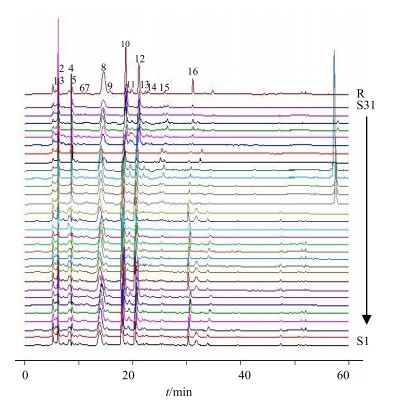
|
图 1 冬虫夏草及其混淆品HPLC指纹图谱 Fig.1 HPLC fingerprint ofC.sinensis and its confused species |
根据指纹图谱整体性原则,把指纹图谱中具有相同保留时间的色谱峰标定为共有峰。通过比较色谱图,标定出16个峰为各批次虫草药材共有峰(1~16号峰)。
3.3 指纹图谱结果分析 3.3.1 指纹图谱相似度分析根据《中药色谱指纹图谱相似度评价系统》(2004A版)计算31批次虫草指纹图谱间的相似度。由相似度匹配结果可以看出,相同产地冬虫夏草间相似度较高,相似度值均大于0.8,不同产地间的冬虫夏草相似度较低,相似度值在0.2~0.8,不同种虫草间相似度也较低,相似度值均小于0.5。
3.3.2 指纹图谱聚类分析以共有峰峰面积数据作为变量,以欧氏距离作为相似度指标,利用IBM SPSS Statistics 19软件对各批次虫草指纹图谱进行聚类分析,结果见图 2。
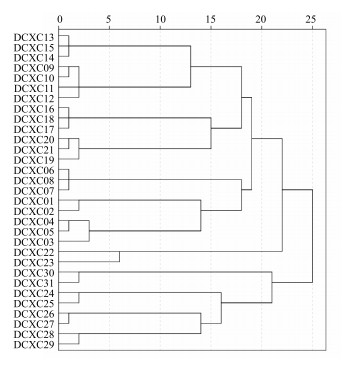
|
图 2 聚类分析图 Fig.2 Cluster diagram |
根据结果,31批样品可以按照产地和品种聚类。就冬虫夏草而言,按具体采集地划分时,相同采集地的冬虫夏草聚为一类且同一类间差异小。按省(自治区)划分时,四川产冬虫夏草(DCXC09~DCXC18)可基本聚为一类,西藏产冬虫夏草(DCXC01~DCXC05)可基本聚为一类,其他各省(自治区)产冬虫夏草可各自聚类,但各具体采集地的冬虫夏草间存在巨大差异,云南(DCXC22、DCXC23)、尼泊尔产冬虫夏草(DCXC24、DCXC25)与其他采集地的冬虫夏草间差异明显,这与药材的生长环境和蝙蝠蛾寄主幼虫的多样性有关。就不同种虫草而言,冬虫夏草(除尼泊尔冬虫夏草)(DCXC01~DCXC23)、尼泊尔冬虫夏草(DCXC24、DCXC25)、凉山虫草(DCXC26、DCXC27)、古尼虫草(DCXC28、DCXC29)、蛹虫草(DCXC30、DCXC31)可各自聚类。聚类分析结果与虫草属真菌分类情况一致,且符合样品标示的产地情况。
3.4 共有峰的归属 3.4.1 UPLC/TOF-MS测定取DCXC03药材粉末,按“2.3”项下方法制备供试品溶液,按“2.4.2”项下方法检测。根据共有峰的质谱参数,结合相关文献,对指纹图谱中的16个共有峰进行了鉴定,供试品溶液总离子流图见图 3。大致推断出其中的12个峰所代表的化合物,分别是胞嘧啶、尿苷、尿嘧啶、肌苷、胞苷、次黄嘌呤、鸟嘌呤、胸腺嘧啶、腺嘌呤、腺苷、胸苷和虫草素,其中7号包含了次黄嘌呤和鸟嘌呤2个化合物(表 2)。得到了5、8、14、15号峰的分子式,但由于缺少文献资料,暂不能确定其所代表的化合物结构。
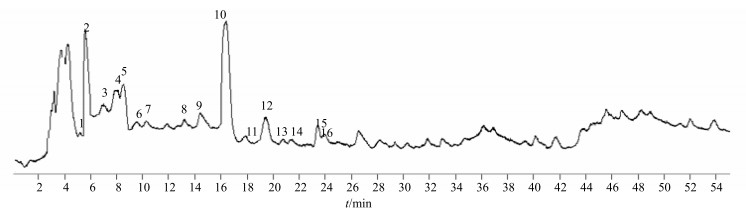
|
图 3 DCXC03供试品溶液UPLC/TOF-MS总离子流图 Fig.3 Total ion-current UPLC/TOF-MS chromatogram of DCXC03 test solution |
|
|
表 2 共有峰的质谱参数及化合物结构推断 Table 2 Mass parameters of common peaks and structure detection |
3.4.2 化合物的结构验证
按照“2.4.2”项下分析条件,检测对照品溶液,得到对照品溶液总离子流图(图 4),提取出各化合物质谱图并确定质谱信息(表 3),通过对比供试品和对照品的总离子流图中各峰的保留时间和相应化合物的质谱信息,对已推断出的化合物结构进行验证。DCXC03供试液总离子流图中,1、2、3、4、6、9、10、11、12、13、16号峰与对照品总离子流图中相应峰的保留时间和分子离子[M+H]+均一致,分别确定为胞嘧啶、尿嘧啶、胞苷、尿苷、胸腺嘧啶、腺嘌呤、肌苷、鸟苷、胸苷、腺苷和虫草素。7号峰保留时间为9.92 min,分子离子为[M+H]+(m/z 137.123 1)和[M+H]+ (m/z 152.123 6),为2种化合物,分别与次黄嘌呤和鸟嘌呤的保留时间和分子离子一致,确定该峰代表的化合物为次黄嘌呤和鸟嘌呤。
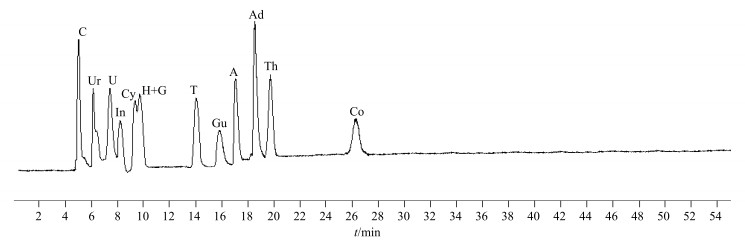
|
C-胞嘧啶Ur-尿苷U-尿嘧啶In-肌苷Cy-胞苷H-次黄嘌呤G-鸟嘌呤T-胸腺嘧啶Gu-鸟苷A-腺嘌呤Ad-腺苷Th-胸苷Co-虫草素 C-cytosine Ur-uridine U-uracil In-inosine Cy-cytidine H-hypoxanthine G-guanosine T-thymidine Gu-guanosine A-adenine Ad-adenosine Th-thymidine Co-codycepine 图 4 对照品UPLC/TOF-MS总离子流图 Fig.4 Total ion-current chromatogram of pharmaceutical standard solution |
|
|
表 3 对照品质谱参数 Table 3 Mass parameters of standards |
4 讨论
本实验分别考察了50%、20%甲醇溶液和纯水作为提取溶剂,20%甲醇作提取溶剂时效果最佳;考察了超声提取和回流提取2种方法,供试品在HPLC色谱图中出峰数目相当,采用提取方法更简便的超声提取法。经过比较,在乙腈-0.1%甲酸水体系中,各色谱峰分离效果好且基线平稳;体积流量为0.8 mL/min时,各色谱峰保留时间适中且分离情况良好;在波长为260 nm检测到的色谱峰较多,峰面积较大,反映的信息较全面。
本实验建立了冬虫夏草及其主要混淆品HPLC指纹图谱,生成共有模式图并标示了16个共有峰。对不同批次的样品进行相似度评价和聚类分析,相同产地冬虫夏草相似度在0.8以上,聚类分析结果与虫草属真菌分类情况一致,且符合样品标示的产地情况。通过UPLC/Q-TOF-MS鉴定出其中12个共有峰分别为胞嘧啶、尿嘧啶、胞苷、次黄嘌呤+鸟嘌呤、尿苷、胸腺嘧啶、腺嘌呤、肌苷、鸟苷、胸苷、腺苷和虫草素。
冬虫夏草水溶性指纹图谱中还有明显区别于其他虫草的特有峰,本课题组下一步将继续完成特有组分的结构研究,该化合物可能为冬虫夏草潜在的指标性化合物,对正品冬虫夏草的鉴别和质量控制具有重要意义。
| [1] | 中国药典[S].一部. 2015. |
| [2] | 白金霞, 韩晋, 戴领, 等. 基于体外溶出度与抗肝纤维化作用效应动力学的冬虫夏草粉碎度研究[J]. 中草药, 2013, 44(20):2823–2827. |
| [3] | 胡贤达, 黄雪, 王彪, 等. 冬虫夏草抗肿瘤及免疫调节作用的研究进展[J]. 药物评价研究, 2015, 38(4):448–452. |
| [4] | Wang J, Liu Y M, Cao W, et al. Anti-inflammation and antioxidant effect of cordymin, a peptide purified from the medicinal mushroom Cordyceps sinensis, in middle cerebral artery occlusion-induced focal cerebral ischemia in rats[J]. Metabolic Brain Disease, 2012, 27(2): 159–165. DOI:10.1007/s11011-012-9282-1 |
| [5] | Yoshikawa N, Yamada S, Takeuchi C, et al. Cordycepin (3'-deoxyadenosine) inhibits the growth of B16-BL6 mouse melanoma cells through the stimulation of adenosine A3 receptor followed by glycogen synthase kinase-3β activation and cyclin D1 suppression[J]. Naunyn-Schmiedeberg's Archiv Pharmacol, 2008, 377(4/6): 591–595. |
| [6] | Park E S, Kang D H, Yang M K, et al. Cordycepin, 3'-deoxyadenosine, prevents rat hearts from ischemia/reperfusion injury via activation of Akt/GSK-3β/p70S6K signaling pathway and HO-1 Expression[J]. Cardiovascular Toxicol, 2014, 14(1): 1–9. DOI:10.1007/s12012-013-9232-0 |
| [7] | Nakav S, Chaimovitz C, Sufaro Y, et al. Anti-inflammatory preconditioning by agonists of adenosine A1 receptor[J]. PLoS One, 2008, 3(5): e2107. DOI:10.1371/journal.pone.0002107 |
| [8] | Jia J M, Tao H H, Feng B M. Cordyceamides A and B from the culture liquid of cordycepssinensis (BERK.) SACC[J]. Chem Pharm Bull, 2009, 57(1): 99–101. DOI:10.1248/cpb.57.99 |
| [9] | 杨大荣, 彭艳琼, 陈吉岳. 我国冬虫夏草分布格局与环境变化对其分布的影响[J]. 中国草地学报, 2010, 32(5):6–22. |
| [10] | 李挺, 宋斌, 王超群, 等. 冬虫夏草促繁地土壤真菌种群结构的变性梯度凝胶电泳技术分析[J]. 中草药, 2013, 44(4):478–481. |
| [11] | 胡清秀, 寥超子, 王欣. 我国冬虫夏草及其资源保护, 开发利用对策[J]. 中国农业资源与区划, 2005, 26(5):43–47. |
| [12] | 元英群, 丁爽, 刘红. 冬虫夏草鉴别方法的研究进展[J]. 现代药物与临床, 2012, 27(6):652–654. |
| [13] | 程元柳, 邱乙, 彭成, 等. 冬虫夏草资源管理法规探讨[J]. 时珍国医国药, 2015, 26(2):449–450. |
| [14] | 王冰, 李宁, 董婷霞, 等. 冬虫夏草中核苷类成分含量测定及HPLC指纹图谱研究[J]. 中药材, 2015, 38(5):952–956. |
| [15] | 赖宇红, 阮桂平, 谢友莲, 等. 冬虫夏草及其类似品的HPLC指纹特征分析[J]. 中药材, 2008, 31(8):1142–1145. |
 2017, Vol. 48
2017, Vol. 48


