2. 南开大学生命科学学院, 天津 300071;
3. 天津中医药大学中医药研究院, 天津 300193;
4. 天津师范大学生命科学学院, 天津 300387
2. College of Life Science, Nankai University, Tianjin 300071, China;
3. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China;
4. College of Life Science, Tianjin Normal University, Tianjin 300387, China
藏药川西獐牙菜Swertia mussotii Franch为龙胆科(Gentianaceae)獐牙菜属Swertia L.植物,为青藏高原特有种,分布于西藏、青海海拔3 800~5 000 m的高寒地区,为藏族民间常用的一种草药,称为“藏茵陈”。藏茵陈是中华民族药中的瑰宝,是青藏高原中藏药八珍之一,是藏医学经典著作《四部医典》中所记载的藏药獐牙菜,全草入药,性寒、味苦,具有清热解毒、清肝利胆之功效[1],主治黄疸型肝炎、肝硬化、肝腹水[2]等症。现开发出的“藏茵陈胶囊”是治疗肝中毒、肝炎的最佳药物之一,其主要有效成分獐牙菜苦苷及龙胆苦苷为环烯醚萜类化合物,它们具有肝损伤修复、抗肝炎、减轻胆细胞坏死、抗溃疡、抗虫、抑制中枢神经系统、抗癌等作用[3-8]。环烯醚萜类化合物属于单萜类化合物,都是通过细胞质中的甲羟戊酸途径(MVA途径)和质体中的2-C-甲基-D-赤藓糖醇-4-磷酸(plastidic 2-C-methyl-D-erythritol 4-phosphate,MEP)途径形成异戊烯焦磷酸(isopentenyl diphosphate,IPP),IPP经硫氢酶(sulphyhydryl)及IPP异构酶(IPP isomerase)转化为焦磷酸r, r-二甲基烯丙酯(r, r-dimethyl pyrophosphate,DMAPP)。然后IPP和DMAPP在细胞质或质体中由牻牛儿基焦磷酸合酶(GPP synthase,GPPS)催化合成牻牛儿基焦磷酸(geranyl pyrophosphate,GPP),GPP经过多步酶学催化过程最后形成獐牙菜苦苷及龙胆苦苷[9-10],GPPS是环烯醚萜化合物合成途径中的关键酶。然而,目前仅在长春花、薄荷、丹参、胡黄连、滇龙胆等少数药用植物中对GPPS蛋白的编码基因进行克隆和功能研究[11-13]。本研究根据川西獐牙菜转录组SmGPPS基因序列,设计特异性引物,通过RT-PCR扩增得到cDNA序列,并进行克隆、测序及生物信息学分析;构建原核表达载体pET-28a-SmGPPS,转入大肠杆菌BL21(DE3)中,在37 ℃、1 mmol/L IPTG诱导下进行表达。并采用半定量RT-PCR方法检测了GPPS基因在川西獐牙菜不同组织中的表达强度,为进一步研究该基因的功能和利用基因工程手段提高川西獐牙菜中环烯醚萜化合物产量提供了基础。
1 材料和试剂 1.1 材料野生川西獐牙菜Swertia mussotii French种子,采集于青海省玉树县,由青海大学董汇泽教授鉴定。实验材料为实验室种植的川西獐牙菜植株。
1.2 工程菌株、质粒载体 1.2.1 菌种大肠杆菌Escherichia coli Trans 5α和BL21(DE3)菌种购于全式金生物有限公司。
1.2.2 载体pET-28a载体由南开大学植物生理与分子生物学实验室保存。
1.3 分子生物学试剂Trans 2000 plus(2 K plus)DNA marker、Trans 15 K DNA marker、6×Loading Buffer、T4连接酶、5×T4 Ligase Buffer、2×EasyTaq PCR SuperMix (+dye)、TransStart FastPfu Fly DNA Polymerase和pEASY-Blunt Simple Cloning Kit均购买自北京全式金生物技术有限公司;Eastep Super总RNA提取试剂盒购自普洛麦格(北京)生物技术有限公司;Reverse Transcriptase M-MLV(RNase H-)试剂盒、Taq DNA聚合酶、10×PCR Buffer、Not I限制性内切酶、Sal I限制性内切酶、10×H Buffer、0.1% BSA和dNTP均购买自大连宝生物公司(TAKARA);异丙基硫代半乳糖苷(isopropyl-1-thio-β-D-galactopyr-anoside,IPTG)、卡那霉素购自北京鼎国昌盛生物科技有限公司;快速琼脂糖凝胶DNA纯化回收试剂盒、高纯度质粒小提试剂盒购自北京康为世纪;引物合成和基因测序由华大基因有限公司完成。
2 方法 2.1 叶片总RNA提取及SmGPPS全长cDNA的克隆按照Eastep Super总RNA提取试剂盒的说明书,提取川西獐牙菜叶片的总RNA;并按照Reverse Transcriptase M-MLV(RNase H-)试剂盒说明书合成cDNA,−40 ℃保存备用。根据川西獐牙菜转录组SmGPPS基因序列和原核表达载体pET-28a多克隆酶切位点,设计一对特异性引物:SmGPPS-UP 5’-GGAATTCCATATGAGTTTGGTGAATTCTACTG-CTACAT-3’;SmGPPS-DP 5’-CGAGCTCAAACTT-AATTATCCCTGTAAGCAATATAAT-3’以cDNA为模板进行PCR扩增,50 μL PCR反应体系为SmGPPS-UP(10 μmol/L)1 μL;SmGPPS-DP(10 μmol/L)1 μL;dNTP(2.5 mmol/L)4 μL;5×TransStart FastPfu Fly Buffer 10 μL;双蒸馏水32 μL;TransStart FastPfu Fly DNA Polymerase(125 U/μL)1 μL;川西獐牙菜cDNA 1 μL。阴性对照为将该体系中的模板替换为双蒸馏水。反应条件为94 ℃、5 min;94 ℃、30 s;60 ℃、30 s;72 ℃,90 s;30个循环;72 ℃延伸10 min。
2.2 SmGPPS基因的测序与分析SmGPPS基因PCR产物经过0.8%的琼脂糖凝胶电泳检测,用快速琼脂糖凝胶DNA纯化回收试剂盒对目的片段进行纯化。取4 μL纯化后的目的片段与1 μL的pEASY-Blunt Cloning Vector混匀在25 ℃下反应10 min。取5 μL的连接产物转化Escherichia coli Trans 5α感受态细胞,涂布于添加卡那霉素(50 mg/L)的LB平板上,37 ℃培养12 h后挑取阳性克隆。通过菌落PCR初步筛选阳性克隆,20 μL菌落PCR的体系为SmGPPS-UP(10 μmol/L)1 μL;SmGPPS-DP(10 μmol/L)1 μL;dNTP(2.5 mmol/L)2 μL;10×PCR Buffer 2 μL;双蒸馏水13 μL;Taq DNA聚合酶(50 U/μL)1 μL;用牙签蘸取的菌落作为模板。扩大培养阳性克隆后获得菌液,利用康为世纪试剂公司的高纯度质粒小提试剂盒进行质粒的提取。通过质粒PCR和质粒双酶切进行鉴定,其中20 μL质粒PCR的体系为SmGPPS-UP(10 μmol/L)1 μL;SmGPPS-DP(10 μmol/L)1 μL;dNTP(2.5 mmol/L)2 μL;10×PCR Buffer 2 μL;双蒸馏水13 μL;Taq DNA聚合酶(50 U/μL)1 μL;质粒1 μL。在该过程中菌落PCR与质粒PCR的反应条件均为94 ℃、5 min;94 ℃、30 s;60 ℃、30 s;72 ℃,90 s;30个循环;72 ℃延伸10 min。20 μL质粒双酶切鉴定的体系为Not I限制性内切酶(10 U/μL)1 μL、Sal I限制性内切酶(10 U/μL)1 μL、10×H Buffer 2 μL、0.1% BSA 2 μL、双蒸馏水9 μL;质粒5 μL。将双酶切体系混匀后,37 ℃反应4 h。选取质粒PCR和质粒双酶切鉴定正确的质粒进行测序,获得重组载体pEASY-Blunt Cloning Vector-SmGPPS(简称B-SmGPPS)。
2.3 SmGPPS的生物信息学分析利用NCBI网站上的BLAST程序进行序列比对,应用DNAMAN软件推测和比对氨基酸序列,颜色利用MEGA 7[14]将川西獐牙菜SmGPPS氨基酸序列与近缘植物同源基因序列进行比对,并进行替代模型计算,检测到最适模型为LG+G。后利用PHYML3[15]进行最大似然法系统发育分析,ML树的初始树为BioNJ,以自展抽样分析1 000次以检测分支置信度,分支处的数字表示改分支分析的可靠程度,数值越大,可信度越高。
利用ExPASy ProtParam tool工具分析SmGPPS编码氨基酸的理化性质,利用PredictProtein方法(https://ppopen.informatik.tu-muenchen.de/)对SmGPPS进行二级结构分析。使用SWISS-MODEL服务器进行蛋白质三级结构预测。利NCBI网站上CDD分析SmGPPS蛋白保守域。
2.4 原核表达载体的构建将B-SmGPPS重组载体和pET-28a载体分别进行Not I和Sal I双酶切,40 μL双酶切的体系为Not I限制性内切酶(10 U/μL)2 μL、Sal I限制性内切酶(10 U/μL)2 μL、10×H Buffer 4 μL、0.1% BSA 4 μL、质粒28 μL,37 ℃反应4 h。回收目的基因和载体片段,经T4连接酶连接,其中11 μL连接体系为目的片段6 μL;载体片段2 μL;5×T4 Ligase Buffer 2 μL;T4连接酶(1 000 U/μL)1 μL,25 ℃反应10 min后转化BL21(DE3)感受态细胞,涂布于添加卡那霉素(50 mg/L)的LB培养基上,37 ℃培养12 h后挑取阳性克隆,通过菌落PCR得到阳性克隆,20 μL菌落PCR的体系为SmGPPS-UP(10 μmol/L)1 μL;SmGPPS-DP(10 μmol/L)1 μL;dNTP(2.5 mmol/L)2 μL;10×PCR Buffer 2 μL;双蒸馏水13 μL;Taq DNA聚合酶1 μL;用牙签蘸取的菌落作为模板。进行扩大培养阳性克隆后获得菌液,利用康为世纪试剂公司的高纯度质粒小提试剂盒进行质粒的提取。通过质粒PCR和质粒双酶切进行鉴定,其中20 μL质粒PCR的体系为SmGPPS-UP(10 μmol/L)1 μL;SmGPPS-DP(10 μmol/L)1 μL;2.5×dNTP 2 μL;10×PCR Buffer 2 μL;双蒸馏水12 μL;Taq DNA聚合酶(50 U/μL)1 μL;质粒1 μL。在该过程中菌落PCR与质粒PCR的反应条件均为94 ℃、5 min;94 ℃、30 s;60 ℃、30 s;72 ℃,90 s;30个循环;72 ℃延伸10 min。20 μL质粒双酶切鉴定的体系为Not I限制性内切酶(10 U/μL)1 μL、Sal I限制性内切酶(10 U/μL)1 μL、10×H Buffer 2 μL、0.1% BSA 2 μL、双蒸馏水9 μL;质粒5 μL。将双酶切体系混匀后,37 ℃反应4 h。选取质粒PCR和质粒双酶切鉴定正确的质粒进行测序,获得原核表达载体pET-28a-SmGPPS。构建流程见图 1。
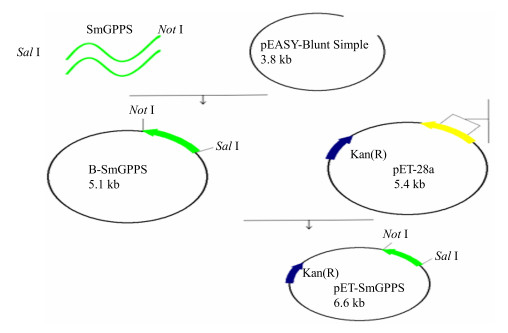
|
图 1 原核表达载体pET-28a-SmGPPS构建流程 Fig.1 Construction of pET-28a-SmGPPS vector |
2.5 SmGPPS在大肠杆菌中的原核表达
利用热激的方法将重组质粒pET-28a-SmGPPS和pET-28a空载质粒转化大肠杆菌BL21(DE3)感受态细胞,分别作为实验组与阴性对照组,经过酶切鉴定和测序后,得到转化成功并且测序正确的菌株。分别挑取单菌落进行液体培养,将其接种于5 mL的LB液体培养基(含有50 mg/L卡那霉素)中,37 ℃ 150 r/min过夜培养。次日以1:100的比例转接到含有卡那霉素50 mg/L的LB液体培养基中,培养至600 nm吸光度(A600)值0.6~0.8;在37 ℃、150 r/min条件下,在对照组与实验组中分别加入IPTG(终浓度1 mmol/L)进行诱导。实验组诱导的时间分别为4、7、18 h;阴性对照组诱导18 h。收集以上4组菌液50 mL,12 000 r/min 4 ℃离心10 min后,弃去上清,加入250 μL的5×SDS-PAGE上样缓冲液[1 mol/L Tris-HCl(pH 6.9)、10% SDS、0.5%溴酚蓝、50%甘油、5% β-巯基乙醇],250 μL去离子水,震荡涡旋混匀,100 ℃煮沸10 min。冰浴5 min后,室温12 000 r/min离心2 min,取上清液进行稀释上样。取8 μL上清液,加入6 μL的去离子水和6 μL的5×SDS-PAGE上样缓冲液进行涡旋混匀,后取10 μL进行上样。进行SDS-PAGE(5%浓缩胶和12%分离胶)电泳检测。
2.6 SmGPPS在不同组织中的半定量RT-PCR表达分析取处于抽薹期川西獐牙菜的叶片,茎和花苞,按照Eastep Super总RNA提取试剂盒提供的说明书,进行RNA的提取。利用Nanodrop2000和琼脂糖凝胶电泳对RNA进行浓度及质量检测,取等量的RNA进行反转录。以反转录第一链cDNA为模板进行PCR。反应中使用actin基因作为内参基因扩增长度为200 bp,actin基因上游引物为:5’-ACTGGTGTTATGGTTGGTATGG-3’,actin基因下游引物为5’-TCGGTGAGAAGTATAGGGTGC-3’。利用川西獐牙菜中SmGPPS的特异性引物扩增长度为252 bp检测在叶片、茎和花苞中SmGPPS基因表达情况。SmGPPS上游引物为5’-ATTTGGTGGTGA-TGAATCTATTG-3’,SmGPPS下游引物为5’-CCAAT-CACTCTCACAATTCTATCTG-3’。在预实验中确定了最佳循环数,使扩增产物处在平台期前的线性增长期,最终扩增actin基因和SmGPPS基因选取了相同的PCR扩增体系和反应程序。PCR扩增体系:上游引物(10 μmol/L)1 μL;下游引物(10 μmol/L)1 μL;2×EasyTaq PCR SuperMix (+dye) 25 μL;双蒸馏水22 μL;cDNA 1 μL。负对照为将该体系中的模板替换为双蒸馏水。反应程序为94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,27个循环后,72 ℃延伸10 min。以1%的琼脂糖凝胶电泳来分析扩增产物,将在各器官中actin基因扩增产物的亮度调成一致,比较各个器官的SmGPPS基因扩增产物的亮度。
3 结果与分析 3.1 川西獐牙菜SmGPPS基因的开放阅读框(ORF)的克隆根据之前得到的转录组信息,获得的中间片段、5’端片段和3’端片段拼接,得到SmGPPS基因全长cDNA序列。RT-PCR扩增cDNA编码区ORF后得到一条预期大小的DNA片段,见图 2。连接pEASY-Blunt Cloning vector载体后,转化,筛选阳性克隆,双酶切验证后(图 3),送华大基因公司测序。测序结果表明SmGPPS(登录号为KX372563)全长1 119 bp,编码372个氨基酸(图 4)。
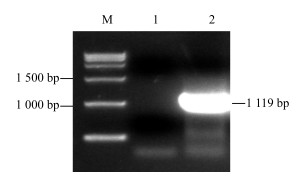
|
M-DNA相对分子质量标准Trans2K plusⅡ 1-阴性对照2-SmGPPS基因的RT-PCR产物 M-DNA Marker Trans2K plusⅡ 1-control 2-RT-PCR product of SmGPPS 图 2 SmGPPS基因的RT-PCR扩增 Fig.2 RT-PCR detection of SmGPPS gene |
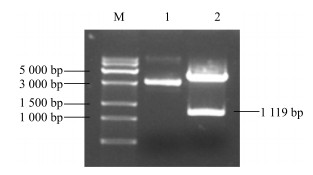
|
M-DNA相对分子质量标准Trans15K 1-B-SmGPPS质粒2-B-SmGPPS质粒经过Sal I和Not I双酶切鉴定 M-DNA Marker Trans15K 1-plasmid of B-SmGPPS 2-digestion result of plasmid B-SmGPPS digested by Sal I and Not I 图 3 B-SmGPPS载体的双酶切检测图 Fig.3 Digestive detection of B-SmGPPS plasmid |
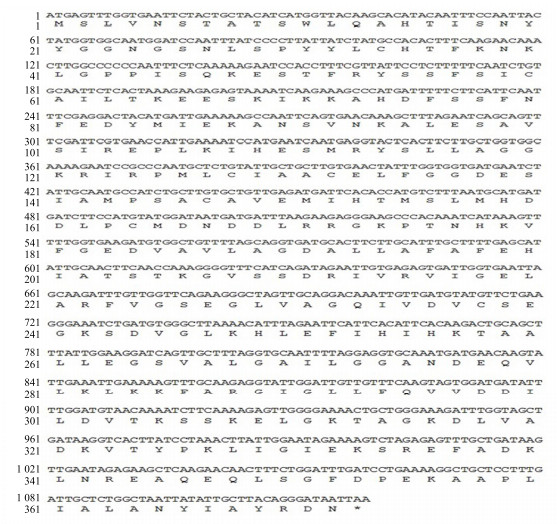
|
图 4 SmGPPS基因的ORF及预测的氨基酸序列 Fig.4 ORF box of SmGPPS and predicted amino acid sequence |
3.2 川西獐牙菜SmGPPS基因的生物信息学分析 3.2.1 川西獐牙菜SmGPPS蛋白质序列分析
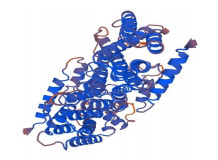
利用ExPASy ProtParam tool工具分析SmGPPS编码氨基酸的理化性质,SmGPPS相对分子质量为40 583.53,理论等电点pI为6.28,分子式为C1801H2875N487O545S16,半衰期为30 h。不稳定指数为37.89,脂肪族指数为92.88,总平均疏水性为−0.093。利用PredictProtein方法(https://ppopen.informatik.tu-muenchen.de/)对SmGPPS进行二级结构分析。结果表明该蛋白二级结构中α-螺旋(H)占53.76%,β-折叠(E)占3.23%,无规卷曲(C)占43.01%。该蛋白含有20种氨基酸,其中亮氨酸量最高,为10.22%;其次是丙氨酸,为9.68%;色氨酸量最低,为0.3%。利用Swiss-Model Workspace预测SmGPPS蛋白的三级结构,结果如图 5所示,与二级结构预测结构一致。
|
图 5 SmGPPS蛋白质的三维结构预测 Fig.5 Predicted three dimensional structure of SmGPPS protein |
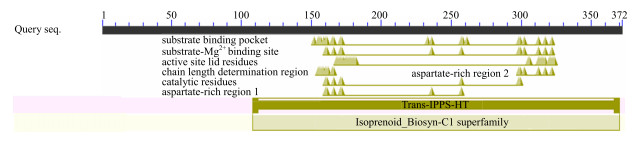
利用推测的蛋白质序列检索NCBI的CDD(Conserved Domain Database)数据库,发现SmGPPS氨基酸序列中含有异戊二烯焦磷酸合酶保守区域(Trans_IPPS_HT),属于类异戊二烯合酶(Isoprenoid_Biosyn_C1)超家族成员(图 6),其功能可能与单萜类物质的合成有关。
|
图 6 SmGPPS蛋白保守域分析 Fig.6 Conserved domain prediction of SmGPPS protein |
3.2.2 氨基酸序列同源性分析
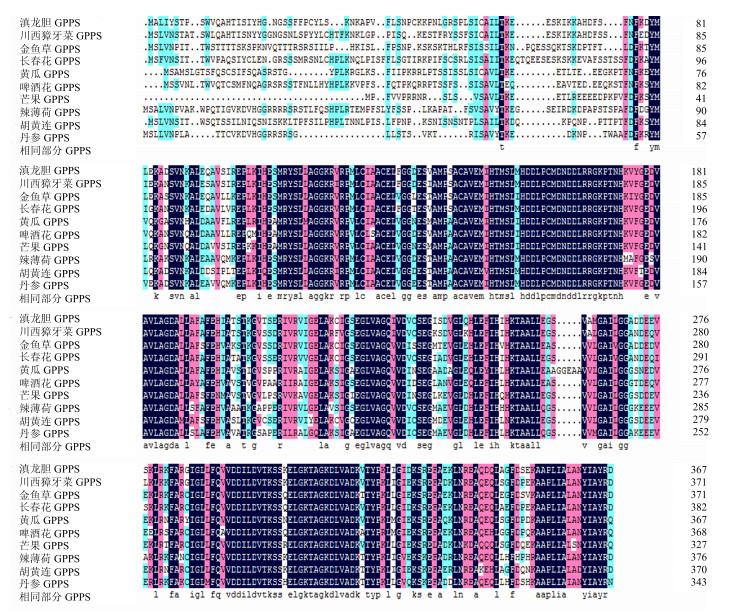
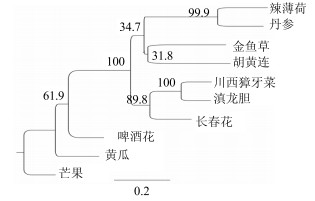
经DNAMAN比对分析,川西獐牙菜SmGPPS的氨基酸序列与其他植物相似性较高(图 7)。图 7中不同颜色区域表示SmGPPS氨基酸与其他植物中GPPS氨基酸的同源程度,黑色区域代表同源程度到达100%。川西獐牙菜(KX372563)与长春花Catharanthus roseus(L.) G. Don(AEI53622.1)、啤酒花Humulus lupulus L.(ACQ90682.1)、丹参Salvia miltiorrhizaBunge(AEZ55681.1)、芒果Mangifera indicaL.(AFJ52722.1)、金鱼草Antirrhinum majus L.(AAS82860.1)、胡黄连Picrorhiza scrophulariifloraPennell(AAW66658.1)、辣薄荷Mentha piperita L.(AAF08793.1)、滇龙胆Gentiana rigescens Franch(ALS54746.1)、黄瓜Cucumis sativusL.(KGN62082.1)的GPPS蛋白质分子的相似度分别为74.8%、68.1%、65.6%、65.1%、72.1%、69.5%、67.2%、83.2%和67.3%。其保守性可能与其在植物体内的功能有关。最大似然法系统发育分析显示,川西獐牙菜与滇龙胆共聚于一个分支。物种间系统发育关系与已知的分类学地位相符合(图 8)。
|
图 7 SmGPPS与其他植物中GPPS氨基酸序列的多序列比对结果 Fig.7 Multiple sequence alignment of SmGPPS amino acid sequence with GPPS in other plants |
|
图 8 SmGPPS与相关物种GPPS蛋白的系统发育分析 Fig.8 Phylogentic relationship of SmGPPS and some other GPPS proteins |
3.3 川西獐牙菜SmGPPS蛋白的原核表达 3.3.1 SmGPPS基因原核表达载体的构建
将已经克隆得到的SmGPPS基因片段与原核表达载体pET-28a载体连接,阳性克隆用Sal I和Not I双酶切鉴定(图 9)并进行测序,测序结果无误后,将其转入大肠杆菌BL21(DE3)中。
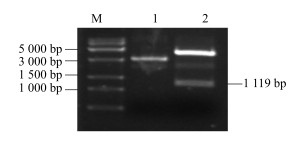
|
M-DNA相对分子质量标准Trans15K 1-pET-28a-SmGPPS质粒2-pET-28a-SmGPPS质粒经过Sal I和Not I双酶切鉴定 M-DNA Marker Trans15K 1-plasmid of pET-28a-SmGPPS 2-digestion result of plasmid pET-28a-SmGPPS digested by Sal I and Not I 图 9 pET-28a-SmGPPS载体的双酶切电泳 Fig.9 Digestive detection of pET-28a-SmGPPS plasmid |
3.3.2 将pET-28a-SmGPPS转入表达菌株BL21(DE3)中进行原核表达
将pET-28a-SmGPPS转入表达菌株BL21(DE3)后,经酶切及测序鉴定后,均证明得到了正确的转化菌株。而后进行蛋白表达条件的摸索与优化,一般优化原核蛋白表达条件的方法包括改变IPTG的浓度、诱导温度及时间。本研究原核表达的诱导条件参考文献报道[12-13],直接选择IPTG 1 mmol/L,温度为37 ℃进行诱导,故本研究主要是通过改变诱导时间进行优化。最终,通过条件摸索,选择IPTG 1 mmol/L,温度为37 ℃,进行了4、7、18 h的诱导后获得了该蛋白的包涵体。将转入pET-28a载体的BL21菌株作为阴性对照,SDS-PAGE电泳检测诱导18 h的蛋白量与诱导4 h和7 h的相比明显增多,其在相对分子质量4.1×104大小处有明显的条带,该位置与根据软件预测的SmGPPS蛋白的相对分子质量大小一致(图 10)。
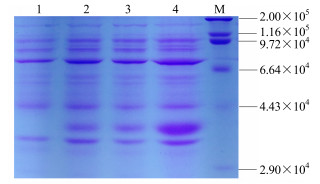
|
M-TaKaRa蛋白质分子量相对分子质量标准Marker 1-转入pET-28a载体的BL21菌株2~4-分别为转入pET-28a-SmGPPS表达载体的BL21菌株诱导4、7、18 h的总蛋白 M-TaKaRa protein Marker 1-the expressed product of pET-28a with 1 mmol/L of IPTG induction for 18 h at 37 ℃ 2-4-the expressed product of pET-28a-SmGPPS with 1 mmol/L of IPTG induction for 4, 7, and 18 h separately at 37 ℃ 图 10 原核表达SmGPPS的SDS-PAGE电泳检测 Fig.10 Prokaryotic expression detection of SmGPPS gene by SDS-PAGE |
3.4 川西獐牙菜SmGPPS基因在不同组织的表达分析
利用半定量RT-PCR检测SmGPPS的组织差异表达,检测了该基因在川西獐牙菜叶茎、花中的表达量。首先将不同组织中actin基因扩增产物(200 bp)的电泳亮度调成一致(图 11),在同样条件下分析SmGPPS基因(252 bp)在不同组织的表达差异(图 12)。结果表明该基因在叶中的表达量最高。
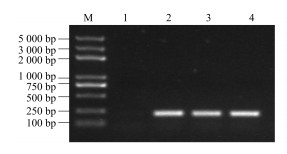
|
M-DNA相对分子质量Trans2k plus 1-阴性对照2~4-叶、茎、花中的actin基因的RT-PCR扩增 M-DNA Marker Trans2K plusⅡ 1-control 2-4-RT-PCR product of actin in leaf, stem or flower, respectively 图 11 半定量RT-PCR检测actin基因在不同组织的表达 Fig.11 Actin expression in various plant organs by semi-quantitative RT-PCR |
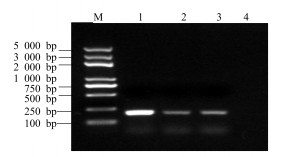
|
M-DNA相对分子质量Trans2k plus 1~3-叶、茎、花中的SmGPPS基因的RT-PCR扩增4-阴性对照 M-DNA Marker Trans2K plusⅡ 1-3-RT-PCR product of SmGPPS in leaf, stem or flower, respectively 4-control 图 12 半定量RT-PCR检测SmGPPS基因在不同组织的表达 Fig.12 SmGPPS expression in various plant organs by semi-quantitative RT-PCR |
4 讨论
牻牛儿基焦磷酸合成酶(GPPS)是单萜化合物合成的关键酶,催化1分子的IPP与DMAPP形成GPP,为单萜化合物的合成提供碳骨架。本研究首次在川西獐牙菜中克隆了SmGPPS基因的ORF序列,经比对分析,川西獐牙菜SmGPPS的氨基酸序列与其他植物的相似性较高,川西獐牙菜与滇龙胆共聚于一个分支。物种间系统发育关系与已知的分类学地位相符合。
利用相关软件预测了SmGPPS的三维结构,多为α-螺旋和无规卷曲,形成了一个孔穴结构,推测这可能是与底物结合的重要部位。Coscia等[9]第1次从薄荷属植物椒样薄荷中分离出由2个亚基组成的异型二聚体GPPS蛋白,即GPPS蛋白包括大亚基和小亚基。Coscia等[10]从长春花中克隆到CrGPPS基因,发现CrGPPS在长春花中以杂聚肽和同聚肽2种形式存在。推测目前克隆的序列有可能是GPPS蛋白的大亚基,在植物中GPPS大亚基的氨基酸序列比小亚基序列更为保守。至于川西獐牙菜中SmGPPS蛋白是杂聚肽还是同聚肽,还需要深入开展实验来证明。
SmGPPS在川西獐牙菜不同组织中的表达有明显差异,叶片中表达量最高,此结果与叶中环烯醚萜化合物较高的结论是一致的[16]。证明了GPPS可能是川西獐牙菜中环烯醚萜化合物合成途径中的关键酶。本研究组正在通过过表达或敲减表达SmGPPS来验证该基因在川西獐牙菜中的功能。
川西獐牙菜野生资源匮乏,加上缺乏环境保护、人工大量采挖,野生资源逐年减少。随着藏药产品开发的进一步升温,对藏药材的需求量越来越大,藏药材的价格越来越高,藏药资源短缺越来越明显[17]。近年利用分子生物学手段来提高川西獐牙菜有效成分量的研究较少,因此,本研究将对獐牙菜苦苷及龙胆苦苷生物合成关键酶基因SmGPPS进行克隆和蛋白质功能预测,将为构建其过表达载体和遗传转化体系,进一步实现环烯醚萜成分在植株中高效表达提供理论基础,并为开展川西獐牙菜及类似以环烯醚萜化合物为主要活性成分植物的遗传改良、提高药材品质具有十分重要的理论意义和实践价值。
| [1] | 舒光明. 川西獐牙菜的化学成分、药理作用和临床应用研究进展[J]. 现代药物与临床, 2012, 27(2):176–179. |
| [2] | 纪兰菊, 保怡, 陈桂琛, 等. 15种獐牙菜属植物中主要药用成分的高效液相色谱测定[J]. 西北植物学报, 2004, 24(7):1298–1302. |
| [3] | Medda S, Mukhopadhyay S, Basu M K. Evaluation of the in-vivo activity and toxicity of amarogentin, an antileishmanial agent, in both liposomal and niosomal forms[J]. J Antimicrob Chemother, 1999, 44(6): 791–794. DOI:10.1093/jac/44.6.791 |
| [4] | 刘占文, 陈长勤, 金若敏, 等. 龙胆苦苷的保肝作用研究[J]. 中草药, 2002, 33(1):47–50. |
| [5] | 严永清. 中药辞海[M]. 北京: 中国医科技出版社, 1996. |
| [6] | 乔伟, 张彦文, 吴寿金, 等. 天然环烯醚萜类化合物的生物活性[J]. 国外医药:植物药分册, 2001, 16(2):65–67. |
| [7] | 王海霞, 黄慧明, 苑祥, 等. 川西獐牙菜不同部位对人胃癌细胞MGC-803增殖抑制作用和细胞周期的影响[J]. 药物评价研究, 2016, 37(5):735–740. |
| [8] | 赵军胜, 蔡云飞, 李子东, 等. 胡萝卜与川西獐牙菜不对称体细胞杂交研究[J]. 山东大学学报, 2004, 39(6):108–111. |
| [9] | Coscia C J, Guarnaccia R. Natural occurrence and biosynthesis of a cyclopentanoid monoterpene carboxylic acid[J]. Chem Commun, 1968, 3: 138–140. |
| [10] | Coscia C J, Botta L, Guarnaccia R. On the mechanism of iridoid and secoiridoid monoterpene biosynthesis[J]. Arch Biochem Biophys, 1970, 136(2): 498–506. DOI:10.1016/0003-9861(70)90221-3 |
| [11] | Burke C C, Wildung M R, Croteau R. Geranyl diphosphate synthase:cloning, expression, and characterization of this prenyltransferase as a heterodimer[J]. P Natl Acad Sci USA, 1999, 96(23): 13062–13067. DOI:10.1073/pnas.96.23.13062 |
| [12] | Rai A, Smita S S, Singh A K, et al. Heteromeric and homomeric geranyl diphsophate synthases from Catharanthus Roseus and their role in monoterpene indole alkaloid biosynthesis[J]. Mol Plant, 2013, 6(5): 1531–1549. DOI:10.1093/mp/sst058 |
| [13] | 王彩云, 李富生, 李涛, 等. 滇龙胆GrGPPS基因的克隆及其序列分析与原核表达[J]. 中草药, 2014, 45(14):2060–2068. |
| [14] | Kumar S G, Stecher, Tamura K. MEGA7:Molecular evolutionary genetics analysis Version 7. 0 for bigger datasets[J]. Mol Biol Evol, 2016, 33(7): 1870–1874. DOI:10.1093/molbev/msw054 |
| [15] | Guindon S J F, Dufayard V, Lefort M, et al. New algorithms and methods to estimate maximum-likelihood phylogenies:Assessing the performance of PhyML 3.0[J]. Syst Biol, 2010, 59(3): 307–321. DOI:10.1093/sysbio/syq010 |
| [16] | 陈刚, 张元忠, 田华咏, 等. 獐牙菜植物器官獐牙菜苦苷含量分布规律研究[J]. 中国民族医药杂志, 2010, 16(1):58–59. |
| [17] | 杨慧玲, 刘建全. 重要藏药川西獐牙菜种子萌发的研究[J]. 云南植物研究, 2005, 27(3):295–300. |
 2017, Vol. 48
2017, Vol. 48


