2. 南开大学医学院, 天津 300071;
3. 天津市中医药研究院, 天津 300022;
4. 天津市公安医院, 天津 300050
2. Medical School of Nankai University, Tianjin 300071, China;
3. Tianjin Academy of Traditional Chinese Medicine, Tianjin 300022, China;
4. Tianjin Gongan Hospital, Tianjin 300050, China
顺铂(CDDP)是当前临床上最有效和最常用的抗肿瘤药物之一,广泛用于治疗膀胱癌、卵巢癌、头颈部鳞癌、睾丸癌、非小细胞肺癌等多种实体肿瘤[1]。然而CDDP化疗却受肿瘤细胞抵抗和严重的不良反应如肾毒性、耳毒性、神经毒性和致吐作用等因素的限制,其中,肾毒性是最主要的限制因素[2]。
五味子乙素(schisandrin B,SchB)为五味子中Schisandrachinensis(Turcz.) Baill.量最高的联苯环辛烯类木脂素[3],大量基础研究表明SchB具有抗氧化、抗肿瘤、降糖、抗炎等多种药理作用[4-5]。已有研究表明,SchB对CDDP所致鼠的急性肾损伤具有保护作用[6-7]。本研究拟从体外水平检测SchB对CDDP诱导的肾小管上皮细胞损伤的保护作用,并观察其对P21和Caspase-3表达的影响,初步探讨其可能机制,以期为减轻CDDP化疗中的不良反应提供研究思路。
1 材料 1.1 细胞人类近端肾小管上皮细胞(HK-2)购自美国模式培养物集存库(ATCC),中国科学院干细胞库编号SCSP-511。
1.2 药品与试剂SchB(质量分数≥99%),上海融禾医药科技发展有限公司,批号140926;CDDP,齐鲁制药有限公司,批号H20023460;DMEM/F12培养基、胎牛血清、胰酶,美国Gibco公司;二甲基亚砜(DMSO)、RIPA蛋白裂解液,美国Sigma公司;CCK-8试剂盒,日本Dojindo公司;AnnexinV-FITC/PI凋亡检测试剂盒,美国BD公司;兔抗P21多克隆抗体、鼠抗β-actin单克隆抗体、辣根过氧化物酶标记山羊抗兔IgG二抗,美国Santa Cruz公司;兔抗Caspase-3多克隆抗体,美国CST公司。
1.3 仪器倒置显微镜,日本Olympus公司;流式细胞仪,美国BD公司;细胞培养箱、台式高速低温离心机、酶标仪,美国Thermo公司,SDS-PAGE电泳仪,美国Bio-Rad公司;全自动化学发光图像分析系统,上海天能公司。
2 方法 2.1 CCK-8法检测HK-2细胞活性在96孔板培养细胞,每孔5 000个细胞,细胞贴壁后,换无血清培养基培养16 h使细胞周期同步化,对照组细胞未经任何处理,CDDP组加入50 μmol/L的CDDP处理24 h,SchB预保护组(CDDP+SchB)分别加入终浓度为5、10、20 μmol/L SchB预处理2 h后,其余操作同CDDP组。处理完成后每孔加CCK-8试剂10 μL,37 ℃孵育2 h,选择450 nm波长,在酶标仪上测定各孔的吸光度(A)值,并计算细胞活性。实验重复3次。
细胞活性=(A加药-A空白)/(A对照-A空白)
2.2 AnnexinV-FITC/PI双标记流式细胞仪检测细胞凋亡率待细胞在6孔板中培养至对数生长期,换无血清培养基培养16 h使细胞周期同步化,细胞分组及药物处理同“2.1”项,胰酶消化收集各组细胞,2 000 r/min离心5 min,用PBS洗涤细胞2次(2 000 r/min离心5 min),用500 μL缓冲液重悬细胞后,先加入5 μL AnnexinV-FITC染色液混匀后,再加入5 μL PI染色液,混匀后室温避光孵育10 min。筛网滤过后,用流式细胞仪检测细胞凋亡率。FlowJo软件计算分析各组细胞AnnexinV-FITC和PI染色细胞百分比例。
2.3 Western blotting检测P21和Caspase-3蛋白表达待细胞在6孔板中培养至对数生长期,换无血清培养基培养16 h使细胞周期同步化,细胞分组及药物处理同“2.1”项,接种于6孔板中的各组细胞以预冷的PBS液洗2次,加入50 μL预冷蛋白裂解液,细胞刮刀收集样本于1.5 mL EP管中,冰上裂解30 min,4℃、12 000 r/min离心10 min,取上清液。2, 2-联喹啉-4, 4-二甲酸二钠(BCA)法蛋白定量、配样,100 ℃、10 min变性后上样。经12%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,将目的蛋白转移至硝酸纤维素膜上,5%脱脂奶粉封闭1 h,用等渗盐溶液加Tris-HCl缓冲液(TBST)冲洗后分别加入1:1 000稀释的兔抗P21、Caspase-3、β-actin的抗体,4 ℃孵育过夜。TBST洗膜3次,每次10 min,加入1:5 000稀释的辣根过氧化物酶标记山羊抗兔IgG,室温孵育1 h,TBST洗膜3次,每次10 min,ECL发光液显色,全自动化学发光图像分析系统曝光。以β-actin为内参,检测P21、Caspase-3蛋白的表达。采用ImageJ软件分析灰度值。
2.4 倒置显微镜观察HK-2细胞形态待细胞在6孔板中培养至对数生长期,换无血清培养基培养16 h使细胞周期同步化,细胞分组及药物处理同“2.1”项,于倒置显微镜下观察并拍照,后用计数工具进行计数处理。
2.5 统计学方法数据均以x±s表示,采用SPSS 20.0统计软件分析数据,组间比较采用单因素方差分析,多重比较采用LSD法。
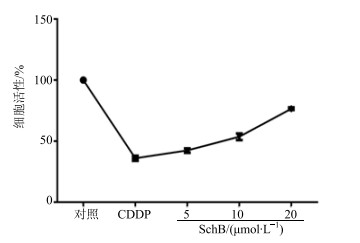
3 结果 3.1 对HK-2细胞活性的影响与对照组相比,CDDP组细胞活性明显降低,SchB预保护组较CDDP组细胞活性显著增加(P<0.01),且随浓度的升高,细胞活性逐渐增强,表现出浓度依赖性。结果见图 1。
|
图 1 SchB对CDDP损伤的HK-2细胞活性的影响 (x±s, n=3) Fig.1 Effects of SchB on cell viability of HK-2 cells injuried by CDDP (x±s, n=3) |
3.2 对CDDP诱导的细胞凋亡的影响
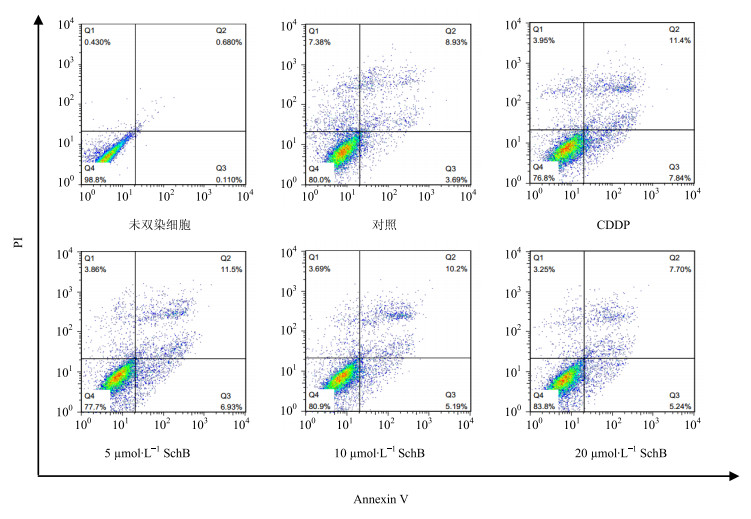
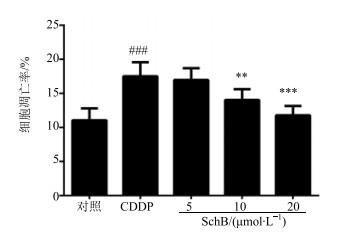
与对照组相比,CDDP组细胞凋亡率显著增加(P<0.001);SchB预保护组显著降低凋亡率并呈剂量依赖性,中、高剂量组与CDDP组比较差异显著(P<0.01)。结果见图 2和图 3。
|
图 2 细胞流式仪检测各组HK-2细胞凋亡率 Fig.2 Results of apoptosis ratio of HK-2 cells in each group detected by flow cytometry |
|
与对照组比较:###P<0.001;与CDDP组比较:**P<0.01 ***P<0.001 ###P < 0.001 vs control group; **P < 0.01 ***P < 0.001 vs CDDP group 图 3 SchB对CDDP诱导的HK-2细胞凋亡的影响 (x±s, n=3) Fig.3 Effects of SchB on CDDP induced apoptosis in HK-2 cells (x±s, n=3) |
3.3 对细胞形态及数目的影响
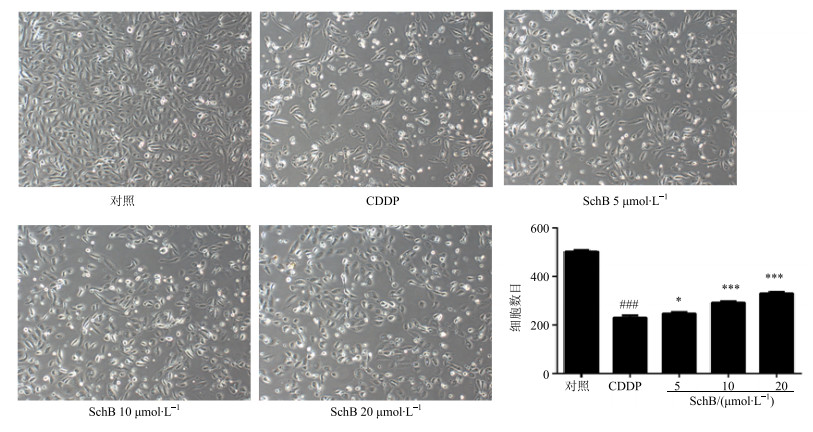
与对照组相比,CDDP组细胞数目明显减少(P<0.001),SchB预保护组细胞数目显著增加并呈剂量依赖性,中、高剂量组与CDDP组比较差异显著(P<0.001)。正常的HK-2细胞光镜下呈多边鹅卵石样,体积较大,细胞紧密连接,可见融合。CDDP 50 μmol/L作用于HK-2后镜下可见细胞体积明显缩小,相互连接消失。SchB预保护组,镜下可见细胞形态的损伤明显减轻,体积略微缩小,相互间连接断裂减少,见图 4。
|
与对照组比较:###P<0.001;与模型组比较:*P<0.05 ***P<0.001 ###P < 0.001 vs control group; *P < 0.05 ***P < 0.001 vs model group 图 4 SchB对各组HK-2细胞形态和数目的影响 Fig.4 Effect of schisandrin B on cell morphology and number of HK-2 cells in each group |
3.4 对P21蛋白表达量的影响
与对照组相比,CDDP组P21表达量显著增加(P<0.01),SchB预保护组P21表达量显著增加并呈剂量依赖性,中、高剂量组与CDDP组比较差异显著(P<0.001),见图 5。
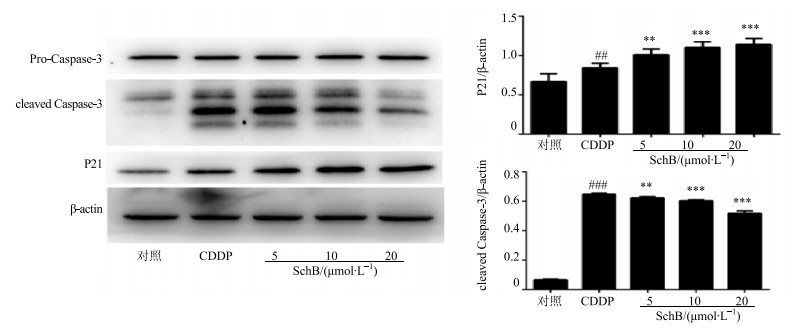
|
与对照组比较:## P<0.01 ### P<0.001;与模型组比较:**P<0.01 *** P<0.001 ##P < 0.01 ###P < 0.001 vs control group; **P < 0.01 ***P < 0.001 vs model group 图 5 各组HK-2细胞cleaved Caspase-3及P21的表达情况 (x±s, n=3) Fig.5 Expression of cleaved Caspase3 and P21 of HK-2 cells in each group (x±s, n=3) |
3.5 对cleaved Caspase-3蛋白表达量的影响
与对照组相比,CDDP组cleaved Caspase-3表达量显著增加(P<0.001),SchB预保护组cleaved Caspase-3表达量显著减少并呈剂量依赖性,中、高剂量组与CDDP组比较差异显著(P<0.001),见图 5。
4 讨论细胞凋亡又称程序性细胞死亡,是指为维护体内稳态,由基因控制的细胞自主有序性死亡,CDDP引起的肾毒性涉及CDDP的细胞毒作用、氧化应激、细胞凋亡及炎症反应等多种机制[8]。近年来CDDP诱导的细胞凋亡成为了研究热点[9]。CDDP诱导肾小管上皮细胞凋亡可通过2种途径:由线粒体介导的内源性途径和由死亡受体介导的外源性途径。此外,内质网应激在CDDP引发的肾小管上皮细胞凋亡中也发挥一定的作用[10]。本实验结果表明,CDDP诱导HK-2细胞活性显著下降,凋亡率显著增加。
在肾细胞CDDP的细胞毒性是依赖于细胞周期蛋白依赖性激酶2(CDK2)在体内外的激活[11-12]。P21基因定位于第6号染色体的短臂上(6P21.2),DNA长度为8.6×104 bp,有3个外显子,是细胞周期蛋白依赖性激酶抑制因子(CDKIs)的家族成员,是细胞周期的负调控因子。CDKIs通过与细胞周期蛋白、细胞周期蛋白依赖性激酶(CDKs)或细胞周期蛋白-CDK的结合,导致细胞周期阻滞,从而阻断细胞的增殖。已有研究证明,P21的过表达可使细胞周期阻滞于G1期、G2期或S期。P21抑制cyclinD1-C DK4和cyclinE-CDK2的活性,使视网膜母细胞瘤蛋白(pRb蛋白)不能发生磷酸化,E2F转录因子不能释放,从而使细胞周期停滞在G1期,DNA复制受抑制,从而使受损的细胞有充分的时间修复。尽管周期诱导产生内源性的P21,但是其保护作用是无效的[13]。本实验结果表明,CDDP组较对照组P21表达上调,但其凋亡率显著增加,与既往研究一致。而SchB组较CDDP组P21表达明显上调,且呈剂量依赖性,凋亡率显著减少,表明细胞周期蛋白已成为肾细胞死亡的主要分子调节剂并且在周期肾毒性中起保护作用[14]。
细胞凋亡涉及一系列蛋白,如Caspase家族蛋白、Bcl-2家族蛋白和P53蛋白、survivin。其中Caspase半胱氨酸天冬氨酸特异性蛋白酶(Cysteinyl aspartate specific proteinase,Caspase)家族是直接导致凋亡细胞解体的蛋白酶系统,在细胞凋亡机制网络中居中心地位[15]。Caspase分为3大类:凋亡启动因子(apoptotic initiators)、凋亡执行因子(apoptotic executioners)和炎症介导因子(inflammatory mediators),构成了级联放大效应。凋亡执行因子在级联反应的下游,包括Caspase-3、Caspase-6和Caspase-7等,作用于其特异性底物并导致细胞凋亡。Caspase-3,是Caspase家族中的最重要的凋亡执行者之一,是细胞凋亡过程中的主要效应因子,它的活化是凋亡进入不可逆阶段的标志。正常情况下,胞质中的Caspase-3以无活性的酶原形存在,细胞凋亡信号的出现可导致Caspase-3在多种蛋白水解酶的作用下,发生裂解而活化[16]。本实验结果表明,CDDP组活化的Caspase-3蛋白表达量显著增加,与流式细胞仪检测的细胞凋亡率的增加一致。
五味子是常用的滋补固涩类中药,性味温和,主产于东北和华北地区;神农本草经列为上品,具补益强壮之功、奏固涩生津之效,能对人体心、肝、脾、肺、肾发挥平衡作用。SchB是五味子属植物中的一个活性单体,既往研究结果表明,其具有抗氧化、抗衰老、抗肿瘤、抑菌、镇静、抗血管纤维化等作用,对心脑肝肾等重要器官均具有保护作用,而且对机体正常的细胞没有毒性作用。SchB已成功用于治疗庆大霉素所致的中毒性肾损害,并且可以有效预防金属汞对肾小球肾小管的损害[17]。
本研究初步证实SchB可能通过下调Caspase-3和上调P21的表达减少HK-2细胞的凋亡,从而对CDDP所致HK-2细胞损伤起到保护作用,且其保护呈剂量依赖性,但其具体机制还需经一步研究。
| [1] | Giaccone G. Clinical perspectives on platinum resistance[J]. Drugs, 2000, 59(Suppl 4): 9–17. |
| [2] | Pabla N, Dong Z. Cisplatin nephrotoxicity:mechanisms and renoprotective strategies[J]. Kidney Int, 2008, 73(9): 994–1007. DOI:10.1038/sj.ki.5002786 |
| [3] | 陶小芳, 宿树兰, 江署, 等. 五味子药渣提取物中木脂素类成分分析及其对急性肝损伤模型大鼠的保护作用[J]. 中草药, 2016, 47(17):3051–3057. |
| [4] | 潘瑶, 林剑霞, 李妍. 五味子乙素的药理作用研究概况[J]. 吉林医药学院学报, 2015, 36(1):60–62. |
| [5] | 史琳, 王志成, 冯叙桥. 五味子化学成分及药理作用的研究进展[J]. 药物评价研究, 2011, 34(3):208–212. |
| [6] | 吴银娜, 谭小月, 张勉之. 五味子乙素对顺铂所致小鼠急性肾损伤的干预作用[J]. 中国中西医结合急救杂志, 2015, 22(3):243–247. |
| [7] | 原丽欣. 五味子乙素对顺铂所致大鼠肾氧化损伤的保护作用[J]. 中国医院药学杂志, 2014, 34(10):825–828. |
| [8] | dos Santos N A, Carvalho Rodrigues M A, Martins N M, et al. Cisplatin-induced nephrotoxicity and targets of nephroprotection:an update[J]. Arch Toxicol, 2012, 86(8): 1233–1250. DOI:10.1007/s00204-012-0821-7 |
| [9] | Peres L A, da Cunha A D. Acute nephrotoxicity of cisplatin:molecular mechanisms[J]. J Bras Nefrol, 2013, 35(4): 332–340. DOI:10.5935/0101-2800.20130052 |
| [10] | Karasawa T, Steyger P S. An integrated view of cisplatin-induced nephroto xicity and ototoxicity[J]. Toxicol Lett, 2015, 237(3): 219–227. DOI:10.1016/j.toxlet.2015.06.012 |
| [11] | Price P M, Safirstein R L, Megyesi J. Protection of renal cells from cisplatin toxicity by cell cycle inhibitors[J]. Am J Physiol Renal Physiol, 2004, 286(2): F378–F384. DOI:10.1152/ajprenal.00192.2003 |
| [12] | Price P M, Yu F, Kaldis P, et al. Dependence of cisplatin-induced cell death in vitro and in vivo on cyclin-dependent kinase 2[J]. J Am Soc Nephrol, 2006, 17(9): 2434–2442. DOI:10.1681/ASN.2006020162 |
| [13] | Price P M, Safirstein R L, Megyesi J. The cell cycle and acute kidney injury[J]. Kidney Int, 2009, 76(6): 604–613. DOI:10.1038/ki.2009.224 |
| [14] | Price P M, Megyesi J, Safirstein R L. Cell cycle regulation:repair and regeneration in acute renal failure[J]. Kidney Int, 2004, 66(2): 509–514. DOI:10.1111/j.1523-1755.2004.761_8.x |
| [15] | Kaushal G P, Kaushal V, Hong X, et al. Role and regulation of activation of caspases in cisplatin-induced injury to renal tubular epithelial cells[J]. Kidney Int, 2001, 60(5): 1726–1736. DOI:10.1046/j.1523-1755.2001.00026.x |
| [16] | Visconti R, D'Adamio L. Functional cloning of genes regulating apoptosis in neuronal cells[J]. Methods Mol Biol, 2007, 399: 125–131. DOI:10.1007/978-1-59745-504-6 |
| [17] | 刘巍, 徐兆发, 杨海波, 等. 五味子乙素对汞性大鼠急性肾损伤的影响[J]. 中国工业医学杂志, 2011, 24(2):89–91. |
 2017, Vol. 48
2017, Vol. 48


