2. 河北中医学院, 河北 石家庄 050020
2. Hebei University of Chinese Medicine, Shijiazhuang 050020, China
持续蛋白尿是糖尿病肾病(diabetic nephropathy,DN)的主要临床表现,足细胞损伤、裂孔膜蛋白的丢失是形成蛋白尿的重要原因[1-2],有研究报道DN异常激活的Wnt/β-catenin通路介导了足细胞损伤所造成的nephrin等裂孔膜蛋白表达的减少、肾小球系膜细胞的增殖及肾间质的纤维化,从而造成蛋白尿持续进行性增多,阻断该通路的表达则能减轻足细胞损伤[3-5]。本课题组通过前期研究证实基于DN瘀血阻络而进行治疗的化瘀通络中药能够减少裂孔膜nephrin、podocin、CD2AP等蛋白的丢失,保护足细胞,减少蛋白尿的漏出[6-8]。基于此,本实验制备DN大鼠模型,探索该大鼠模型肾脏是否存在Wnt/β-catenin通路的异常表达,以及化瘀通络中药减轻足细胞损伤、减少蛋白尿的作用靶点是否与Wnt/β-catenin通路有关。
1 材料 1.1 动物清洁级雄性SD大鼠60只,体质量(100±20)g,购自河北医科大学实验动物中心,动物许可证号SCXK(冀)2013-1-003。
1.2 药物化瘀通络中药颗粒剂:丹参(1.8 g/袋,相当于饮片10 g,批号501306T)、川芎(1.3 g/袋,相当于饮片6 g,批号412272T)、水蛭(1.5 g/袋,相当于饮片3 g,批号408245T)、地龙(1.0 g/袋,相当于饮片10 g,批号501153T)、全蝎(1.0 g/袋,相当于饮片3 g,批号412299T),广东一方制药有限公司生产;厄贝沙坦片(0.15 g/片,批号4A293),赛诺菲(杭州)制药有限公司生产。
1.3 试剂链脲佐菌素(STZ,美国Enzo Life Sciences,批号04081408);TRIzol Reagent(Life technologies公司);FastQuant cDNA第一链合成试剂盒(北京天根生化科技有限公司);Platinum SYBR Green qPCR SuperMix-UDG(美国Invitrogen公司);引物(上海生工生物工程有限公司);BCA蛋白质定量试剂盒(北京天根生化科技有限公司);兔免疫组化试剂盒(北京四正柏生物科技有限公司);兔多克隆抗体Wnt4(Gene Tex公司);兔单克隆抗体β-catenin(Abcam公司)。
1.4 仪器NanoDrop2000C紫外分光光度计(美国Thermo Scientific公司);Eco实时定量PCR仪(美国Illumina公司);BX63+DP72正置研究级显微镜(日本OLYMPUS株式会社);Odyssey红外激光扫描仪(美国LI-COR公司)。
2 方法 2.1 模型制备与分组60只大鼠适应性喂养1周,按随机数字法选10只作为对照组给予普通饲料饲养,余50只大鼠予高糖高脂饲料喂养联合小剂量STZ复制DN模型[9]。高糖高脂喂养6周后大鼠禁食不禁水12 h,按35 mg/kg一次性ip 1% STZ溶液,72 h后尾静脉采血测血糖,血糖≥16.7 mmol/L为造模成功[10]。造模过程中3只大鼠死亡,2只大鼠血糖<16.7 mmol/L,予以剔除。将45只成模大鼠随机分为模型组15只、厄贝沙坦组15只、中药组15只。
2.2 给药方法大鼠造模成功后即给予相应药物干预,根据药物成人临床使用剂量及人与大鼠体表面积法计算药物大鼠ig给药剂量[11]。中药按照人用药的配伍比例配制药物混悬液,化瘀通络中药颗粒剂混合物(颗粒中丹参、川芎、地龙、水蛭、全蝎质量比为27:26:10:30:20,剂量分别为1.41、1.12、0.94、0.56、0.56 g/kg)给药剂量为4.59 g/(kg∙d),厄贝沙坦组给药剂量为14.12 mg/(kg∙d),对照组及模型组大鼠予以相应体积的纯净水,每日1次,连续给药20周。
2.3 观察指标及测定 2.3.1 大鼠死亡情况观察实验期间大鼠的死亡情况。
2.3.2 24 h尿蛋白定量检测给药20周末,代谢笼留取各组大鼠24 h尿液,3 500 r/min,离心10 min后取上清,采用终点法检测尿蛋白浓度,乘以尿量得出24 h尿蛋白定量数据。
2.3.3 肾脏Wnt4、β-catenin mRNA的表达采用Real-time PCR法检测,TRIzol Reagent提取肾皮质总RNA,按FastQuant cDNA第一链合成试剂盒操作将RNA反转录为cDNA。采用Primer 5.0软件设计引物,序列如下:β-actin上游引物5’-ACCCGCGAGTACAACCTTCT-3’,下游引物5’-TTCAGGGTCAGGATGCCTCT-3’,引物长度266 bp;Wnt4上游引物5’-AGCCCACAGGGTTTCCA-3’,下游引物5’-GCTCGCCAGCATGTCTTT-3’,引物长度233 bp;β-catenin上游引物:5’-AACGGCTTTCGGTTGAGCTG-3’,下游引物:5’-TGGCGATATCCAAGGGCTTC-3’,引物长度147 bp。PCR反应体系为SYBR Green qPCR SuperMix 5 μL,DEPC水2 μL,上、下游引物(5 μmol/L)各1 μL,cDNA 1 μL。扩增条件为UDG孵育50 ℃,2 min;聚合酶活化95 ℃,10 min;95 ℃,10 s;60 ℃,30 s;40个循环;熔解曲线形成条件为95 ℃,15 s;55 ℃,15 s;95 ℃,15 s。每个样本设3个复孔,采用2−ΔΔCt法计算样本基因的相对表达量。
2.3.4 免疫组织化学法检测肾脏Wnt4、β-catenin蛋白的表达肾组织常规石蜡包埋、切片。采用SP法,切片脱蜡,抗原微波修复,3% H2O2清除内源性过氧化酶,山羊血清封闭,依次滴加一抗(Wnt4 1:50稀释;β-catenin 1:100稀释;4 ℃过夜),抗兔生物素化二抗、HRP标记链亲和素后,显微镜下DAB显色、复染、封片。阳性结果呈棕黄或棕褐色,显微镜下×400倍放大拍照,数据采用Image-Pro Plus version 6.0图像处理软件进行分析。每张切片取10个视野进行测量,选取视野内有染色调的区域并测量该区域的积分吸光度值(IOD),选择并测量有效染色区域的面积(area),以IOD/area来表示该蛋白的表达量。
2.3.5 Western blotting法检测肾脏Wnt4、β-catenin蛋白的表达RIPA裂解液提取肾皮质蛋白,按BCA蛋白质定量试剂盒操作测定蛋白浓度。5×上样缓冲液稀释蛋白样品,干浴器中100 ℃变性5 min,上样量Wnt4为100 μg、β-catenin为50 μg,4 ℃、100 V电泳2 h,转膜1 h后,5%脱脂奶粉封闭液中室温摇床封闭1 h,加入TBST稀释的一抗(Wnt4稀释比例1:500;β-catenin稀释比例1:1 000),4 ℃摇床孵育18 h。洗膜后避光加入稀释的荧光二抗(稀释比例1:10 000),37 ℃摇床避光孵育1 h后洗膜,用红外激光扫描仪拍照并分析荧光条带的灰度值,以目的条带与β-actin灰度值的比值来表示蛋白表达量。
2.4 统计学方法数据采用SPSS 17.0统计软件进行统计学处理,所有实验数据以x±s表示,方差齐采用单因素方差分析,两两比较采用SNK-q检验;方差不齐采用秩和检验,组间比较采用Mann-Whiteney法。
3 结果 3.1 各组大鼠死亡情况干预20周内,模型组、厄贝沙坦组大鼠分别死亡3只,中药组大鼠死亡2只,模型组、厄贝沙坦组各有1只大鼠血糖缓解,中药组2只大鼠血糖缓解,予以剔除。
3.2 各组大鼠24 h尿蛋白定量的比较如表 1所示,与对照组比较,模型组大鼠24 h尿蛋白定量明显增多(P<0.01);与模型组比较,厄贝沙坦组、中药组大鼠24 h尿蛋白定量明显减少(P<0.01);与厄贝沙坦组比较,中药组24 h尿蛋白定量明显减少(P<0.05)。
|
|
表 1 各组大鼠24 h尿蛋白定量的比较 (x±s, n=11) Table 1 Comparison on 24 h UTP of rats in each group (x±s, n=11) |
3.3 各组大鼠肾脏Wnt4、β-catenin mRNA表达量的比较
如表 2所示,与对照组比较,模型组大鼠Wnt4、β-catenin的mRNA表达均明显增多(P<0.01);与模型组比较,厄贝沙坦组、中药组大鼠Wnt4、β-catenin的mRNA表达均明显减少(P<0.01);厄贝沙坦组与中药组大鼠2种蛋白的mRNA表达差异无统计学意义(P>0.05)。
|
|
表 2 各组大鼠Wnt4、β-catenin mRNA表达的比较 (x±s, n=11) Table 2 Comparison on Wnt4 and β-catenin mRNA of rats in each group (x±s, n=11) |
3.4 各组大鼠肾脏Wnt4、β-catenin蛋白表达量的比较
免疫组化结果显示:对照组大鼠Wnt4蛋白仅微弱表达于部分肾小管上皮细胞中,β-catenin蛋白在部分肾小球、肾小管上皮细胞及远端小管有少量表达;模型组大鼠Wnt4、β-catenin蛋白在肾小球及肾小管均有表达,较对照组明显增多;厄贝沙坦组、中药组大鼠Wnt4、β-catenin蛋白表达量较模型组明显减少,且作用程度相当,结果见图 1、2。
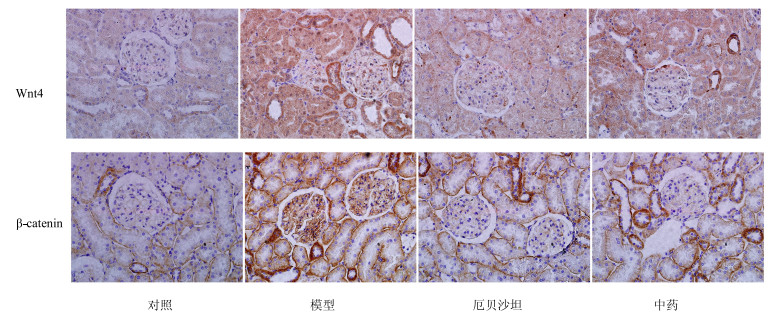
|
图 1 各组大鼠肾组织Wnt4、β-catenin蛋白表达 (免疫组化法) Fig.1 Protein expression of Wnt4 and β-catenin in renal tissue of rats in each group (immunohistochemical staining) |
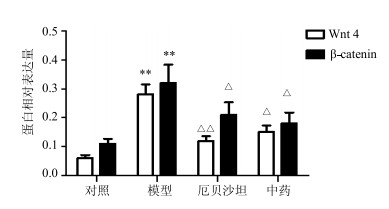
|
与对照组比较:**P<0.01,与模型组比较:△P<0.05 △△P<0.01 **P < 0.01 vs control group, △P < 0.05 △△P < 0.01 vs model group 图 2 各组大鼠肾组织Wnt4、β-catenin蛋白表达的比较 (免疫组化法, x±s, n=11) Fig.2 Comparison on Wnt4 and β-catenin protein expression in renal tissue of rats in each group (immunohistochemical staining, x±s, n=11) |
Western blotting结果显示:与对照组比较,模型组大鼠Wnt4、β-catenin蛋白的表达量均明显增多(P<0.01);与模型组比较,厄贝沙坦组、中药组大鼠Wnt4、β-catenin蛋白的表达量均明显减少(P<0.05、0.01);与厄贝沙坦组比较,中药组2种蛋白的表达量差异无统计学意义(P>0.05),见图 3和表 3。
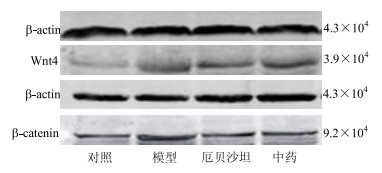
|
图 3 各组大鼠肾组织Wnt4、β-catenin蛋白表达 (Western blotting) Fig.3 Protein expression of Wnt4 and β-catenin in renal tissue of rats in each group (Western blotting) |
|
|
表 3 各组大鼠Wnt4、β-catenin蛋白表达量的比较 (Western blotting, x±s, n=11) Table 3 Comparison on Wnt4 and β-catenin protein of rats in each group (Western blotting, x±s, n=11) |
4 讨论
糖尿病其病机重在气阴两虚,气虚无力运血,血行迟滞,滞而为瘀;阴虚燥热,热灼津伤,血稠黏滞,久而致瘀;病程日久,肾络瘀阻,引起肾小球毛细血管团结构及功能受损,导致蛋白尿的漏出,由此DN期,病机重在瘀血阻络。鉴于瘀血阻络为贯穿DN全过程的主要病理改变[12-13],近年来在中医治疗DN的复方中,化瘀通络中药已成为复方的重要组成部分和必用药。在临床上将化瘀通络中药置于复方中治疗DN患者可以明显改善患者症状,减少尿蛋白排泄,保护肾功能[14]。但目前针对化瘀通络中药深入的基础研究并不多见,鉴于此本课题组开展了化瘀通络中药干预DN的系列基础研究,选取化瘀的丹参、川芎和通络的地龙、水蛭、全蝎,意在祛逐肾络瘀血、改善肾脏微循环、延缓肾脏纤维化。前期研究证实化瘀通络中药可以通过抑制DN肾脏RAS系统的激活,减少足细胞裂孔膜蛋白的丢失,维持滤过屏障的完整性,减少蛋白尿[7-8, 15]。
目前蛋白尿的发生机制尚未完全明确,而足细胞损伤在蛋白尿发生过程中的作用受到广泛关注。研究报道DN时伴随足细胞Wnt/β-catenin通路的激活、Wnt信号活化及β-catenin核易位表达的增加,该机制参与了足细胞损伤的进展及蛋白尿的发生[16-17]。在该通路中Wnt4蛋白对肾小管的形成及肾脏纤维化导致的肾小球硬化及蛋白尿具有重要意义[18]。
β-catenin作为经典Wnt信号通路的核心蛋白,参与细胞代谢的增殖、分化和凋亡过程,具有介导细胞间黏附和参与基因表达的功能[19]。动物实验证明DN时Wnt通路的激活导致下游因子β-catenin降解减少,在胞核及胞质中聚集增多,而异常升高的β-catenin可抑制nephrin的表达,诱导足细胞损伤,影响到细胞的分化、增殖、凋亡、迁移等功能[20]。体外实验表明足细胞中β-catenin的减少,可使足细胞标记蛋白如WT1和podocin表达增强,可见该通路的激活影响到足细胞滤过屏障的完整性[21]。基于此,本研究就Wnt/β-catenin通路是否参与了DN病程的进展及化瘀通络中药能否对该通络的激活产生干预作用进行探讨。
实验结果显示,模型组大鼠出现大量蛋白尿,肾脏出现明显损伤,Wnt/β-catenin通路在DN大鼠肾脏存在高表达,由此证明该通路的激活参与了DN大鼠病程的进展。通过对该通路中Wnt4、β-catenin基因及蛋白水平的检测,可见化瘀通络中药对该通路的过表达具有抑制作用。前期研究[7-8, 22-23]证实化瘀通络中药可以通过上调足细胞裂孔膜蛋白nephrin、podocin、CD2AP及电荷屏障相关蛋白的表达,对足细胞起到保护作用,能够明显减少尿蛋白的排泄。由此推测化瘀通络中药抑制Wnt/β-catenin通路高表达的作用可能是该药物保护肾脏足细胞、减少蛋白尿排泄的主要途径之一。
| [1] | Long X J, Lin S, Zhang X, et al. Correlation between podocyte excretion and proteinuria in patients with diabetic nephropathy[J]. J Med Coll PLA, 2010, 25(3): 180–186. DOI:10.1016/S1000-1948(10)60037-8 |
| [2] | Huby A C, Rastaldi M P, Caron K, et al. Restoration of podocyte structure and improvement of chronic renal disease in transgenic mice overexpressing renin[J]. PLoS One, 2009. DOI:10.1371/journal.pone.0006721 |
| [3] | Dai C, Stolz D B, Kiss L P, et al. Wnt/β-catenin signaling promotes podocyte dysfunction and albuminuria[J]. J Am Soc Nephrol, 2009, 20(9): 1997–2008. DOI:10.1681/ASN.2009010019 |
| [4] | He W, Dai C, Li Y, et al. Wnt/beta-catenin signaling promotes renal interstitial fibrosis[J]. J Am Soc Nephrol, 2009, 20(4): 765–776. DOI:10.1681/ASN.2008060566 |
| [5] | Tan R J, Zhou D, Zhou L, et al. Wnt/β-catenin signaling and kidney fibrosis[J]. Kidney Int Suppl, 2014, 4(1): 84–90. DOI:10.1038/kisup.2014.16 |
| [6] | 徐晶, 马二卫, 白璐, 等. 糖尿病肾病大鼠模型瘀血阻络证的确认[J]. 中国中西医结合肾病杂志, 2014, 15(1):12–15. |
| [7] | 曹晨, 郝世梦, 孟泽松, 等. 化瘀通络中药对糖尿病肾病代谢指标及裂孔膜蛋白nephrin的影响[J]. 中国中西医结合肾病杂志, 2016, 17(6):484–487. |
| [8] | 方敬, 陈志强, 郭倩, 等. 化瘀通络中药对糖尿病肾病大鼠肾脏足细胞裂孔膜蛋白podocin、CD2AP的调节作用[J]. 中国中西医结合杂志, 2016, 36(7):835–841. |
| [9] | Danda R S, Habiba N M, Rincon-Choles H, et al. Kidney involvement in a nongenetic rat model of type 2 diabetes[J]. Kidney Int, 2005, 68(13): 2562–2571. |
| [10] | 李志杰, 张悦. 糖尿病肾病动物模型的研究进展[J]. 生命科学, 2011, 23(1):90–95. |
| [11] | 陈奇. 中药药理研究方法学[M]. 北京: 人民卫生出版社, 2011. |
| [12] | 胡筱娟, 秦艳, 刘恬园, 等. 糖尿病肾病中医证型与肾络瘀阻相关性临床探讨[J]. 辽宁中医杂志, 2016, 43(1):91–92. |
| [13] | 卞镝, 李敬林, 董天宝. 从瘀论治糖尿病肾病[J]. 辽宁中医杂志, 2006, 33(10):1266–1267. |
| [14] | 王凤丽, 陈志强, 王月华, 等. 益气养阴消癥通络方治疗早期糖尿病肾病临床观察[J]. 中国中西医结合杂志, 2012, 32(1):35–38. |
| [15] | 徐晶, 马二卫, 白璐, 等. 化瘀通络中药对糖尿病肾病大鼠肾皮质血管紧张素转化酶2-血管紧张素 (1-7)-Mas轴的影响[J]. 中国中西医结合杂志, 2014, 34(6):714–721. |
| [16] | Naves M A, Requi o-Moura L R, Soares M F, et al. Podocyte Wnt/β-catenin pathway is activated by integrin-linked kinase in clinical and experimental focal segmental glomerulosclerosis[J]. J Nephrol, 2012, 25(3): 401–409. DOI:10.5301/jn.5000017 |
| [17] | Kawakami T, Ren S, Duffield J S. Wnt signalling in kidney diseases:dual roles in renal injury and repair[J]. J Pathol, 2013, 229(2): 221–231. DOI:10.1002/path.4121 |
| [18] | Surendran K, Mc Caul S P, Simon T C. A role for Wnt-4 in renal fibrosis[J]. Am J Physiol Renal Physiol, 2002, 282(3): 431–441. DOI:10.1152/ajprenal.0009.2001 |
| [19] | Chen J X, Yan H W, Ren D N, et al. LRP6 dimerization through its LDLR domain is required for robust canonical Wnt pathway activation[J]. Cell Signal, 2014, 26(5): 1068–1074. DOI:10.1016/j.cellsig.2013.12.020 |
| [20] | Mac Donald B T, Tamai K, He X. Wnt/beta-catenin signaling:components, mechanisms, and diseases[J]. Dev Cell, 2009, 17(1): 9–26. DOI:10.1016/j.devcel.2009.06.016 |
| [21] | Kato H, Gruenwald A, Suh J H, et al. Wnt/beta-catenin pathway in podocytes integrates cell adhesion, differentiation, and survival[J]. J Biol Chem, 2011, 286(29): 26003–26015. DOI:10.1074/jbc.M111.223164 |
| [22] | 张江华, 陈志强, 赵雯红, 等. 益气养阴消癥通络中药对早期糖尿病肾病大鼠24 h尿蛋白及nephrin、podocin基因表达的相关性分析[J]. 北京中医药大学学报, 2013, 36(10):671–675. |
| [23] | 郭倩, 张肖, 刘利飞, 等. 化瘀通络中药对糖尿病肾病大鼠肾小球电荷屏障的影响[J]. 中医杂志, 2016, 57(8):671–675. |
 2017, Vol. 48
2017, Vol. 48


