人类乳头状瘤病毒(human papilloma virus,HPV)是一种嗜上皮性病毒,在人和动物中分布广泛,有高度的特异性,长期以来,已知HPV可引起人类良性的肿瘤和疣,如生长在生殖器官附近皮肤和黏膜上的人类寻常疣、尖锐湿疣以及生长在黏膜上的乳头状瘤。
子宫颈癌是在全球妇女中发病率排在第3位的最常见的恶性肿瘤之一[1]。高危型人乳头瘤病毒(high-risk HPV,HR-HPV,通常为HPV-16和HPV-18)持续感染是子宫颈癌发展的主要危险因素[2]。HR-HPV与肿瘤的启动、发生、发展及恶性表型的全过程都密切相关,是与人类肿瘤关系最为密切的肿瘤病毒。事实上,子宫颈癌患者中有约70%的病例为HPV-16和HPV-18感染者。HR-HPV感染导致一系列分子失调为宫颈癌的发生做出贡献。但这些变化的确切机制并不完全清楚[3-5]。化疗药物在一定程度上能抑制宫颈癌细胞增殖和转移,但毒性大且容易产生肿瘤耐药性,临床疗效并不理想,且部分患者难以耐受。因此从天然植物中寻找低毒、高效的抗宫颈癌活性成分是近年来研究的热点[6]。
高良姜素(3, 5, 7-三羟基黄酮)是传统中药高良姜的主要活性成分之一,具有广泛的药理活性,包括抗病毒、抗癌、抗致畸、抗突变、抗菌及止痉作用等[7]。虽然高良姜素的抗病毒及抗肿瘤活性均有文献报道[8-9],但其作用机制并未阐明。本研究旨在明确高良姜素对HPV阳性及阴性的3株宫颈癌细胞活力、凋亡及Bcl-2家族蛋白表达的影响,以期为阐明高良姜素的抗肿瘤活性和作用机制以及临床应用前景提供理论依据。
1 材料与方法 1.1 主要材料高良姜素(质量分数≥95%,批号282200-100MG)购于Sigma公司;人宫颈癌细胞系SiHa细胞(HPV-16阳性)、HeLa细胞(HPV-18阳性)和C-33-A细胞(HPV阴性)购自美国典型培养物保藏中心(ATCC);胎牛血清购于Invitrogen公司;RPMI 1640培养液购自美国Gibco-BRL公司;噻唑蓝(MTT)试剂盒购于北京索莱宝生物科技有限公司;AnnexinV/PI细胞凋亡检测试剂盒购于Bender公司;细胞浆蛋白抽提试剂盒购于上海碧云天生物技术有限公司;半胱氨酸天冬氨酸蛋白酶(caspase)活性检测试剂盒购于上海酶联生物科技有限公司;Bcl-2、Bad、Bid、Bax、Bcl-w抗体购于美国Cell Signaling Technology公司;IgG购于武汉博士德生物工程有限公司;其他试剂(分析纯)购于北京试剂厂。
1.2 细胞培养将3种宫颈癌细胞分别培养于补充了10%胎牛血清的RPMI 1640培养基(含100 U/mL青霉素、100 μg/mL链霉素)中。所有细胞培养在含有5% CO2、37 ℃的潮湿环境中。
1.3 细胞增殖抑制实验分别取1×105/mL对数生长期的SiHa细胞、HeLa细胞及C-33-A细胞,接种于96孔板(200 μL/孔),细胞贴壁后每孔加入终质量浓度为0(对照)、20、40、80 μmol/L的高良姜素(溶解于DMSO)。各质量浓度均设5个复孔,培养48 h,测定细胞活力。选择浓度为40 μmol/L的高良姜素处理细胞,分别培养24、48、72 h,以同体积RPMI 1640培养液为对照。于实验结束前4 h加入MTT试剂20 μL/孔,继续孵育4 h,吸掉上清,加入DMSO 150 μL/孔,摇床上振荡10 min,待结晶完全溶解后酶标仪上检测570 nm处的吸光值(A)值,计算细胞活力。
细胞活力=(实验组平均A值-调零孔A值)/(对照组平均A值-调零孔A值)
1.4 流式细胞术检测细胞凋亡及细胞周期将对数生长期3种细胞以1×106/mL浓度接种于6孔培养板内,待细胞贴壁后分别加入高良姜素终质量浓度分别为0(对照)、20、40、80 μmol/L的培养液,培养48 h后,收集细胞,离心固定后加入Annexin V-FITC和PI,室温避光染色。筛网过滤后送流式细胞仪进行细胞凋亡及细胞周期的检测。
1.5 Western blotting检测蛋白表达量的变化40 μmol/L高良姜素处理48 h后收集细胞,总细胞裂解物制备裂解缓冲液(pH为7.4的Tris缓冲液50 mmol/L,150 mmol/L氯化钠、5 mmol/L的EDTA、1%体积比的Triton X-100、1%质量体积比的脱氧胆酸钠、30 mmol/L磷酸氢二钠、50 mmol/L的氟化钠和1 mmol/L钒酸钠)含有新加入的蛋白酶抑制剂混合物(GenDEPOT,美国)。提取物(30 mg)混合于SDS样品缓冲液,煮沸5 min,8%或10%(质量体积比)SDS-PAGE分离,并转移至硝酸纤维素膜(Millipore)上。室温下封闭1 h,分别加入1:1 000稀释的兔抗人Bcl-2、Bax、Bad、Bid、Bcl-w蛋白,4 ℃过夜。以GAPDH作为内参,TBST洗膜3次,加入1:1 000稀释的辣根酶标记的兔抗山羊IgG,室温孵育2 h,同样洗膜3次,ECL发光液显色,观察各条带深浅变化。
1.6 统计学处理采用SPSS 19.0统计学软件进行数据分析,计量资料数据用x±s表示,两组间比较采用t检验;多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。
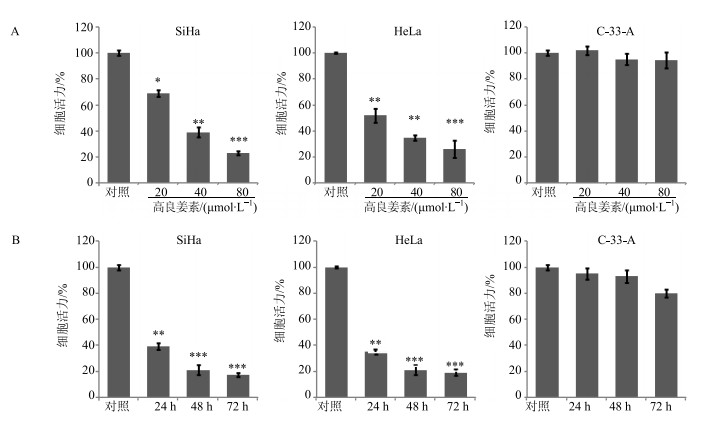
2 结果 2.1 高良姜素对宫颈癌细胞活力的影响如图 1所示,20、40、80 μmol/L高良姜素处理48 h,均可显著抑制HPV阳性宫颈癌细胞株SiHa细胞和HeLa细胞的活力,且随着高良姜素浓度的升高和处理时间的延长,抑制细胞活力的作用也逐渐增强,呈浓度和时间依赖效应。但高良姜素在同样浓度及同样时间内对HPV阴性宫颈癌细胞株C-33-A细胞活力没有显著影响。
|
与对照组比较:*P<0.05 **P<0.01 ***P<0.001 *P < 0.05 **P < 0.01 ***P < 0.001 vscontrol group 图 1 不同浓度高良姜素处理48 h (A) 及40 μmol∙L−1高良姜素处理24、48、72 h (B) 对SiHa、HeLa、C-33-A细胞活力的影响 (x±s, n=5) Fig.1 Effects of galangin with different concentration treated for 48 h (A) and 40 μmol∙L−1 galangin treated for 24, 48, and 72 h (B) on cell viability of SiHa, HeLa, and C-33-A cells (x±s, n=5) |
2.2 高良姜素对宫颈癌细胞凋亡的影响
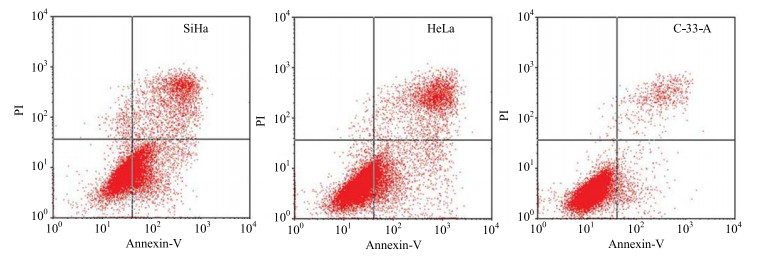
流式细胞仪检测结果显示,高良姜素能诱导HPV阳性宫颈癌细胞凋亡,而对HPV阴性宫颈癌细胞几乎没有诱导凋亡作用。40 μmol/L高良姜素分别处理SiHa、HeLa、C-33-A细胞48 h后,细胞凋亡率分别为41.5%、47.4%、3.96%,见图 2,不同浓度高良姜素处理3种细胞48 h的凋亡率见表 1。
|
图 2 40 μmol∙L−1高良姜素诱导宫颈癌细胞凋亡情况 Fig.2 Inductive effect of 40 μmol∙L−1 galangin on apoptosis of human cervical cancer cells |
|
|
表 1 高良姜素对SiHa、HeLa、C-33-A细胞凋亡的影响 (x±s, n=6) Table 1 Effects of galangin on apoptosis of SiHa, HeLa, and C-33-A cells (x±s, n=6) |
2.3 高良姜素对HPV阳性宫颈癌细胞周期的影响
高良姜素对HPV阴性宫颈癌细胞C-33-A凋亡未见显著影响,因此考察不同浓度高良姜素处理HPV阳性宫颈癌细胞SiHa和HeLa细胞48 h后细胞周期分布情况,结果表明,2种HPV阳性的宫颈癌细胞G0/G1期细胞比例增加,同时G2/M期与S期细胞比例减少。80 μmol/L高良姜素处理后,SiHa细胞G0/G1期细胞比例为75.94%,而G2/M期与S期细胞比例分别为3.77%、22.46%;HeLa细胞G0/G1期细胞比例增加至73.65%,而G2/M期与S期细胞比例分别降低为5.56%、20.76%。结果见表 2。提示高良姜素能使HPV阳性的宫颈癌细胞周期阻滞在G0/G1期,从而抑制细胞增殖。
|
|
表 2 高良姜素对HPV阳性宫颈癌细胞周期分布的影响 (x±s, n=3) Table 2 Effects of galangin on cell cycle of human cervical cancer cells with HPV positive (x±s, n=3) |
2.4 高良姜素对HPV阳性宫颈癌细胞Bcl-2家族蛋白表达的影响
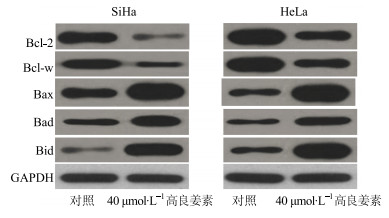
Western blotting法检测40 μmol/L高良姜素处理48 h后,2种HPV阳性宫颈癌细胞中凋亡相关蛋白表达的影响,结果显示高良姜素作用后,2种HPV阳性宫颈癌细胞中的促凋亡蛋白Bax、Bad、Bid的表达量均升高,而抗凋亡蛋白Bcl-2、Bcl-w的表达量均降低。见图 3。
|
图 3 高良姜素对HPV阳性宫颈癌细胞中Bcl-2家族蛋白表达量的影响 (x±s, n=3) Fig.3 Effects of galangin on intracellular expression levels of Bcl-2 family proteins in HPV positive human cervical cancer cells (x±s, n=3) |
3 讨论
妇女宫颈癌的发病率和死亡率远较其他HPV相关恶性肿瘤高。HPV人群感染率的研究显示,性活跃期妇女HPV感染率最高,约占50%~80%,其中50%为HR-HPV感染。HPV感染无明显临床症状,而且超过半数的HPV感染可在感染后的数月至2年内被免疫系统清除,平均清除时间根据低危型HPV、HR-HPV或HPV的持续感染而不同。如果在间隔1年以上的时间连续2次检测出同一高危型的HPV,被认为是持续性感染。只有慢性持续性HR-HPV感染,才能最终演变为宫颈癌。
虽然自20世纪90年代初国内外学者就对抗HPV疫苗进行了研究,并且全球首支HPV疫苗已于2006年在美国上市,但是中国还没有HPV疫苗。目前上市的宫颈癌预防疫苗仅涵盖HPV-16及HPV-18两种高危型,而且只对HPV-16及HPV-18感染阴性的人群有预防相应型别HPV感染相关的肿瘤的作用,所以接种宫颈癌疫苗不能完全代替宫颈癌筛查,目前宫颈癌筛查仍是预防宫颈癌的有效手段。而由于肿瘤免疫治疗的复杂性,目前在全球范围内尚无有效的HPV治疗性疫苗问世[10]。因此关于HPV感染的宫颈癌的诊断及治疗的研究是当今世界非常重要的课题。
中医药,包括民族医药是祖国医学用来防治疾病的有力武器,与化学化合物相比,中药除了有着取材方便、价格低廉和毒副作用低等优点外,更重要的是,在减轻临床症状,提高生存质量,防止复发转移,延长生存期,提高免疫力,预防肿瘤,增强放、化疗敏感性,减轻放、化疗不良反应等很多方面都具有优势。近年来中药及其有效部位或成分抗癌研究工作取得了一系列的成果,已成为肿瘤医学的研究热点之一[11]。高良姜素是一个具有抗病毒及抗癌活性的天然产物[12],本研究表明高良姜素可以显著降低HPV阳性宫颈癌细胞的活力,而对HPV阴性的宫颈癌细胞活力没有明显影响。这说明可能高良姜素对肿瘤细胞的作用可能与其抗病毒活性有关。
细胞凋亡是多细胞机体维持内环境稳定的重要自我调节机制,诱导细胞凋亡已成为肿瘤治疗的热点,亦成为评估抗癌药物作用能力的重要指标[13-14]。本研究发现高良姜素在20~80 μmol/L均能抑制HPV阳性的人宫颈癌细胞的增殖,且呈现明显的剂量依赖及时间依赖效应:高良姜素处理HPV阳性的宫颈癌细胞48 h后可诱导凋亡,且随着药物浓度的升高细胞凋亡率增加。
此外,本研究发现经过高良姜素处理后,宫颈癌细胞抗凋亡蛋白Bcl-2表达下调,促凋亡蛋白Bax表达上调。Bcl-2蛋白家族是一个特别的家族,成员中有些促进凋亡,如Bad、Bid、Bax,有些成员阻止细胞凋亡,如Bcl-2、Bcl-w。Bcl-2能够阻止细胞色素C从线粒体释放到细胞质,从而抑制了细胞凋亡。Bcl-2是一种内膜蛋白,主要存在于线粒体、内质网和核膜上,Bcl-2在多种肿瘤细胞中表达,能通过增强线粒体膜电位,抑制钙离子释放,阻止核酸内切酶活化,进而发挥抗凋亡作用;Bax的作用与Bcl-2相反,可直接激活死亡效应因子caspase或改变细胞膜通透性引起细胞色素C释放某些离子和小分子通过细胞膜,进而促进细胞凋亡。细胞Bcl-2和Bax比例改变可调节细胞凋亡,当Bcl-2占优势时,细胞具有抗凋亡作用;相反,当Bax过表达时,细胞易发生凋亡[15]。由于高良姜素对肿瘤细胞的作用并非针对单一靶点,具有广泛的生物学作用,因此对高良姜素诱导宫颈癌细胞凋亡机制的进一步研究以及阻滞细胞传导通路、信使的相关研究,将对其临床应用具有良好的指导意义。
综上所述,高良姜素可抑制宫颈癌细胞增殖并诱导细胞凋亡,其诱导细胞凋亡机制可能是通过上调Bad、Bid、Bax蛋白表达并下调Bcl-2、Bcl-w蛋白表达。本研究为宫颈癌治疗所需的新的化疗试剂或其类似物的发现提供了参考。
| [1] | Comparetto C, Borruto F. Cervical cancer screening:A never-ending developing program[J]. World J Clin Cases, 2015, 3(7): 614–624. |
| [2] | Rusan M, Li Y Y, Hammerman P S. Genomic landscape of human papillomavirus-associated cancers[J]. Clin Cancer Res, 2015, 21(9): 2009–2019. DOI:10.1158/1078-0432.CCR-14-1101 |
| [3] | Huang Q T, Zhong M, Gao Y F, et al. Can HPV vaccine have other health benefits more than cancer prevention? A systematic review of association between cervical HPV infection and preterm birth[J]. J Clin Virol, 2014, 61(3): 321–328. DOI:10.1016/j.jcv.2014.09.002 |
| [4] | Arbyn M, Tommasino M, Depuydt C, et al. Are 20 human papillomavirus types causing cervical cancer[J]. J Pathol, 2014, 234(4): 431–435. DOI:10.1002/path.2014.234.issue-4 |
| [5] | Yin D, Jiang Y, Wang N, et al. The diagnostic value of serum hybrid capture 2(CH2) HPV DNA in cervical cancer:a systematic review and meta-analysis[J]. Tumour Biol, 2014, 35(9): 9247–9253. DOI:10.1007/s13277-014-2214-4 |
| [6] | Mamgain S, Sharma P, Pathak R K, et al. Computer aided screening of natural compounds targeting the E6 protein of HPV using molecular docking[J]. Bioinformation, 2015, 11(5): 236–242. DOI:10.6026/bioinformation |
| [7] | Huang H, Chen A Y, Rojanasakul Y, et al. Dietary compounds galangin and myricetin suppress ovarian cancer cell angiogenesis[J]. J Funct Foods, 2015, 15: 464–475. DOI:10.1016/j.jff.2015.03.051 |
| [8] | Wang Y, Wu J, Lin B, et al. Galangin suppresses HepG2 cell proliferation by activating the TGF-β receptor/Smad pathway[J]. Toxicology, 2014, 326(1): 9–17. |
| [9] | Meyer J J, Afolayan A J, Taylor M B, et al. Antiviral activity of galangin isolated from the aerial parts of Helichrysum aureonitens[J]. J Ethnopharmacol, 1997, 56(2): 165–169. DOI:10.1016/S0378-8741(97)01514-6 |
| [10] | Emberger J. The HPV vaccine:Overcoming barriers to acceptance of a medical triumph[J]. AMA J Ethics, 2015, 17(9): 854–857. DOI:10.1001/journalofethics.2015.17.9.msoc1-1509 |
| [11] | Wang S M, Qiao Y L. Implementation of cervical cancer screening and prevention in China--challenges and reality[J]. Jpn J Clin Oncol, 2015, 45(1): 7–11. DOI:10.1093/jjco/hyu188 |
| [12] | 许奕夫, 姚鑫. 高良姜素抑制乳腺癌转移作用机制研究[J]. 中草药, 2016, 47(10):1731–1739. |
| [13] | Koff J L, Ramachandiran S, Bernal-Mizrachi L. A Time to kill:Targeting apoptosis in cancer[J]. Int J Mol Sci, 2015, 16(2): 2942–2955. DOI:10.3390/ijms16022942 |
| [14] | Renault T T, Chipuk J E. Death upon a kiss:mitochondrial outer membrane composition and organelle communication govern sensitivity to BAK/BAX-dependent apoptosis[J]. Chem Biol, 2014, 21(1): 114–123. DOI:10.1016/j.chembiol.2013.10.009 |
| [15] | Chen H C, Kanai M, Inoue-Yamauchi A, et al. An interconnected hierarchical model of cell death regulation by the BCL-2 family[J]. Nat Cell Biol, 2015, 17(10): 1270–1281. |
 2017, Vol. 48
2017, Vol. 48

