2. 湖南中医药大学第一附属医院, 湖南 长沙 410007;
3. 湖南中医药大学药学院, 湖南 长沙 410208;
4. 湖南中医药大学中西医结合学院, 湖南 长沙 410208
2. The First Affiliate Hospital, Hunan University of Chinese Medicine, Changsha 410007, China;
3. College of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China;
4. College of Intergrated Chinese and Western Medicine, Hunan University of Chinese Medicine, Changsha 410208, China
肝癌的中医基本病机标实为“血瘀、毒结”,据此在临床可采用攻补兼施,攻以峻猛攻毒散结的方法。虫类中药的抗肿瘤作用一直颇受关注[1],其中蜈蚣作为一种重要的虫类药物,其攻毒散结的功效可应用于临床治疗肝癌的中药复方配伍中[2-4]。前期实验研究中也发现,蜈蚣提取物具有良好的体内外抗肿瘤活性[5]。肝癌的转移复发是导致临床低生存率的重要原因,近年来发现信号传导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)通路在细胞的肿瘤侵袭转移过程中具有重要的意义,已证实肝癌的成瘤前和新生瘤的增殖过程中STAT3通路起着决定性作用[6-7]。为了进一步深入研究蜈蚣提取物的抗肝癌机制,本实验观察蜈蚣提取物作用于肝癌HepG2细胞后对STAT3信号通路与磷酸化相关蛋白表达以及细胞转移侵袭能力的影响,探讨蜈蚣提取物介导STAT3信号通路抗肝癌侵袭转移的调控作用机制。
1 材料 1.1 细胞株采用人肝癌HepG2细胞株,购自湘雅医学院细胞中心。用含10%胎牛血清的高糖DMEM完全培养基,置37 ℃、5% CO2饱和湿度的恒温孵育箱中培养。
1.2 主要试剂及仪器高糖DMEM培养基(美国Gibco公司);胎牛血清、胰蛋白酶(美国Invitrogen公司);二甲基亚砜(美国Amresco公司);CCK8试剂盒(中国上海七海复泰生物科技有限公司);STAT3小鼠抗人单克隆抗体、p-STAT3小鼠抗人单克隆抗体、金属基质蛋白酶-2(MMP-2)小鼠抗人单克隆抗体、血管内皮生长因子(VEGF)小鼠抗人单克隆抗体、HRP标记山羊抗小鼠IgG抗体(美国Santa Cruz公司产品);ECL增强发光试剂盒(美国Amersham公司);细胞总蛋白抽提试剂盒(中国碧云天生物公司)。CO2培养箱(美国Thermo公司);DU640核酸及蛋白分析仪、高速低温离心机(美国Beckman公司);倒置显微镜(日本Olympus公司);Elx808型酶标仪、蛋白电泳仪与转移仪(美国Bio-rad公司)。
1.3 药材与药品蜈蚣为蜈蚣科动物少棘巨蜈蚣Scolopendra subspinipes mutilans L. Koch的干燥体,本实验所用蜈蚣超微粉末一次性购于湖南中医药大学第一附属医院药剂科,并经湖南中医药研究院中药研究所彭艳梅研究员鉴定。5-FU,上海源叶生物科技有限公司,批号S17073。
2 方法 2.1 蜈蚣提取物的制备及分离纯化按照前期建立的方法[5]进行提取分离。具体方法:蜈蚣超微粉末2 g,55 ℃蛋白酶酶解后,99 ℃水浴中灭活10 min,4 ℃、5 000 r/min离心10 min,取上清液,2倍体积预冷丙酮沉淀,4 ℃、5 000 r/min离心10 min,取沉淀,超纯水充分溶解沉淀,重复2次。收集最后沉淀,超纯水溶解,加入2倍体积预冷丙酮,取沉淀,30 ℃真空干燥成粉末99.6 mg,提取率是4.89%,−20 ℃冻存备用。蜈蚣提取物中主要成分为蛋白,质量分数为80.1%。
2.2 细胞增殖检测CCK8法检测蜈蚣提取物对HepG2细胞的增殖抑制作用。选取对数生长期HepG2细胞制成单细胞悬液,调整浓度为1×105个/mL接种于96孔培养板,每孔100 μL细胞悬液,待细胞贴壁后分别加入不同质量浓度(300、600、1 200、2 400 μg/mL)的蜈蚣提取物,每孔100 μL,同时设对照组和空白组(调零孔),均设5个复孔。其中对照组接种细胞加入完全培养基,空白组只加入完全培养基。分别于培养24、48、72 h时加入CCK8 20 μL,孵育30 min后,酶标仪450 nm测定吸光度(A)值。计算细胞增殖抑制率,采用直线回归方程计算半数抑制浓度(IC50)。
增殖抑制率=1-A药物组/A对照组
2.3 细胞侵袭能力检测采用Transwell小室检测蜈蚣提取物对HepG2细胞的侵袭能力的抑制作用,根据细胞侵袭测定试剂盒操作说明进行。将基质胶按照40 μL/孔均匀铺在8 μm孔径Transwell小室滤膜上,置小室于24孔板内。选取对数生长期HepG2细胞制成单细胞悬液,调整浓度为2.5×105个/mL,取0.2 mL接种于成胶的Transwell小室上室,同时下室加0.5 mL完全培养基。蜈蚣提取物设置2组,处理质量浓度分别为250、500 μg/mL,同时设置对照组与阳性对照组(5-FU组,质量浓度为10 μg/mL)。培养48 h时取出Transwell小室,用棉签擦去滤膜上面未穿膜细胞,滤膜下室面细胞用甲醇固定,常规HE染色。200×高倍镜下任取4个不重叠视野观察计算穿膜细胞数目。
2.4 细胞蛋白表达检测采用Western blotting方法检测蜈蚣提取物处理后HepG2细胞STAT3信号通路相关蛋白表达变化。选取对数生长期HepG2细胞制成单细胞悬液,调整浓度为2×106个/mL,接种于6孔培养板,每孔500 μL细胞悬液,待细胞贴壁后分别加入250、500 μg/mL的蜈蚣提取物,每孔500 μL,同时设置对照组与5-FU组(10 μg/mL)。处理48 h时收集细胞,以冰冷的PBS缓冲液洗涤细胞,加入细胞裂解液lysis buffer(含2.5%磷酸酶抑制剂混合物,1% NP-40)后刮取细胞,置冰上30 min完全裂解,以500 W功率超声处理后,4 ℃条件下14 000 r/min离心5 min,取上清即为样品总蛋白。样品总蛋白质量浓度采用BCA法检测。Western blotting法检测STAT3、p-STAT3、MMP-2、VEGF的蛋白表达水平,一抗稀释浓度为1:500,二抗稀释浓度为1:1 000。洗膜后用ECL发光试剂盒检测杂交信号,Bio-Rad凝胶成像系统采集图片,结果采用Quantity One软件进行灰度值分析,实验重复3次。
2.5 统计学方法数据使用SPSS 19.0统计软件分析。计量资料以x±s表示,经方差齐性检验后,采用单因素方差分析,组间比较采用SNK法。
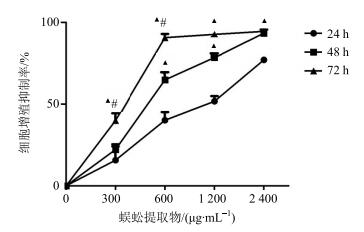
3 结果 3.1 对HepG2细胞增殖的抑制作用CCK8法检测结果显示,蜈蚣提取物对HepG2细胞增殖有明显抑制作用(P<0.05),呈剂量依赖性,见图 1。与24、72 h比较,处理48 h时蜈蚣提取物的增殖抑制作用随质量浓度增加快速增强,并且不出现平台期。因此选择48 h作为后续实验的处理时间。经计算IC50(48 h)值为508.3 μg/mL,在后续实验中,确定蜈蚣提取物处理HepG2细胞的质量浓度分别为250 μg/mL(相当于作用48 h的1/2 IC50值)和500 μg/mL IC50(相当于作用48 h的IC50值),检测对细胞侵袭能力及蛋白表达的影响。
|
与24 h比较:▲P<0.05;与48 h比较:#P<0.05 ▲P < 0.05 vs 24 h; #P < 0.05 vs 48 h 图 1 蜈蚣提取物对HepG2细胞增殖的抑制作用 (x±s, n=5) Fig.1 Inhibition of SSE on proliferation of HepG2 cells (x±s±s, n=5) |
3.2 对HepG2细胞侵袭能力的影响
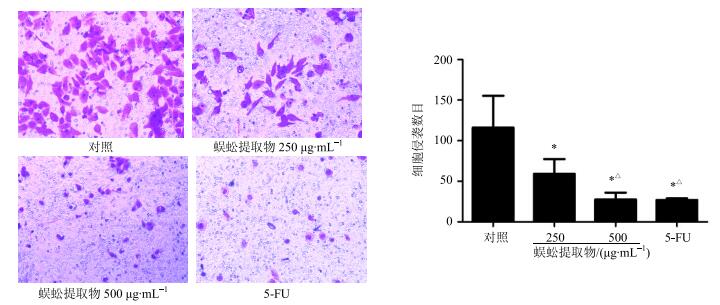
Transwell细胞侵袭实验结果显示,对照组透膜细胞数为(116.0±39.3)个/视野。经蜈蚣提取物处理48 h时,人肝癌HepG2细胞的侵袭能力明显降低,250、500 μg/mL蜈蚣提取物组的透膜细胞数分别为(59.25±18.2)、(27.5±8.6)个/视野。5-FU组(10 μg/mL)透膜细胞数为(28.7±2.5)个/视野。与对照组比较,蜈蚣提取物及5-FU组均能使细胞穿过Matrigel基质胶的数目减少,侵袭能力明显降低(P<0.05)。与蜈蚣提取物250 μg/mL组比较,蜈蚣提取物500 μg/mL组、5-FU组透膜细胞数更少,差异有统计学意义(P<0.05)。见图 2。
|
与对照组比较:*P<0.05;与250 μg∙mL−1蜈蚣提取物组比较:△P<0.05 *P < 0.05 vs control group; △P < 0.05 vs 250 μg∙mL−1SSE group 图 2 蜈蚣提取物对HepG2细胞侵袭能力的影响 (x±s±s, n=5) Fig.2 Effect of SSE on invasion ability of HepG2 cells (x±s, n=5) |
3.3 对HepG2细胞STAT3、p-STAT3、MMP-2、VEGF蛋白表达的影响
Western blotting方法检测STAT3信号通路相关蛋白的表达结果显示,经蜈蚣提取物处理HepG2细胞48 h时,STAT3蛋白表达虽然呈下降趋势,但与对照组比较差异无统计学意义(P>0.05);与对照组比较,250、500 μg/mL蜈蚣提取物与5-FU组的p-STAT3表达均降低,差异显著(P<0.05、0.01),500 μg/mL蜈蚣提取物组降低作用要优于250 μg/mL蜈蚣提取物组,两组间比较差异显著(P<0.05);与对照组比较,500 μg/mL蜈蚣提取物组、5-FU组的MMP-2、VEGF蛋白的表达显著降低(P<0.05),且降低MMP-2的作用优于250 μg/mL蜈蚣提取物组(P<0.05)。见图 3和表 1。

|
图 3 各组HepG2细胞STAT3、p-STAT3、MMP-2、VEGF蛋白表达 Fig.3 Protein expression of STAT3, p-STAT3, MMP-2, and VEGF in HepG2 cells |
|
|
表 1 蜈蚣提取物对HepG2细胞STAT3、p-STAT3、MMP-2、VEGF蛋白表达的影响 (x±s±s, n=5) Table 1 Effect of SSE on STAT3, p-STAT3, MMP-2, and VEGF protein expression in HepG2 cells (x±s±s, n=5) |
4 讨论
肝癌的发生、发展是一个多基因、多步骤的复杂过程,STAT3的信号转导通路在肝癌发生、发展的分子生物学基础上起着重要作用。STAT3的信号转导通路与肿瘤细胞的增殖、凋亡、免疫抑制、转移以及肿瘤血管生成等过程密切相关[8-9]。通过使用Janus激酶抑制剂AG490可阻断人肝癌SMMC-7721细胞JAK2/STAT3信号通路,从而抑制肝癌细胞的生长和侵袭[10]。近年来的众多研究发现,中药单体成分、提取物或中药复方可通过干预STAT3信号通路发挥抗肿瘤作用[11-13]。
STAT3的过度活化与多种恶性肿瘤的血管生成、侵袭、转移等密切相关,在发病分子机制中处于核心位置[14-17]。在侵袭转移过程中,常常伴随具有屏障作用的细胞外基质(extracellular matrix,ECM)异常降解[18]。基质金属蛋白酶(matrix metalloproteinase,MMP)在ECM的重塑和降解中扮演着重要角色,研究表明肝癌存在高表达的MMP-2[10]。VEGF作为最重要的促血管生成因子能够刺激血管内皮细胞的增殖促进血管通透性,对血管生成在肿瘤的生长、转移和浸润中发挥重要的作用。由于VEGF、MMP-2启动子区都存在活化的STAT3高亲和结合位点,因此转录表达可作为靶基因直接受到STAT3调控[19-20]。本研究结果显示,肝癌细胞存在STAT3的过度活化,出现p-STAT3的高表达,从而调控MMP-2、VEGF的表达增高,促进肝癌细胞的增殖生长。蜈蚣提取物对肝癌细胞STAT3相关信号通路的调控主要通过抑制STAT3的磷酸化过程来实现,Western blotting结果显示蜈蚣提取物主要降低p-STAT3蛋白表达,而STAT3蛋白表达降低不明显,表明蜈蚣提取物能阻断STAT3蛋白的活化过程。进一步的实验结果显示STAT3的下游调控靶蛋白VEGF、MMP-2的表达水平在蜈蚣提取物达到500 μg/mL剂量水平时显著降低,与5-FU作用无明显差别,VEGF、MMP-2表达水平下降,可降低肝癌细胞的增殖、侵袭及转移能力。
综上所述,本实验证实蜈蚣提取物能够体外抑制肝癌HepG2细胞的增殖生长,明显降低肝癌细胞的侵袭能力。研究结果提示高质量浓度蜈蚣提取物可通过抑制STAT3蛋白的磷酸化从而降低下游靶蛋白MMP-2、VEGF的表达,从而抑制肝癌细胞的生长增殖及转移侵袭。阻断STAT3信号通路的活化是蜈蚣提取物发挥肝癌作用的重要作用机制之一。
| [1] | 赵嵌嵌, 张维东, 武利存, 等. 蝎毒多肽提取物联合雷帕霉素抑制H22肝癌肿瘤血管生成的作用机制研究[J]. 中草药, 2015, 46(9):1343–1347. |
| [2] | Wang T, Liu J, Xiao X Q. Cantharidin inhibits angiogenesis by suppressing VEGF-induced JAK1/STAT3, ERK and AKT signaling pathways[J]. Arch Pharm Res, 2014, 38(2): 282–289. |
| [3] | 刘展华. 周岱翰教授治疗原发性肝癌验案2则[J]. 中医药信息, 2015, 32(5):35–37. |
| [4] | 韩莉, 周永芹, 韩钰. 蜈蚣提取物诱导宫颈癌HeLa细胞凋亡及其机制的研究[J]. 时珍国医国药, 2007, 18(9):2109–2111. |
| [5] | 陈园, 艾小佳, 王志琪, 等. 蜈蚣提取物抗肺癌活性的体内外实验研究[J]. 中国中医药信息杂志, 2016, 23(5):61–63. |
| [6] | Subramaniam A, Shanmugam M K, Perumall E, et al. Potential role of signal transducer and activator of transcription (STAT) signaling pathway in inflammation, survival, proliferation and invasion of hepatocellular carcinoma[J]. Biochim Biophys Acta, 2013, 1835(1): 46–60. |
| [7] | Lee Y H, Yun Y. HBx protein of hepatitis B virus activates Jak1-STAT signaling[J]. J Biol Chem, 1998, 273(39): 25510–25515. DOI:10.1074/jbc.273.39.25510 |
| [8] | Yeh C M, Chang L Y, Lin S H, et al. Epigenetic silencing of the NR4A3 tumor suppressor, by aberrant JAK/STAT signaling, predicts prognosis in gastric cancer[J]. Scientific Rep, 2016, 8(6): 31690. |
| [9] | Hosford S R, Miller T W. Clinical potential of novel therapeutic targets in breast cancer:CDK4/6, Src, JAK/STAT, PARP, HDAC, and PI3K/AKT/mTOR pathways[J]. Pharmacog Personal Med, 2014, 7: 203–215. |
| [10] | 刘波, 王洪林, 宋立, 等. Janus激酶抑制剂AG490对人肝癌SMMC-7721细胞侵袭转移的影响[J]. 第三军医大学学报, 2011, 33(18):1960–1963. |
| [11] | Yallapu M M, Khan S, Maher D M, et al. Anti-cancer activity of curcumin loaded nanoparticles inprostate cancer[J]. Biomaterials, 2014, 35(30): 8635–8648. DOI:10.1016/j.biomaterials.2014.06.040 |
| [12] | 刘鹏, 王勤.以STAT3信号通路为靶点探索半枝莲提取物的抗癌分子机制[D].兰州:兰州大学, 2014. |
| [13] | 沈迪, 李崇慧, 周晋华, 等. 复方守宫散对Lewis肺癌小鼠JAK2-STAT3信号通路的影响[J]. 中国医药科学, 2014, 4(9):17–21. |
| [14] | Timme S, Ihde S, Fichter C D, et al. STAT3 expression, activity and functional consequences of STAT3 inhibition in esophageal squamous cell carcinomas and Barrett's adenocarcinomas[J]. Oncogene, 2014, 33(25): 3256–3266. DOI:10.1038/onc.2013.298 |
| [15] | Judd L M, Menheniott T R, Ling H, et al. inhibition of the JAK2/STAT3 pathway reduces gastric cancer growth In vitro and in vivo[J]. PLoS One, 2014, 9(5): e95993. DOI:10.1371/journal.pone.0095993 |
| [16] | Cai S Q, Zheng M, Chen L R. Overexpression of phosphorylated-STAT3correlated with the invasion and metastasis of cutaneous squamous cell carcinoma[J]. J Dermatol, 2005, 32(5): 354–360. DOI:10.1111/jde.2005.32.issue-5 |
| [17] | Zhang C H, Xu G L, Jia W D, et al. Activation of STAT3 signal path-way correlates with twist and E-Cadherin expression in hepatocellular carcinoma and their clinical significance[J]. J Surges, 2010, 166(1): 236–246. |
| [18] | Theruvath T P, Jones J A, Ikonomidis J S. Matrix metatloproteinasesand descending aortic aneurysms:parity, disparity, and switch[J]. J Card Surg, 2011, 191(2): 133–140. |
| [19] | Tekte C, Nygren M K, Chen Y W, et al. B7-H3 contributes to the meta-static capacity of melanoma cells by modulation of known metastasis-associated genes[J]. Int J Cancer, 2011, 128(1): 216–226. DOI:10.1002/ijc.v128:1 |
| [20] | Jablonska J, Leschner S, Westphal K, et al. Neutrophils responsive toendogenous IFN-beta regulate tumor angiogenesis and growth in amouse tumor model[J]. J Clin Invest, 2010, 120(4): 1151–1164. DOI:10.1172/JCI37223 |
 2017, Vol. 48
2017, Vol. 48


