2. 云南省三七资源可持续利用重点实验室, 云南 昆明 650500;
3. 国家中医药管理局三七资源可持续发展利用研究室, 云南 昆明 650500;
4. 昆明市道地药材可持续发展利用重点实验室, 云南 昆明 650500;
5. 云南白药集团中药资源有限公司, 云南 昆明 650502
2. Yunnan Provincial Key Laboratory of Panax notoginseng, Kunming 650500, China;
3. Key Laboratory of Panax notoginseng Resources Sustainable Development and Utilization of State Administration of Traditional Chinese Medicine, Kunming 650500, China;
4. Kunming Key Laboratory of Sustainable Development and Utilization of Famous-Region Drug, Kunming 650500, China;
5. Yunnan Baiyao Group Chinese Medicinal Resources Co., Ltd., Kunming 650502, China
天然多糖由于具有良好的物理性能和生物可降解性,在药物递送系统(drug delivery system,DDS)和组织修复工程中具有广阔的应用前景[1],并受到高度重视。白及多糖(Bletilla striata polysaccharides,BSP)为兰科植物白及Bletilla striata (Thunb.) Reichb. f.的主要活性成分,具有促进伤口愈合[2-3]、抗老化[4]和抗菌[5]等活性。其相对分子质量大小为1.35×105[6],由α-甘露糖、β-甘露糖和β-葡萄糖组合而成,其中,甘露糖与葡萄糖的物质的量之比约为2.4:1。BSP可作为一种理想的止血敷料基质。王爱民等[7]以维生素K1为参照,建立了白及药材的止血生物效价;王玮[8]和王巍等[9]分别制备了白及止血粉和白及止血海绵,并进行了止血活性的评价。本研究以BSP为原料,成功制备了一种具有皮肤促渗活性和止血活性的水凝胶[10-11]基质。该水凝胶流变学特性良好,兼具经皮促渗和止血的生理活性,在医用敷料和经皮药物传递系统中具有潜在的应用价值。
1 仪器与试剂DFY-500粉碎机,中国上海大德仪器有限公司;DEAE-cellulose(3 cm×45 cm),英国美特斯通公司;UV-2600分光光度计,日本岛津公司;Sephadex G-200(1.4 cm×75 cm),美国Pharmacia公司;TENSOR 27傅里叶变换红外光谱(FTIR)仪,德国卡尔斯鲁厄Bruker公司;DTG-60热重分析仪,日本岛津公司;DMAX-2250衍射仪,日本东京日本理学公司;MCR501流变仪,奥地利AntonPaar公司;Vapor meter经皮水分散失速率测定仪,芬兰Delfin公司;XN06-IV半自动血浆凝血分析仪,武汉景川诊断技术股份有限公司。
白及药材购于中国云南省昆明市菊花村药材市场,经昆明理工大学杨野副教授鉴定为兰科白及属植物白及Bletilla striata (Thunb.) Reichb. f.的块茎;卡波姆940,美国克利夫兰Noveon化学工业公司;水为超纯水;其他试剂均为市售分析纯。
2 方法与结果 2.1 提取与提纯 2.1.1 BSP的提取将干燥后的白及块茎粉碎,取白及粉末100 g和4 000 mL蒸馏水加入至5 000 mL烧杯中,80 ℃水浴3.5 h。提取液3 000 r/min离心2 min,加热至60 ℃,放入5 g/L活性炭脱色1.5 h并滤过。滤液浓缩至700 mL成稠状液体,冷却,将一定体积的95%乙醇缓慢加入到溶液中,以达到70%的体积分数。完全沉淀呈絮状多糖后,将混合物3 000 r/min离心20 min,收集沉淀物并45 ℃真空干燥72 h。最后,获得约16 g粗BSP产物[12-13]。
2.1.2 BSP的提纯使用酶解和Sevag反应除去蛋白质。取粗BSP溶解在水中,加入5 g/L木瓜蛋白酶40 ℃酶解3 h。以Sevag法除去多糖中的蛋白质,以透析膜(截留相对分子质量3 500)透析除去小分子并以紫外分光光度仪进行检测(400~200 nm)。使用DEAE-cellulose(3 cm×45 cm)柱和Sephadex G-200(1.4 cm×75 cm)柱色谱,最后真空干燥得到BSP纯化产物[13-14]。
2.2 BSP的表征 2.2.1 红外光谱用FTIR光谱仪进行BSP的红外表征。测试条件:干燥的样品2 mg,KBr压片,在500~4 000 cm−1进行FTIR光谱扫描,记录红外图谱,见图 1。红外光谱图中,895.8 cm−1处的特征吸收峰表明多糖中有β-葡萄糖基存在。810.2 cm−1处的特征吸收峰表明单糖分子的存在。在1 031.7和1 148.5 cm−1的强吸收峰显示了吡喃型糖基。1 650和1 550 cm−1处无显著吸收,表明多糖中无氨基基团残留,纯度较高。该红外光谱与文献报道一致[6]。
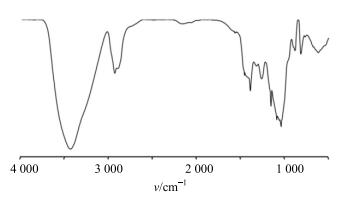
|
图 1 BSP的红外光谱表征 Fig.1 FTIR Spectroscopy of BSP |
2.2.2 热分析
使用DTG-60热重分析仪进行测试。升温速度10 ℃/min;温度范围20~500 ℃,填充气体为氮气。BSP的热重分析(thermogravimetric analysis,TGA)曲线见图 2。BSP的热降解分2步进行。在50~100 ℃,BSP有1个小的失重过程,失重约为10%,这是物料所含的结合水和结晶水产生的。在250~350 ℃,BSP发生剧烈降解,失重约60%。随后,BSP在测试温度内失重趋势变缓。
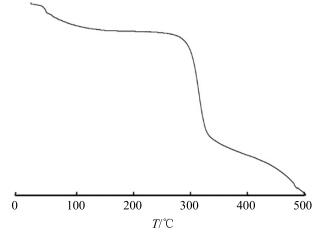
|
图 2 BSP的TGA曲线 Fig.2 TGA curve of BSP |
图 3为BSP的差热分析(differential thermal analysis,DTA)曲线,在100 ℃之前,有1个小的吸热峰,与BSP的失水过程相关;在250~300 ℃有1个强烈的放热峰,峰值为300 ℃左右,该峰与BSP的剧烈降解相关。DTA曲线显示结果与TGA结果相符。
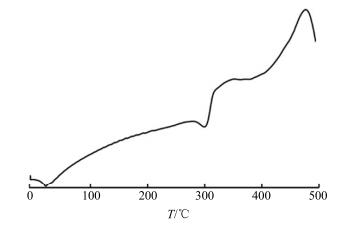
|
图 3 BSP的DTA曲线 Fig.3 DTA curve of BSP |
由热分解行为可知,BSP的降解行为具有典型的多糖特征,BSP的热降解分2步进行,首先是BSP内部的结合水损失;在250 ℃之后为多糖的自身降解失重。BSP的降解行为与文献报道一致[6]。
2.2.3 X射线衍射分析使用DMAX-2250衍射仪对BSP粉末进行X射线衍射分析。操作条件为Kα射线,测量电压36 kV,电流26 mA,扫描速率为0.05°/min,扫描角度为10°~100°(2θ),扫描间隔0.02°。其结果见图 4。由图 4可知,样品的曲线无尖锐峰,仅有少量小峰存在,表明该BSP是非晶体无定形材料[6]。
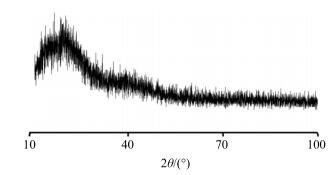
|
图 4 BSP的XRD分析 Fig.4 XRD analysis of BSP |
2.3 BSP水凝胶的制备
精确称取一定量提纯后的BSP完全溶解于18.0 mL蒸馏水中制备成BSP溶液。取0.1 g卡波姆940加入到该溶液中加热至80 ℃持续5 h,然后加入2.0 mL甘油继续搅拌3 min,后使用一定量的三乙醇胺调节pH值至7.4。制备出5个不同质量浓度的BSP水凝胶制剂(表 1)。
|
|
表 1 BSP水凝胶配比组成 Table 1 Composition of BSP hydrogel |
2.4 BSP水凝胶的流变学测试
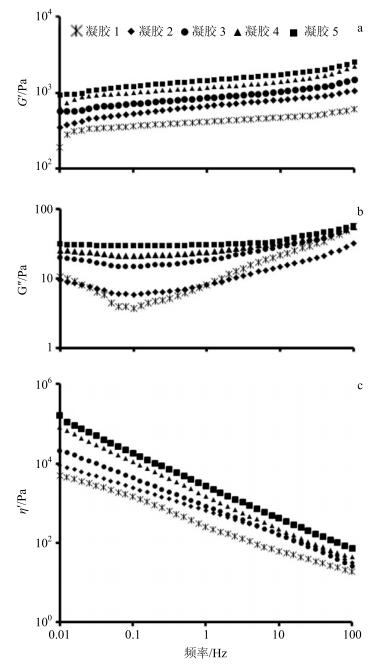
采用旋转流变仪测定BSP水凝胶的流变学特性。测试模式:频率扫描模式。测试参数:温度32 ℃(皮肤温度面),频率0.01~100 Hz[15]。分别以频率为横坐标,以存储模量(G′)、损耗模量(G″)以及动态复数黏度(η′)为纵坐标绘制水凝胶的流变学特征图,见图 5。通常,材料的G′与其固态特性有关,G″与其液态特性有关。空白对照水凝胶的谱图中,在线性黏弹范围(频率0.01~100 Hz)内,G′的值高于G″,且二者都表现出了明显的频率无关性,是典型的水凝胶行为[16]。
|
a-G′随频率变化曲线b-G″随频率变化曲线c-η′随频率变化曲线 a-curves of G′ vs frequency variation b-curves of G″ vs frequency variation c-curves of η′ vs frequency 图 5 不同配比的BSP水凝胶的流变性能 Fig.5 Rheological properties of BSP hydrogels |
与空白对照凝胶相比,BSP水凝胶在测试范围内表现出更高的G′和G″值(图 5-a和图 5-b)。且随BSP质量分数的增加,G′和G″均出现升高趋势,处方5(BSP质量分数2%)的G′和G″均明显高于处方2(BSP质量分数0.5%)。与之相对应地,BSP水凝胶的η′值也高于空白对照(图 5-c),且与BSP质量分数呈现正相关。水凝胶中加入BSP后,黏度显著提高。
2.5 BSP水凝胶皮肤通透性评价经皮水分散失速率(trans-epidermal water loss,TEWL)指单位时间单位面积内水分经由皮肤角质层向外扩散的量,是衡量皮肤角质层屏障作用的重要参数[17]。本实验以经皮水分散失速率为指标,考察BSP水凝胶对受试动物皮肤角质层屏障作用的影响。实验开始时,将30只小鼠(雌雄各半)根据表 1中水凝胶的配比随机分为5组,每组6只。在实验前24 h,小心剃除小鼠背部的体毛(1 cm×1 cm)作为给药部位。根据分组,在每组小鼠背部给药部位均匀涂抹供试凝胶或空白凝胶0.3 mL,每只小鼠隔离饲养。参考文献方法[17],给药前1.0 h和给药后1.0、1.5、2.0、2.5、3.0、4.0 h时分别用经皮水分散失仪测定给药部位的TEWL值。计算增渗比(enhancement ratio,ER)。
ER=TEWLt/TEWL0
TEWL0为给药前的TEWL值,TEWLt为BSP水凝胶给药后t时的TEWL值
各组受试动物的TEWL值见表 2。由表 2可知,正常小鼠皮肤的TEWL值为27 g/(m2∙h) 左右,给药前各组组间相比无显著差异(P>0.05)。给药1 h后,空白对照组(凝胶1)小鼠的TEWL值从(27.15±3.62)g/(m2∙h) 升高到(32.30±3.97)g/(m2∙h),且随着给药时间的延长逐渐降低。BSP水凝胶组给药1 h后的TEWL值出现了大幅提升。且提升幅度与水凝胶中BSP质量分数呈现正相关。其中,水凝胶组5(BSP质量分数2%)在给药1 h后的TEWL值最高,为(53.00±4.08)g/(m2∙h),显著高于给药前的对应值(P<0.01)。
|
|
表 2 给药后小鼠皮肤的TEWL值变化 (x±s, n=6) Table 2 Changes in TEWL values of mouse skin after administration of BSP gel (x±s, n=6) |
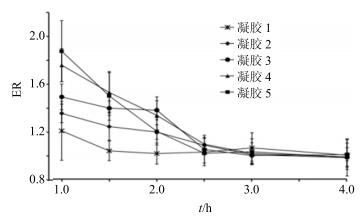
图 6描述了各组动物ER值随时间变化的曲线。给药1 h后,各组动物的ER值根据水凝胶中BSP质量分数的增加都出现了不同程度的提高。其中,凝胶5的ER值最高,为1.84,与表 2中的结果相对应。值得注意的是,在1 h后,各组受试动物的ER值都显著下降,到3 h时ER值已接近1。
|
图 6 给药后小鼠皮肤ER值随时间变化图 (x±s, n=6) Fig.6 Percentage changes of ER in mice after administration (x±s, n=6) |
2.6 BSP水凝胶的生物活性评价 2.6.1 止血时间(bleeding time,BT)测定
参考文献方法进行BT测定[8]。将30只小鼠(雌雄各半)根据表 1中的水凝胶配比随机分为5组,每组6只。用无菌刀片将距小鼠尾端5 mm处割破,立即于伤口涂抹100 μL相应水凝胶并开始计时。每15秒观察1次,伤口不再出血视为出血停止。从开始出血至出血停止的时间为小鼠BT。另取6只小鼠作为自然止血组(雌雄各半),自然止血组不加任何样品,其余处理方法同实验组,同样待伤口不再渗血后记录BT。
各组实验动物的BT测定值见表 3。自然止血组与凝胶1组相比较,2组实验动物的BT值并无明显区别(P>0.05)。而BSP水凝胶可降低动物的BT值,具有止血效果。且止血效果与BSP质量分数呈正相关。其中,凝胶3、4和5组受试动物的BT值显著低于凝胶1组(P<0.05)。
|
|
表 3 BSP水凝胶对小鼠BT的影响 (x±s, n=6) Table 3 Effects of BSP hydrogels on bleeding time in mice (x±s, n=6) |
2.6.2 凝血4项测定
参考文献方法进行凝血4项测定[18]。将大鼠断颈取全血,存储在预涂3.8%肝素钠的试管内,在室温下10 000 r/min离心分离10 min,小心吸取上层血浆,在2 h内进行实验。
取上述血浆100 μL,分别加入25 μL不同BSP质量分数的凝胶样品(同体积生理盐水作为阴性对照),混匀后,37 ℃孵育,用XN06-Ⅳ半自动血浆凝血分析仪进行凝血酶原时间(prothrombin time,PT)、凝血酶时间(thrombin time,TT)、活化部分凝血酶时间(activated partial thromboplastin time,APTT)、纤维蛋白原量(fibrinogen,FIB)测定。每种凝胶平行4次实验。
由表 4可知,与凝胶1组相比,BSP水凝胶组的PT并未发生明显改变,而APTT和TT值出现不同程度地降低,降低程度与BSP质量分数直接相关。另一方面,FIB值随着BSP质量分数的增加显著上升。上述结果表明BSP水凝胶对血浆凝固起到促进作用[19]。
|
|
表 4 BSP水凝胶对小鼠凝血4项指标的影响 (x±s, n=4) Table 4 Effects of BSP hydrogels on plasma coagulation time of mice (x±s, n=4) |
3 讨论
本实验通过水提醇沉法从白及中提取得到了BSP,并通过酶解和Sevag法进行纯化。通过FTIR、TGA、DTA、XRD等方法对BSP进行表征,将特征谱图与相关文献比较后发现,实验制备的BSP纯度较高且结构完整。
本实验设计了一系列BSP质量分数梯度(0~2%),将其和卡波姆交联制备得到水凝胶。通过流变学考察发现,BSP与卡波姆分子之间通过分子链穿插缠结形成网状结构,强化了凝胶的黏度。且由于BSP中的强氢键之间的相互作用,水凝胶表现出了良好的物理强度。
BSP水凝胶对皮肤屏障的通透性也具有一定的改善作用。通过在体TEWL考察发现,BSP水凝胶可以显著提升受试动物的TEWL值,从而增加了皮肤通透性,且该改善作用是可逆的,当给药3 h后,TEWL值恢复到正常水平。
BSP已被证明具有止血、凝血功能、促进伤口愈合等活性[3, 20-21]。通过进一步研究发现,BSP水凝胶在经皮给药后,表现出了明显的止血活性。结合其皮肤促渗活性,BSP水凝胶的在伤口敷料和经皮给药载体领域具有广阔的应用前景。
| [1] | 杨泽川.基于天然多糖的pH响应型高分子材料的合成及其生物功能研究[D].长春:吉林大学, 2016. |
| [2] | Wang C M, Sun J T, Luo Y, et al. A polysaccharide isolated from the medicinal herb Bletilla striata induces endothelial cells proliferation and vascular endothelial growth factor expression in vitro[J]. Biotechnol Lett, 2006, 28(8): 539–543. DOI:10.1007/s10529-006-0011-x |
| [3] | 董莉, 董永喜, 刘星星, 等. 白芨多糖对大鼠血小板聚集、疑血功能及TXB2、6-keto-PGF1α表达的影响[J]. 贵阳医学院学报, 2014, 39(4):459–462. |
| [4] | Zhang Y S, Lv T, Li M, et al. Anti-aging effect of polysaccharide from Bletilla striata on nematode Caenorhabditis elegans[J]. Pharmacogn Mag, 2015, 11(43): 449–454. DOI:10.4103/0973-1296.160447 |
| [5] | Li Q, Li K, Huang S S, et al. Optimization of extraction process and antibacterial activity of Bletilla striata polysaccharides[J]. Asian J Chem, 2014, 26(12): 3574–3580. |
| [6] | Kong L S, Yu L, Feng T, et al. Physicochemical characterization of the polysaccharide from Bletilla striata:Effect of drying method[J]. Carbohyd Polym, 2015, 125: 1–8. DOI:10.1016/j.carbpol.2015.02.042 |
| [7] | 王爱民, 王永林, 郑林, 等. 白及药材中多糖的含量测定[J]. 中国中药杂志, 2009, 37(22):2963–2965. |
| [8] | 王玮.白及止血粉的研制及其止血性能的研究[D].广州:广东药学院, 2015. |
| [9] | 王巍, 程明和, 高静, 等. 白及止血海绵止血作用的实验研究[J]. 药学实践志, 2016, 34(1):32–35. |
| [10] | 李伟泽, 张光伟, 赵宁, 等. 中药水凝胶巴布剂产业化工艺技术攻关研究[J]. 中草药, 2012, 43(10):1928–1933. |
| [11] | 葛月宾, 熊莹, 徐海燕, 等. 艾叶油乳-水凝胶贴膏剂的制备与透皮研究[J]. 中草药, 2015, 46(24):3661–3665. |
| [12] | 刘福强, 王艳萍, 韩丹, 等. 白及多糖的提取及其相对分子质量测定和结构研究[J]. 中成药, 2013, 35(10):2291–2293. |
| [13] | 孔令姗.白芨多糖的提取与功效研究[D].上海:上海应用技术学院, 2014. |
| [14] | Diao H J, Li X, Chen J N. Bletilla striata polysaccharide stimulates inducible nitric oxide synthase and proinflammatory cytokine expression in macrophages[J]. J Biosci Bioeng, 2008, 15(2): 85–89. |
| [15] | Wang C X, Han W, Tang X Z, et al. Evaluation of drug release profile from patches based on styrene-isoprene-styrene block copolymer:The effect of block structure and plasticizer[J]. AAPS PharmSciTech, 2012, 13(2): 556–567. DOI:10.1208/s12249-012-9778-3 |
| [16] | Bonacucina G, Martelli S, Palmieri G F. Rheological, mucoadhesive and release properties of Carbopol gels in hydrophilic cosolvents[J]. Int J Pharm, 2004, 282(1/2): 115–130. |
| [17] | Nuutinen J, Alanen E, Autio P, et al. A closed unventilated chamber for the measurement of transepidermal water loss[J]. Skin Res Technol, 2003, 9(2): 85–89. DOI:10.1034/j.1600-0846.2003.00025.x |
| [18] | 孙永富, 可吸收壳聚糖材料止血性能及其生物相容性研究[D].杭州:浙江大学, 2013. |
| [19] | 丰博, 王金磊, 庄朋伟, 等. 舒脑欣滴丸与华法林钠抗凝血相互作用研究[J]. 中草药, 2015, 46(16):2445–2447. |
| [20] | 汤逸飞, 阮川芬, 应晨, 等. 白及属植物化学成分与药理作用研究进展[J]. 中草药, 2014, 45(19):2864–2872. |
| [21] | 崔向磊.白芨多糖的结肠生物可降解性与抗溃疡性结肠炎活性研究[D].苏州:苏州大学, 2012. |
 2017, Vol. 48
2017, Vol. 48



