UPLC-Triple-TOF/MS系统:AcquityTM ultra型高效液相色谱仪(美国Waters公司),Triple TOF 5600+型飞行时间质谱,配有电喷雾离子源(美国AB SCIEX公司);Eppendorf minispan离心机(德国Eppendorf公司);METTLER TOLEDO XS105分析天平(瑞士Mettler Toledo公司);三叶青药材购自浙江中医药大学饮片厂(批号141113),由浙江大学生命科学学院姜维梅副教授鉴定为三叶崖爬藤Tetrastigma hemsleyanum Diels et Gilg的干燥块根。乙腈和甲酸为色谱纯(Merck公司),水为Milli-Q超纯水,其余试剂均为分析纯。紫云英苷、儿茶素、山柰酚、槲皮素和槲皮苷对照品购于上海一飞生物科技有限公司;异鼠李素和异槲皮苷对照品购于上海融禾医药科技发展有限公司;对照品质量分数均大于98%。
2 方法 2.1 色谱及质谱条件 2.1.1 色谱条件色谱柱为安捷伦Eclipse Plus-C18(100 mm×4.6 mm,1.8 μm);以0.1%甲酸溶液为流动相A,以0.1%甲酸乙腈为流动相B,线性梯度洗脱,0~10 min,5%~10% B;10~13 min,10%~12% B;13~18 min,12% B;18~25 min,12%~20% B;25~30 min,20%~40% B;30~50 min,40%~90% B,体积流量为1.0 mL/min;柱温为30 ℃;检测波长为254 nm;进样量10 μL。
2.1.2 质谱条件UPLC-Triple-TOF 5600+飞行时间液质联用仪:负离子扫描模式;扫描范围:m/z 100~1 500;雾化气(GS1):344.75 kPa;雾化气(GS2):344.75 kPa;气帘气(CUR):241.325 kPa;离子源温度(TEM):550 ℃(负);离子源电压(IS):-4 500 V(负);一级扫描:去簇电压(DP):100 V;聚焦电压(CE):10 V;二级扫描:使用TOF MS~Product Ion~IDA模式采集质谱数据,CID能量为30、50和70 eV,进样前,用CDS泵做质量轴校正,使质量轴误差小于2×10-6。
2.2 供试品溶液制备三叶青药材粉碎过80目筛,干燥(50 ℃)至恒定质量,取2.0 g至100 mL烧瓶,80 mL甲醇水浴回流提取1 h,滤过,取70 mL续滤液,减压浓缩至干,甲醇复溶并转移到5 mL量瓶中,用甲醇定容至刻度,摇匀,0.45 μm微孔滤膜滤过。
2.3 化合物结构分析查阅国内外三叶青及其同科属植物化学成分研究相关文献报道,同时借助Scifinder和Reaxys数据库,收集整理了三叶青中各类化学成分。利用液质联用仪采集数据后,提取各色谱峰的质谱图,根据准分子离子([M+H]+、[M-H]-)和加荷离子([M+NH4]+、[M+Na]+、[M+Cl]-、[M+HCOO]-等)信息判断并得到的一级质谱精确相对分子质量,通过peakview 1.2软件在5×10-6的质量偏差范围内拟合分子式,与文献数据库进行比对,对各色谱峰进行初步推测。筛选信噪比较好的二级质谱图以获取色谱峰的二级质谱信息,并获得化合物相应的碎片离子,根据离子的裂解情况并结合对照品及文献数据进一步比对推测化学成分。
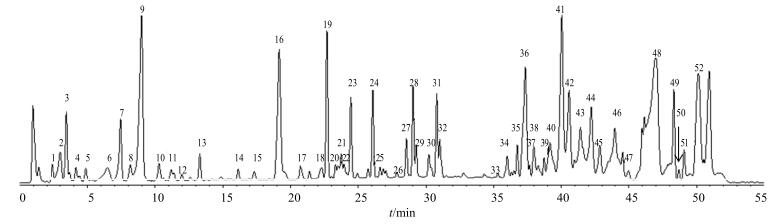
3 结果三叶青样品在“2.1”项色谱及质谱条件下分析得三叶青UPLC-Triple-TOF/MS总离子流图,见图 1。根据“2.3”的数据分析方法,共得到52种成分,推测了其中51种,结果见表 1。
|
图 1 三叶青样品UPLC-Triple-TOF/MS的负离子基峰离子色谱图 Fig.1 UPLC-Triple-TOF-MS base peak chromatogram of T. hemsleyanum in negative ion mode |
|
|
表 1 三叶青化学成分分析 Table 1 Identification analysis of each chemical constituent in T. hemsleyanum |
3.1 黄酮类
根据文献报道[1]三叶青的提取物中含有槲皮素、山柰酚等黄酮类成分,在一级质谱中,化合物的准分子离子峰丰度较高,氯和甲酸加荷离子峰丰度较低,在二级高分辨质谱中,可以观测到[M-Glc-H]-、[M-Rha-H]-、[M-Glc-Xyl-H]-、[M-Rha-Glc-H]-等碎片离子,其中m/z 285.040 5、m/z 301.035 6和m/z 315.051 0分别为山柰酚、槲皮素和异鼠李素的准分子离子峰。通过比对对照品,峰22、24、26、29、31和32鉴定为异槲皮苷、紫云英苷、槲皮苷、槲皮素、山柰酚和异鼠李素。峰14、16、17、18、19、20、21、23、25和28通过分析其碎片和母核离子,确定为黄酮类成分,经文献比对[7-10],推测其结构。
峰6、7、8和15 TOF/MS均给出分子离子峰577.135 4,质谱软件计算出精确分子式为C30H26O12,与文献报道的原花青素二聚体类分子式一致,再根据TOF-MS二级碎片离子m/z 407.079 9、289.072 5、245.081 2、125.025 0等,与文献报道原花青素二聚体二级质谱相一致[11],推测为原花青素二聚体,峰10给出分子离子峰865.201 4,质谱软件计算出精确分子式为C45H38O18,再根据TOF-MS二级碎片离子m/z 739.172 2,577.138 3,407.079 9,289.072 5,245.081 2,125.025 0,推测为原花青素三聚体。峰9经对照品比对,推断峰9为儿茶素。
3.2 酚酸类峰2、3、4和5 TOF/MS给出分子离子峰,质谱软件计算出精确分子式,在二级质谱中,均观测到m/z 152.011 0(C7H4O4)和108.022 9(C6H4O2)离子,根据质谱软件计算,m/z108.022 9可能为二苯酚类结构,而m/z 152.011 0脱羧后变成m/z 108.022 9离子,此类结构的母核可能为原儿茶酸,根据文献检索和裂解途径研究[12-13],推测峰2和3为原儿茶酸葡萄糖苷,葡萄糖取代未知无法确认。峰4和5分别推测为香草酸-1-O-呋喃芹糖基葡萄糖酯和原儿茶酸-1-O-呋喃芹糖基葡萄糖酯。根据TOF/MS结果,峰11与峰12差1个亚甲基,根据峰11二级碎片信息,推测峰11的母核离子为二苯酚结构,根据Reaxys数据库检索,推测峰11和峰12分别推测为甲氧基苯酚-1-O-呋喃芹糖基-O-葡萄糖苷和2-甲氧基-4-甲基苯-1-O-呋喃芹糖基葡萄糖苷。
3.3 酯类负离子模式下观测到一些饱和度较高的的化学成分,可能存在长链不饱和脂肪酸结构单元,该类成分出峰晚于黄酮苷元,紫外吸收较差,容易被忽视。对高分辨质谱数据解析后,发现三叶青块根中存在磷脂和糖酯2类成分。
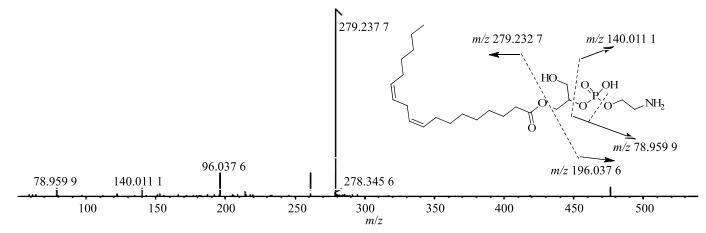
3.3.1 磷脂类峰37、38、39、41、42、44和45,一级质谱负离子模式响应较好,质谱软件计算出精确分子式,发现化合物中含有磷元素且饱和度较高,检索数据库后,初步推测此类化合物为磷脂,在二级质谱中观测到m/z 78.962 9(PO3)典型磷脂碎片峰,根据Reaxys数据库和裂解途径分析(图 2),推测均为磷脂类成分。
|
图 2 1-Linoleylglycero-2-phosphoethanolamin质谱裂解过程 Fig.2 Detail fragmentation pathway of 1-linoleylglycero-2-phosphoethanolamin |
3.3.2 糖酯类
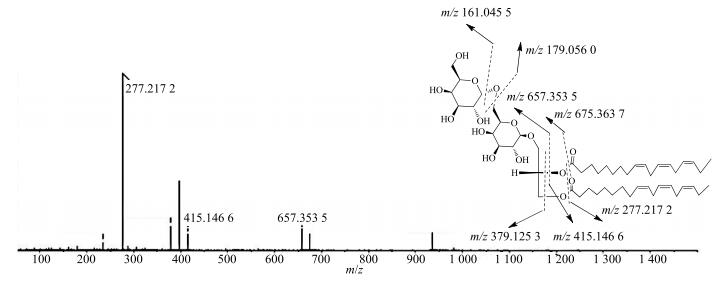
峰33、34、35和48在一级质谱中,化合物的氯和甲酸加荷离子丰度较高,几乎观测不到准分子离子峰,二级质谱中,观测到m/z 161.045 5、277.217 2、415.146 6和675.365 7等碎片离子,根据文献检索[14-15]和裂解途径分析(图 3),推测均为糖酯类成分。
|
图 3 1, 2-二亚麻酰-3-O-(半乳糖基半乳糖) 甘油质谱裂解过程 Fig.3 Detail fragmentation pathway of 1, 2-di-O-linolenoyl-3-O-(galactopyranosyl-O-galactopyranosyl) glycerol |
3.4 烷基磺酸类
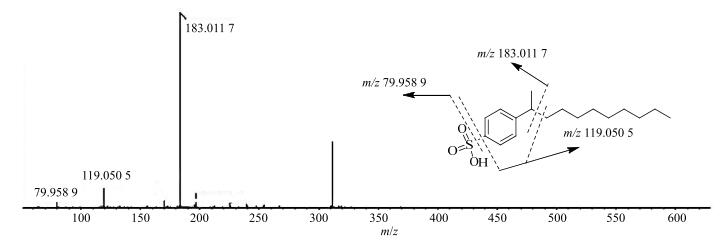
峰36、40、43、46和47,一级质谱负离子模式响应较好,质谱软件计算出精确分子式,发现化合物中含有硫元素,检索数据库后,初步推测此类化合物为烷基磺酸类,在二级质谱中观测到m/z 79.958 9(SO3)和m/z 183.011 7(C8H8SO3)2个典型磺酸根和苯磺酸根碎片峰,根据数据库和裂解途径分析(图 4),推测均为烷基磺酸类成分。
|
图 4 4-(1-Methyl-decyl)-benzenesulfonic acid质谱裂解过程 Fig.4 Detail fragmentation pathway of 4-(1-methyl-decyl)-benzenesulfonic acid |
3.5 其他类
峰1在一级质谱中显示[M-H]-离子为m/z 353.144 8,质谱软件计算出精确分子式为C14H26O10,在MS2图谱中均可见m/z 207.086 8和m/z 161.043 3,推测为[M-H-Rha]-和[Glu-H-H2O]-,峰1推测为乙基芸香糖苷;峰13在一级质谱中显示[M-H]-离子为m/z 415.161 0,质谱软件计算出精确分子式为C19H28O10,在MS2图谱中均可见m/z 269.102 1和m/z 161.044 4,推测为[M-H-Rha]-和[Glu-H-H2O]-,峰13推测为苯乙醇芸香糖苷[16];同理,其余色谱峰均得到推测。
4 讨论 4.1 检测条件的优化比较了正负离子检测模式,发现负离子模式质谱响应明显优于正离子模式,因此本实验在负离子模式下定性分析样品。通过色谱条件优化,比较了乙腈水和甲醇水,结果表明,使用乙腈水系统的分离效果优于甲醇水。当水相中添加0.1%甲酸时,峰形更优,质谱响应更佳。色谱柱比较了普通C18柱和快速分离柱(填料粒径1.8 μm),快速分离柱不但提高了峰容量,而且磷脂和糖酯类成分峰形得到明显改善。
4.2 质谱解析UPLC-Triple-TOF/MS提供了一级高分辨数据,根据元素组成,计算出分子式,寻找植物中首次发现的已知化合物提供了搜库的可能。二级碎片离子也是高分辨数据,为分析碎片离子和断裂方式提供更加准确而丰富的信息。
4.3 小结本实验利用UPLC-Triple-TOF/MS联用技术,建立了三叶青定性分析方法,共分析了三叶青52个化合物,为三叶青成分定性提供了一种快速、高效的分析方法。磷脂、糖酯和烷基磺酸类成分在三叶青块根中首次发现,扩展了三叶青化学成分类别,但其药理活性有待进一步研究。本研究结果可以为三叶青的药效物质基础研究及质量控制提供新的依据。
| [1] | 陈丽芸, 郭素华. 三叶青的化学成分及药理作用研究进展[J]. 浙江中医药大学学报, 2012(12):1368–1370. |
| [2] | Peng X, Zhuang D D, Guo Q S. Induction of S phase arrest and apoptosis by ethyl acetate extract from Tetrastigma Hemsleyanum in human hepatoma hepg (2) cells[J]. Tumor Biol, 2015, 36(4): 2541–2550. DOI:10.1007/s13277-014-2869-x |
| [3] | Ye C L, Liu X G. Extraction of flavonoids from Tetrastigma hemsleyanum Diels et Gilg and their antioxidant activity[J]. J Food Processing Preservation, 2015, 39(6): 2197–2205. DOI:10.1111/jfpp.12464 |
| [4] | Peng Y, Zhao L L, Lin D J, et al. Determination of the chemical constituents of the different processed products of Anemarrhena Asphodeloides Rhizomes by high-performance liquid chromatography quadrupole time-of-flight mass spectrometry[J]. Biomed Chromatogr, 2016, 30(4): 508–519. DOI:10.1002/bmc.v30.4 |
| [5] | Ling Y, Fu Z W, Zhang Q, et al. Identification and structural elucidation of steroidal saponins from the root of Paris Polyphylla by HPLC-ESI-QTOF-MS/MS[J]. Nat Prod Res, 2015, 29(19): 1798–1803. DOI:10.1080/14786419.2015.1007137 |
| [6] | Zhang F, Qi P, Xue R, et al. Qualitative and quantitative analysis of the major constituents in Acorus tatarinowii Schott by HPLC/ESI-QTOF-MS/MS[J]. Biomed Chromatogra, 2015, 29(6): 890–901. DOI:10.1002/bmc.v29.6 |
| [7] | 许文, 傅志勤, 林婧, 等. HPLC-Q-TOF-MS和UPLC-QqQ-MS的三叶青主要成分定性与定量研究[J]. 中国中药杂志, 2014, 30(22):4365–4372. |
| [8] | 许文, 傅志勤, 林婧, 等. UPLC-MS/MS法同时测定三叶青中10种黄酮类成分[J]. 药学学报, 2014, 49(12):1711–1717. |
| [9] | Sun Y, Li H Y, Hu J N, et al. Qualitative and quantitative analysis of phenolics in Tetrastigma Hemsleyanum and their antioxidant and antiproliferative activities[J]. J Agric Food Chem, 2013, 61(44): 10507–10515. DOI:10.1021/jf4037547 |
| [10] | Sun Y, Qin Y, Li H Y, et al. Rapid characterization of chemical constituents in Radix Tetrastigma, a functional herbal mixture, before and after metabolism and their antioxidant/antiproliferative activities[J]. J Functional Foods, 2015, 18: 300–318. DOI:10.1016/j.jff.2015.07.009 |
| [11] | 刘国强, 董静, 王弘, 等. Egc/Gc和egcg/Gcg的esi-It-Tof质谱裂解规律研究[J]. 质谱学报, 2009, 30(5):287–294. |
| [12] | Zeng X, Wang H, Gong Z, et al. Antimicrobial and cytotoxic phenolics and phenolic glycosides from Sargentodoxa Cuneata[J]. Fitoterapia, 2015, 101: 153–161. DOI:10.1016/j.fitote.2015.01.008 |
| [13] | 陈丽芸.三叶青化学成分及抗肿瘤活性研究[D].福州:福建中医药大学, 2014. |
| [14] | Yoshikawa M, Yamaguchi S, Kunimi K, et al. Stomachic principles in Ginger. Iii. An anti-ulcer principle, 6-gingesulfonic acid, and three monoacyl-digalactosylglycerols, gingerglycolipids A, B, and C, from Zingiberis Rhizoma originating in Taiwan[J]. Chem Pharm Bull, 1994, 42(6): 1226–1230. DOI:10.1248/cpb.42.1226 |
| [15] | Gao Z, Ali Z, Khan I A. Glycerogalactolipids from the fruit of Lycium Barbarum[J]. Phytochemistry, 2008, 69(16): 2856–2861. DOI:10.1016/j.phytochem.2008.09.002 |
| [16] | 郭晓江.两种药用植物的化学成分及生物活性研究[D].济南:山东大学, 2013. |
 2017, Vol. 48
2017, Vol. 48


