2. 沈阳药科大学中药学院, 辽宁 沈阳 110016
2. School of Traditional Chinese Materia Medica, Shenyang Pharmaceutical University, Shenyang 110016, China
没药Myrrha是橄榄科(Burseraceae)没药属Commiphora Engl.植物地丁树Commiphora myrrhaEngl.或哈地丁树Commiphora molmolEngl.的干燥树脂[1]。其主产于非洲东北部、肯尼亚北部、阿拉伯半岛南部,另在苏丹、马达加斯加、利比亚、印度、中国等地也有分布[2],是一种传统香料,兼作药用。没药味苦、辛,性平,有活血止痛、消肿生肌的功效,在各国民间医药中广泛应用,有抗炎、杀菌、退热、健胃、通经、止痛、止血、促进伤口愈合等作用,可用于外伤、溃疡、肺结核、贫血、风湿病、蠕虫病、妇科病等诸多疾患[2-3]。近代药理学研究表明没药具有抗炎、抗微生物、抗肿瘤等多种药理活性,可用于治疗脾、肝、胃等多种肿瘤,而且较安全,无明显毒副作用。已从中分离得到的主要化学成分有单萜、倍半萜、三萜、甾体、木脂素等[4-5]。为了开发利用没药资源,在前期工作基础上[6-7],本实验进一步研究了没药的化学成分和抗肿瘤活性。采用重结晶、硅胶、Sephadex LH-20、ODS柱色谱和制备HPLC等方法对没药的三氯甲烷提取物进行化学成分研究,从中分离得到11个化合物,分别鉴定为 (4α, 11α)-2-酮基-8, 11-二羟基杜松-1(6), 7, 9-三烯-12-酸-γ-内酯[(4α, 11α)-2-oxo-8, 11-dihydroxycadina-1(6), 7, 9-trien-12-oic acid-γ-lactone,1]、(4α, 11β)-2-酮基-8, 11-二羟基杜松-1(6), 7, 9-三烯-12-酸-γ-内酯[(4α, 11β)-2-oxo-8, 11-dihydroxycadina-1(6), 7, 9-trien-12-oic acid-γ-lactone,2]、二氢焦莪术酮(dihydropyrocurzerenone,3)、泽泻萜醇E(orientalol E,4)、愈创木烷二醇(guaianediol,5)、柳杉二醇(cryptomeridiol,6)、环阿尔廷-1α, 2α, 3β, 25-四醇(cycloartane-1α, 2α, 3β, 25-tetrol,7)、环阿尔廷-24-烯-1α, 2α, 3β-三醇(cycloartan-24-ene-1α, 2α, 3β-triol,8)、环阿尔廷-24-烯-1α, 3β-二醇(cycloartan-24-ene-1α, 3β-diol,9)、29-降羊毛脂-8, 24-二烯-1α, 2α, 3β-三醇(29-norlanost-8, 24-dien-1α, 2α, 3β-triol,10)、十八烷-1, 2S, 3S, 4R-四醇-1-O-α-L-吡喃鼠李糖苷(octadecane-1, 2S, 3S, 4R-tetrol-1-O-α-L-rhamnopyrano-side,11)。其中化合物1、2为新化合物,分别命名为 (+)-没药内酯A和 (-)-没药内酯A;化合物4、6为首次从没药属植物中分离得到。通过MTT法检测,化合物8、10和11对人前列腺癌PC-3细胞具有细胞毒作用。
1 仪器与材料Bruker ARX-300型、Bruker AV-600型核磁共振波谱仪(德国布鲁克公司);GCMS-5050A气质联用仪(日本岛津制作所);1100离子阱型液-质联用仪(美国安捷伦科技有限公司);Autospec-VItimaE TOF型质谱仪(美国Waters公司);241MC polarimeter(美国PerkinElmer公司);薄层硅胶GF254、薄层硅胶H、200~300目柱色谱用硅胶(青岛海洋化工厂);Sephadex LH-20(美国GE公司);ODS C18(日本YMC公司);溶剂均为分析纯;CO2培养箱(德国Heraeus公司);SW-CJ超净工作台(上海锦屏仪器仪表有限公司);TGL-16G高速离心机(上海安亭科学仪器厂);550酶标仪(美国Biorad公司);ZW-A定时微量振荡器(富华仪器有限公司);XD-101倒置显微镜(南京江南光电有限公司);B1-220A生物显微镜(麦克奥迪实业集团有限公司);AR1140电子分析天平(梅特勒-托利多仪器上海有限公司);40B1自动立式压力蒸汽灭菌器(上海申安医疗器械厂)。
没药药材购自辽宁省沈阳市同仁堂药店,由沈阳药科大学药用植物教研室孙启时教授鉴定为没药属地丁树Commiphora myrrha Engl.的树脂。
人前列腺癌PC-3细胞购于美国ATCC,由美国西奈山医学院景永奎教授提供,胎牛血清购自Gibco公司。
2 提取与分离没药树脂粉末450 g,三氯甲烷回流提取3次,合并提取液,回收溶剂得浸膏250 g。取100 g浸膏进行硅胶柱色谱分离,以石油醚-丙酮(100:0→1:1)梯度洗脱,TLC分析后,合并得到8个流分(Fr. 1~8)。Fr. 1经重结晶得化合物3(10 mg)。Fr. 5经Sephadex LH-20柱色谱分离(三氯甲烷-甲醇1:1),得到3个流分Fr. 5.1~5.3。Fr. 5.2经开放ODS柱色谱,甲醇-水梯度洗脱,其中60%甲醇-水溶液洗脱得到9个流分Fr. 5.2.1~5.2.9,Fr. 5.2.4经ODS柱色谱,甲醇-水系统洗脱,55%甲醇-水洗脱部分经重结晶得化合物1和2的混合物(5 mg)。Fr. 5.2.5经制备薄层色谱(三氯甲烷-甲醇10:1)纯化得到化合物4(10 mg)和5(12 mg)。Fr. 6先后经Sephadex LH-20柱色谱(三氯甲烷-甲醇1:1)和硅胶柱色谱(石油醚-丙酮5:1)分离,得到3个流分(Fr. 6.1~Fr. 6.3),Fr. 6.2经ODS柱色谱,甲醇-水溶剂系统梯度洗脱,得到3个流分(Fr. 6.2.1~Fr. 6.2.3)。Fr. 6.2.1和Fr. 6.2.2分别经重结晶得化合物6(15 mg)和10(25 mg)。Fr. 6.2.3再经ODS柱色谱甲醇-水溶剂系统分离,95%甲醇-水洗脱部分得到4个流分(Fr. 6.2.3.1~6.2.3.4)。Fr. 6.2.3.2经硅胶柱色谱(三氯甲烷-甲醇10:1)分离得化合物8(20 mg)和9(8 mg)。Fr. 7经反复Sephadex LH-20(三氯甲烷-甲醇1:1)、硅胶柱色谱(三氯甲烷-甲醇10:1)分离,得到3个流分(Fr. 7.1~7.3)。Fr. 7.2再经ODS柱色谱(甲醇-水)分离,80%甲醇-水洗脱部分得到化合物7(20 mg)。Fr. 8经Sephadex LH-20(三氯甲烷-甲醇1:1)、硅胶柱色谱(石油醚-丙酮100:80)分离,得到2个流分(Fr. 8.1~8.2)。Fr. 8.2再经Sephadex LH-20柱色谱(三氯甲烷-甲醇1:1)分离,得到3个流分(Fr. 8.2.1~8.2.3),Fr. 8.2.2经重结晶得到化合物11(20 mg)。
3 结构鉴定化合物1和2:无色针晶(三氯甲烷-甲醇)。溶于三氯甲烷、甲醇。10%硫酸乙醇溶液显色不明显,碘熏不显色,紫外254 nm下有暗斑。1H-NMR (600 MHz, DMSO-d6) 谱(表 1)中给出了2组非常接近的信号,且2组信号中相同基团的信号峰面积积分相同,推测该样品是摩尔比1:1的差向异构体混合物。在HPLC(50%乙腈-水)中显示2个未完全分开的色谱峰,证实了上述推测。1H-NMR谱中1组信号(化合物1)包括:1个芳香质子信号δ 7.06 (1H, brs),1个活泼质子信号δ 6.62 (1H, s),2组亚甲基上偕偶质子信号δ 3.38 (1H, m) 和2.63 (1H, m), 2.58 (1H, m) 和2.37 (1H, m),1个连接在sp2杂化碳上的甲基信号δ 2.59 (3H, brs),1个次甲基质子信号δ 2.15 (1H, m),1个与sp3杂化碳相连的甲基信号δ 1.64 (3H, s),1个甲基双峰信号δ 1.09 (3H, d, J=6.5 Hz);化合物2则给出了相似的质子信号(表 1)。13C-NMR (150 MHz, DMSO-d6) 谱(表 1)中亦给出2组碳信号,其中化合物1的信号包括α, β-不饱和羰基碳信号δ 198.2、酯羰基碳信号δ 177.8、6个芳香碳信号以及1个连氧sp3杂化碳信号,另外高场区还给出6个脂肪碳信号;化合物2亦有相似的碳信号(表 1)。根据以上信息推测该样品是由2个倍半萜内酯非对映异构体组成的摩尔比1:1的混合物,结构中含有α, β-不饱和酮、1个苯环、1个丁内酯结构,以及1个羟基和3个甲基取代。
|
|
表 1 化合物1和2的1H-NMR和13C-NMR数据 (600/150 MHz, DMSO-d6) Table 1 1H-NMR and 13C-NMR spectroscopic data of compounds 1 and 2 (600/150 MHz, DMSO-d6) |
将其核磁数据与没药酮(myrrhone)[8]的数据比较,化合物1和2少了1个烯质子信号和1对烯碳信号,多了1个羟基质子信号和酯羰基碳以及连氧sp3杂化碳信号,而且13位的甲基质子信号向高场位移δ0.78,其他信号相似,推断其结构为:没药酮呋喃环变成内酯结构并在11位有羟基取代。此外文献报道了一对倍半萜内酯差向异构体[9],其结构与化合物1和2的不同在于2位羰基变成亚甲基,分析比较核磁数据,进一步确认1和2的结构(图 1),并归属了1和2的核磁数据。
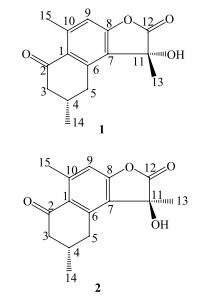
|
图 1 化合物1和2的结构 Fig.1 Structures of compounds 1 and 2 |
化合物1和2色谱行为很接近,高效液相色谱中,流动相为甲醇-水系统时为1个峰;50%乙腈-水系统中,二者有一定分离度,但无法实现基线分离,故未能得到单体化合物。考虑到生源关系,并根据已报道的类似物9-甲氧基没药酮[7]和没药酮[8]的结构,推断化合物1和2互为11位的差向异构体,因此鉴定化合物1和2的结构分别为 (4α, 11α)-2-酮基-8, 11-二羟基杜松-1(6), 7, 9-三烯-12-酸-γ-内酯和 (4α, 11β)-2-酮基-8, 11-二羟基杜松-1(6), 7, 9-三烯-12-酸-γ-内酯,均为未见文献报道的新化合物,命名为 (+)-没药内酯A和 (-)-没药内酯A。
化合物3:无色针晶(石油醚-丙酮),10%硫酸乙醇溶液显色呈蓝色。ESI-MS m/z: 251.0 [M+Cl]−, 259.0 [M+HCOO]−。1H-NMR (300 MHz, CDCl3) δ: 7.22 (1H, brs, H-12), 7.08 (1H, brs, H-9), 3.30 (1H, m, H-5b), 2.72 (1H, m, H-5a), 2.59 (2H, m, H-2), 2.36 (3H, d, J=0.9 Hz, H-13), 2.28 (3H, s, H-15), 1.95 (1H, m, H-3b), 1.93 (1H, m, H-3a), 1.40 (1H, m, H-4), 1.10 (3H, d, J=6.5 Hz, H-14)。以上数据与文献报道[10]基本一致,确定化合物3为二氢焦莪术酮。
化合物4:无色油状物,紫外254 nm下无暗斑,365 nm下无荧光,10%硫酸乙醇溶液显色呈粉红色, 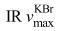
化合物5:无色方晶(甲醇),紫外254 nm下无暗斑,365 nm下无荧光,10%硫酸乙醇溶液显色呈蓝色,久置褐红色。ESI-MS m/z: 277.2 [M+K]+。1H-NMR (300 MHz, CDCl3) δ: 5.50 (1H, d, J=3.0 Hz, H-6), 2.24 (1H, m, H-11), 2.19 (1H, m, H-8a), 2.15 (1H, m, H-5), 1.94 (1H, m, H-8b), 1.86 (1H, m, H-1), 1.81 (1H, m, H-9a), 1.76 (1H, m, H-2b), 1.70 (1H, m, H-3a), 1.66 (1H, m, H-2a), 1.60 (1H, m, H-3b), 1.49 (1H, m, H-9b), 1.27 (3H, s, H-15), 1.21 (3H, s, H-14), 0.99 (3H, d, J=6.8 Hz, H-12), 0.97 (3H, d, J=6.8 Hz, H-13)。以上数据与文献报道[12]对照基本一致,确定化合物5为愈创木烷二醇。
化合物6:无色针晶(甲醇),紫外254 nm下无暗斑,365 nm下无荧光,10%硫酸乙醇溶液显色呈暗红色,显色后紫外365 nm下呈亮蓝色荧光。1H-NMR (300 MHz, CDCl3) δ: 1.93 (1H, brd, J=12.9 Hz, H-6a), 1.80 (1H, brd, J=12.9 Hz, H-6b), 1.21 (6H, s, H-12, 13), 1.12 (3H, s, H-14), 0.87 (3H, s, H-15);13C-NMR (75 MHz, CDCl3) δ: 73.0 (C-11), 72.3 (C-4), 54.8 (C-5), 49.9 (C-7), 44.6 (C-9), 43.4 (C-3), 41.0 (C-1), 34.5 (C-10), 27.3 (C-13), 27.1 (C-12), 22.6 (C-14), 22.5 (C-8), 21.5 (C-6), 20.1 (C-2), 18.7 (C-15)。以上数据与文献报道[13-14]对照基本一致,确定化合物6为柳杉二醇。
化合物7:无色针晶(甲醇),10%硫酸乙醇溶液显色呈紫红色,[α]D25 +50.0° (MeOH, c 0.54), 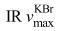
化合物8:无色片晶(甲醇),10%硫酸乙醇溶液显色初为绿色,后变红色。1H-NMR (300 MHz, CDCl3) δ: 5.10 (1H, t, J=7.0 Hz, H-24), 3.64 (1H, dd, J=9.8, 3.1 Hz, H-2), 3.55 (1H, brs, H-1), 3.48 (1H, d, J=9.8 Hz, H-3), 2.29 (1H, m, H-11β), 2.06 (1H, m, H-23), 1.93 (1H, dd, J=15.2, 4.5 Hz, H-5), 1.91 (1H, m, H-16β), 1.88 (1H, m, H-23), 1.69 (3H, s, H-27), 1.68 (2H, m, H-12), 1.65 (1H, m, H-6α), 1.61 (3H, s, H-26), 1.60 (1H, m, H-17), 1.53 (1H, dd, J=15.2, 4.8 Hz, H-8), 1.42 (1H, m, H-22), 1.37 (2H, m, H-7β), 1.32 (4H, m, H2-15, H-16α, H-20), 1.27 (1H, m, H-11α), 1.15 (1H, dd, J=12.5, 2.4 Hz, H-7α), 1.06 (1H, m, H-22), 1.00 (3H, s, H-29), 0.97 (3H, s, H-18), 0.96 (3H, s, H-28), 0.90 (3H, d, J=6.4 Hz, H-21), 0.86 (1H, m, H-6β), 0.82 (3H, s, H-30), 0.73 (1H, d, J=4.4 Hz, H-19β), 0.49 (1H, d, J=4.4 Hz, H-19α);13C-NMR (75 MHz, CDCl3) δ: 130.9 (C-25), 125.2 (C-24), 78.1 (C-3), 75.3 (C-1), 72.6 (C-2), 52.3 (C-17), 48.8 (C-14), 47.9 (C-8), 45.2 (C-13), 40.1 (C-4), 39.3 (C-5), 36.3 (C-22), 35.9 (C-20), 35.7 (C-15), 32.7 (C-12), 29.4 (C-19), 29.0 (C-10), 28.1 (C-16), 26.1 (C-11), 25.7 (C-26), 25.6 (C-7), 25.6 (C-29), 24.9 (C-23), 20.6 (C-6), 20.3 (C-9), 19.4 (C-28), 18.2 (C-21), 18.1 (C-18), 17.6 (C-27), 14.2 (C-30)。以上数据与文献报道[15]对照基本一致,确定化合物8为环阿尔廷-24-烯-1α, 2α, 3β-三醇。
化合物9:无色针晶(甲醇),10%硫酸乙醇溶液显色呈紫红。ESI-MS m/z: 443.0 [M+H]+。1H-NMR (300 MHz, CDCl3) δ: 5.10 (1H, t, J=7.0 Hz, H-24), 3.77 (1H, dd, J=12.0, 4.8 Hz, H-3), 3.58 (1H, brs, H-1), 1.68 (3H, s, H-27), 1.61 (3H, s, H-26), 1.00 (3H, s, H-29), 0.95 (3H, s, H-28), 0.93 (3H, s, H-18), 0.88 (3H, d, J=6.4 Hz, H-21), 0.79 (3H, s, H-30), 0.71 (1H, d, J=4.6 Hz, H-19β), 0.46 (1H, d, J=4.6 Hz, H-19α)。以上数据与文献报道[17]对照基本一致,确定化合物9为环阿尔廷-24-烯-1α, 3β-二醇。
化合物10:无色针晶(甲醇),10%硫酸乙醇溶液显紫红色,显色后紫外365 nm下呈亮蓝色荧光。1H-NMR (300 MHz, CDCl3) δ: 5.10 (1H, t, J=6.9 Hz, H-24), 3.95 (1H, d, J=2.5 Hz, H-1), 3.64 (1H, dd, J=9.5, 2.9 Hz, H-2), 3.33 (1H, t, J=9.5 Hz, H-3), 1.69 (3H, s, H-27), 1.61 (3H, s, H-21), 1.04 (3H, d, J=5.6 Hz, H-28), 1.00 (3H, s, H-19), 0.94 (3H, d, J=3.5 Hz, H-21), 0.93 (3H, s, H-30), 0.72 (3H, s, H-18);13C-NMR (75 MHz, CDCl3) δ: 138.9 (C-9), 130.9 (C-25), 130.0 (C-8), 125.2 (C-24), 77.0 (C-2), 74.8 (C-3), 73.8 (C-1), 50.3 (C-17), 50.1 (C-14), 44.5 (C-13), 42.2 (C-10), 39.8 (C-5), 36.4 (C-20), 36.3 (C-22), 36.2 (C-4), 30.8 (C-16), 30.7 (C-15), 28.0 (C-7), 25.7 (C-23), 25.7 (C-26), 25.0 (C-19), 24.9 (C-12), 21.4 (C-11), 19.9 (C-6), 18.6 (C-21), 18.5 (C-28), 17.6 (C-27), 15.7 (C-18), 14.9 (C-30)。以上数据与文献报道[18]对照基本一致,确定化合物10为29-降羊毛脂-8, 24-二烯-1α, 2α, 3β-三醇。
化合物11:无色簇晶(甲醇),10%硫酸乙醇溶液显色呈黄色,Molish反应阳性。1H-NMR (300 MHz, DMSO-d6) δ: 4.69 (1H, d, J=5.4 Hz, 4′-OH), 4.67 (1H, d, J=4.2 Hz, 2′-OH), 4.52 (1H, brs, H-1′), 4.49 (1H, m, 4-OH), 4.47 (1H, m, 3-OH), 4.21 (1H, d, J=5.1 Hz, 2-OH), 4.19 (1H, d, J=4.8 Hz, 3′-OH), 3.61 (1H, m, H-3), 3.57 (1H, m, H-2′), 3.47 (1H, m, H-2), 3.43 (1H, m, H-4), 3.38 (3H, m, H2-1, H-5′), 3.18 (1H, m, H-3′), 3.16 (1H, m, H-4′), 1.33 (2H, m, H-5), 1.28 (2H, m, H-6), 1.23 (22H, m, H-7~17), 1.10 (3H, d, J=6.0 Hz, H-6′), 0.84 (3H, t, J=6.5 Hz, H-18);13C-NMR (75 MHz, DMSO-d6) δ: 100.4 (C-1′), 73.0 (C-3′), 72.1 (C-4′), 71.1 (C-2′), 70.7 (C-4), 70.6 (C-1), 70.2 (C-3), 68.7 (C-5′), 68.5 (C-2), 33.2 (C-6), 31.4 (C-16), 29.3 (C-7), 29.2 (C-8~14), 28.8 (C-15), 25.5 (C-5), 22.2 (C-17), 18.0 (C-6′), 14.1 (C-18)。以上数据与文献报道[15]对照基本一致,确定化合物11为十八烷-1, 2S, 3S, 4R-四醇-1-O-α-L-吡喃鼠李糖苷。
4 体外抗肿瘤活性通过MTT方法[19]检测化合物对PC-3细胞的生长抑制活性,以5-氟尿嘧啶为阳性对照药(IC50值为22.31 μmol/L)。PC-3细胞培养于含有10%经加热灭活的胎牛血清、100 U/mL青霉素、100 μg/mL链霉素及1 mmol/L L-谷氨酰胺RPMI 1640培养液中,37 ℃、5% CO2饱和湿度培养箱中孵育至对数生长期。收集对数生长期PC-3细胞,以2×103个细胞/孔接种于96孔板,使其贴壁24 h后,加入不同浓度受试药物于37 ℃继续培养4 d。然后每孔加入50 μL 2 mg/mL MTT溶液于37 ℃孵育4 h后,弃去上清液,每孔加入200 μL DMSO,室温振荡10 min后,在酶标仪570 nm处测量每个孔的吸光度值。以未加入受试药物的吸光度值作对照来计算药物对PC-3细胞的生长抑制率。
实验结果显示,化合物8、10和11的IC50值分别为37.4、26.18、37.12 μmol/L,具有中等强度抑制PC-3细胞增殖的活性;化合物1~7、9对肿瘤细胞增殖无抑制活性。
| [1] | 南京中医药大学. 中药大辞典 (上册)[M]. 上海: 上海科学技术出版社, 2006. |
| [2] | 万文珠, 娄红祥. 没药的化学成分和药理作用[J]. 国外医药:植物药分册, 2005, 20(6):236–241. |
| [3] | 韩淑芬, 金仲品. 没药的药理活性研究进展[J]. 时珍国医国药, 2008, 19(6):1502–1503. |
| [4] | Rao R M, Khan Z A, Shah A H. Toxicity studies in mice of Commiphora molmol oleo-gum-resin[J]. J Ethnopharmacol, 2001, 76(2): 151–154. DOI:10.1016/S0378-8741(01)00189-1 |
| [5] | 韩璐, 孙甲友, 周丽, 等. 没药化学成分和药理作用研究进展[J]. 亚太传统医药, 2015, 11(3):38–41. |
| [6] | 杨国春, 李占林, 李文, 等. 没药中一呋喃倍半萜的核磁共振研究[J]. 波谱学杂志, 2008, 25(4):540–548. |
| [7] | Zhao N, Yang G C, Li D H, et al. Two new sesquiterpenes from myrrh[J]. Helv Chim Acta, 2015, 98(9): 1332–1336. DOI:10.1002/hlca.v98.9 |
| [8] | Zhu N, Sheng S, Sang S, et al. Isolation and characterization of several aromatic sesquiterpenes from Commiphora myrrha[J]. Flavour Fragr J, 2003, 18(4): 282–285. DOI:10.1002/(ISSN)1099-1026 |
| [9] | Wu B, He S, Wu X D, et al. Cadinane and eudesmane sesquiterpenoids from Chloranthus henryi[J]. Helv Chim Acta, 2007, 90(8): 1586–1592. DOI:10.1002/(ISSN)1522-2675 |
| [10] | Dekebo A, Dagne E, Sterner O. Furanosesquiterpenes from Commiphora sphaerocarpa and related adulterants of true myrrh[J]. Fitoterapia, 2002, 73(1): 48–55. DOI:10.1016/S0367-326X(01)00367-7 |
| [11] | Peng G P, Tian G, Huang X F, et al. Guaiane-type sesquiterpenoids from Alisma orientalis[J]. Phytochemistry, 2003, 63(8): 877–881. DOI:10.1016/S0031-9422(03)00222-X |
| [12] | Sayed K A E, Hamann M T. A new norcembranoid dimer from the red sea soft coral Sinularia gardineri[J]. J Nat Prod, 1996, 59(7): 687–689. DOI:10.1021/np960207z |
| [13] | Evens F E, Miller D W, Gairns T, et al. Structure analysis of proximadiol (cryptomeridiol) by 13C-NMR spectroscopy[J]. Phytochemistry, 1982, 21(4): 937–938. DOI:10.1016/0031-9422(82)80097-6 |
| [14] | Locksley H D, Fayez M B E, Radwan A S, et al. Constituents of local plants XXV, constitution of the antispasmodic principle of Cymbopogon proximus[J]. Planta Med, 1982, 45(1): 20–22. |
| [15] | Shen T, Wan W Z, Yuan H Q, et al. Secondary metabolites from Commiphora opobalsamum and their antiproliferative effect on human prostate cancer cells[J]. Phytochemistry, 2007, 68(9): 1331–1337. DOI:10.1016/j.phytochem.2007.01.013 |
| [16] | Su S L, Duan J A, Tang Y P, et al. Isolation and biological activities of neomyrrhaol and other terpenes from the resin of Commiphora myrrha[J]. Planta Med, 2009, 75(4): 351–355. DOI:10.1055/s-0028-1112214 |
| [17] | Shen T, Yuan H Q, Wan W Z, et al. Cycloartane-type triterpenoids from the resinous exudates of Commiphora opobalsamum[J]. J Nat Prod, 2008, 71(1): 81–86. DOI:10.1021/np070442p |
| [18] | Provan G J, Waterman P G. Chemistry of the Burseraceae. Major triterpenes from the resins of Commiphora incisa and C. kua and their potential chemotaxonomic significance[J]. Phytochemistry, 1988, 27(12): 3841–3843. DOI:10.1016/0031-9422(88)83028-0 |
| [19] | Mosmann T. Rapid colorimetric assay for cellular growth and survival:Application to proliferation and cytotoxicity assays[J]. J Immunol Methods, 1983, 65(1/2): 55–63. |
 2017, Vol. 48
2017, Vol. 48


