2. 中国医学科学院 北京协和医学院药物研究所, 北京 100050
2. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
一味中药具有多种功能,可主治不同病证,是中药的普遍现象和特色。古代徐灵胎早已发现了中药的“一药多效”的特点,在《医学源流注》中言:“然一药不止一方用之,他方用之亦效,何也?盖药之功用,不止一端,在此方,则取其此长,在彼方,则取其彼长”[1]。众多的临床中医师也发现,中药的功效往往显现出多样化作用,在具体临证处方中,大多是取其一部分功效和作用,而非全部,即方剂中的药物具有作用方向的选择性,而调控中药的选择性作用是通过配伍、剂量控制、剂型选择、煎服调护以及方证对应等方法实现[2-3],由此创立和积累了数以万计的临床有效中医方剂,为我国的药物研发提供了宝贵资源。然而,中医学家在临床实践中发现某一药在某方中所表现的“长”就是“功效”,药物学家则应回答这些“所长的功效”由什么物质实现的?怎样实现的?笔者将这些“所长的功效物质”命名为“定向药效成分(oriented effective components)”,即多效中药在不同的配伍环境下针对不同病证所表现的功能不同,其所含化学成分可能并非全部发挥作用,而是部分显现出定向有效性。发现并准确辨识多效中药的定向功效成分对提高复方中药质量可控性意义重大,也是组分中药研发的基础,但更需要科学可行的研究策略。
1 多效中药定向药效成分的研究策略 1.1 研究前提--以适宜病症的方剂为研究对象开展比较分析由于多效中药的定向功效成分是在配伍环境下针对病证显现的,故研究对象应是方剂而不是饮片,在适宜的病证中研究。此研究前提与王喜军教授关于中药药效物质基础研究的观点一致,即中药药效物质基础研究应该从方剂入手,饮片中含有的只是化学成分,只有在一定的方剂配伍环境下才能表达药效成分,同一种药在不同配伍环境下在体内表达不同的直接作用物质,从而实现药效的配伍取向。
关黄柏在单独给药及在知柏地黄丸方剂配伍环境下药物在体内的成分有较大差异,在方剂配伍条件下关黄柏体内以黄柏内酯(obaculactone)、黄柏酮(obacunone)、木兰碱(magnoline)及相关的代谢产物为主,而非关黄柏质控的指标成分小檗碱(berberine)及巴马汀(palmatine)[4]。
第2个研究前提是比较分析同一多效中药针对不同病证配伍组成的不同方剂,才能明确定向功效成分的差异化表达。如柴胡具有3个功效,和解退热、疏肝解郁、升举阳气,以君药配伍的2个方剂“柴葛解肌汤”和“逍遥散”为代表,所发挥的功效不同,其定向功效成分也存在差异。在柴葛解肌汤中,与黄芩配伍共为君药,一透解表热,一清泄里热,合之解肌解热。高琳等[5]发现柴胡-黄芩水煎液中所含的各类化学成分群在解热效用方面存在作用差异,柴胡-黄芩中所含的挥发油--黄酮类化学成分群很可能为其重要解热物质基础,此方中柴胡挥发油是解表退热功效的物质基础。而在逍遥散中君药柴胡与白芍、当归配伍,补肝体而助肝用,共用柔肝解郁,此方中柴胡发挥的主要是疏肝解郁。黄萍[6]研究指出,柴胡总皂苷能明显降低血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)的量,显著升高血清白蛋白(ALB)的量,能明显降低血清透明质酸酶(HA)、层粘连蛋白(LN)、前胶原(PC)的量,可抑制胶原纤维的形成,具有保护肝细胞、抗肝纤维化的作用,故柴胡总皂苷是柴胡在逍遥散中发挥疏肝解郁的功效成分之一。本课题组多年致力于逍遥散抗抑郁研究,通过谱-效相关分析证实了柴胡中的皂苷类成分与抗抑郁有显著的相关性,还通过逍遥散的溶剂分离与体内药物分析,发现并首次报道了柴胡中的多炔类成分具有明显的抗抑郁活性[7]。刘佳丽等[8]研究表明柴胡在逍遥散中发挥疏肝解郁的定向功效成分是皂苷类和多炔类。
由此可见,研究多效中药的定向功效成分应从方剂入手,且该多效中药在方剂中处于君药地位,并比较不同方剂在不同病证中的功效成分的差异性,以此作为研究前提。
1.2 研究步骤--拆分配伍药物的体内逆向分析与功效验证 1.2.1 体内逆向分析,发现进入体内的药物原型及代谢产物通常情况下,血清药物化学是以药物口服给药后的血清为研究对象,综合应用多种现代技术,分离、鉴定含药血清中药源性成分及其代谢物,能够表征口服中药后血中成分的消除特点,阐释体内直接作用物质间的相互关系[9]。然而血清中的药物及其代谢产物的量较少,且处于动态变化中,因而富集困难且成本高。而尿液、粪便等是终端代谢产物,具有无损可累积性。所以选择从尿液或粪便入手,采用多种代谢产物识别检测方法(薄层色谱示差法、HPLC-UV/DAD/ELSD等)对比空白对照组和含药组的生物样本以及受试药物的色谱行为,以发现中药的原型药物与代谢产物[10-11],最后借助系统溶剂萃取和组合色谱法分离富集这些代谢产物,根据其理化性质及波谱学方法进行结构鉴定。这种方法能切实体现化学成分的体内生物转化(机体对药物的作用),以及成分之间的相互作用。
1.2.2 拆分配伍药物,归属被研究药物进入体内的成分首先,以单味药、全方及缺该单味药的阴性方干预受试动物,通过比较三者的药效差异,确定该单味药对复方药效的重要贡献作用;其次,采用超高效液相色谱(UPLC)法分析比较上述全方、各单味药以及缺各单味药的阴性方的指纹图谱,归属体外复方中化学成分的来源,阐释配伍对中药化学成分(溶出增加或减少甚至消失或是产生新的化合物)的影响;最后,利用色谱与质谱联用的多维分离分析技术,表征收集到的上述动物体液(血清、尿液、胆汁)中的化学成分,通过比较含单味药与复方的体液中的多成分化学指纹谱,探讨复方中其他药味对该中药进入体内的化学成分的影响;通过比较含阴性方和复方的体液中的多成分化学指纹谱,探讨单味中药对复方中其他药味进入体内化学成分的影响。与此同时,还可通过拆分配伍药物,采用肠道菌群代谢、肠吸收和肝微粒体酶生物转化等体外方法,模拟被研药物的药源性成分及其代谢物的体内过程,为归属被研药物进入体内的成分提供辅助作用[12]。
1.2.3 比较不同定向功效成分,发现中药不同功效成分的异同性将2个或以上的方剂所归属的被研中药定向功效成分群进行比较,可找出同一中药在针对不同病证的不同方剂中显现出各自的定向功效物质。
1.2.4 敲出功效成分的阴性方剂与复方药效学比较,验证被研中药功效成分的准确性[13]依据所发现定向功效成分的理化性质,进行分离敲出,将敲出成分后剩余的中药再与方剂其他药味配伍构成阴性方剂,与全复方进行药效学实验,考察传统药效指标与代谢组学指标,以明确所发现的功效成分是否与功效相关。具体步骤见图 1。
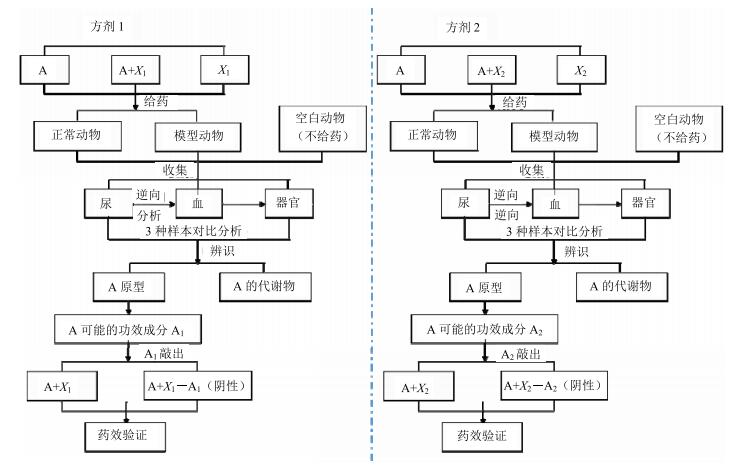
|
A为被研中药,X1和X2分别为方剂1和2的其他药物的总称,A1(方剂1)和A2(方剂2)为A可能的功效成分 A is investigated herb, X1 and X2 are generic terms of other single herbs, A1 (formula 1) and A2 (formula 2) are potential effective components 图 1 研究步骤示意图 Fig.1 Schematic diagram of research concrete step |
1.3 关键技术--代谢组学与药物解析技术 1.3.1 代谢组学技术是寻找差异性的有力工具
在药物代谢组学中,利用NMR、LC-MS、GC-MS表征的信息,通过强大的多元统计分析,找出各类样本的差异成分,从而进行药物成分的归属与溯源,明确药物的原型和代谢产物。例如,空白尿样与含药尿样的多元统计分析,可将进入机体的药物成分与非药物成分分开;比较全方与单味药以及阴性方剂的尿液样本,可将全方中的中药药物成分归属到被研单味药中。王喜军课题组利用该技术在茵陈蒿汤的研究中获得了许多重要发现[14-15];本课题组从逍遥散中发现了19个成分,其中16个为来自药材的原型,3个为代谢物[16-17]。在病证代谢组学中,可利用实验动物内源性代谢产物的整体变化表征机体的生理或病理状态,再通过差异代谢物的发掘,寻找到与疾病相关的潜在代谢标志物,以此为指标观测药物干预的整体疗效。
1.3.2 基于核磁与质谱的解析技术是药物化学结构确证的关键核磁光谱与质谱是化合物结构确认的关键,但在混合样本与微量情况下,确认中药中的天然产物结构非常困难。色谱与质谱联用,以及色谱与核磁光谱联用是现代分析仪器发展的结果,对于从代谢组学中筛出的潜在功效成分的化学确证,将提供有力的技术支撑。
孔宏伟等[18]从质谱、代谢物分子结构式判别、数据库及谱图检索,以及计算机辅助谱图解析等方面,综述了基于液相色谱-质谱联用的代谢产物结构鉴定进展,针对常规代谢产物与难以区分的同分异构体分子,提出2种鉴定流程。其中,常规代谢物鉴定获取候选分子结构的方式有2种:一种是直接采用获得的分子离子峰和二级质谱信息进行谱图库检索;另一种是首先进行化合物元素组成判定,再基于获取的元素组成进行数据库检索。然后通过标准物质验证,最终获得准确的定性结果。而针对同分异构体,则构建了基于微型制备、保留指数、质谱、核磁等的集成技术流程。但目前可购买到的标准物质仅有5 000种左右,包括1 100种内源性的核心代谢物,1 200种美国FDA批准的药物,1 300种美国FDA批准的食品添加剂,1 500种植物化学或植物次生代谢物。但生物体的代谢物数量尚无定论,数据从1 000到20 000不等,构建药物代谢产物数据库并实现共享,发展更为全面的谱图树和碎片树,是解决化合物解析的方向。
2 多效中药定向功效成分的研究意义主要有3方面意义:解决质控指标与药效关联问题,合理评价药用植物资源,为中成药生产和临床用药选择适宜的原料提供依据;从化学分子水平上诠释方剂的配伍规律;构建从方剂入手到组方药味定向功效成分辨析的方法,为组分中药创制提供依据。
2.1 准确评控多效中药质量目前,《中国药典》和许多国家植物药(或中药)药典都采用检测1个或几个化学成分的量,专属性控制中药材和饮片的质量,并用以评价其有效性。笔者在黄芪质量研究中发现,《中国药典》规定的指标性成分黄芪甲苷,对同一产地,在生长年限较短的一年生和两年生移栽芪中的量远高于生长年限在6年以上的传统芪[19],导致低成本移栽芪成为市场的主流商品,而现有研究资料并不能给临床医生和商品市场提供有力的证据,即不能阐释黄芪发挥不同功能的药效成分是什么,不明确市售的什么品规商品能达到具体功效的用药要求?当阐明了多效中药黄芪的定向功效成分后,就能针对不同功能选择指标成分的种类,确定含量,即建立基于药效成分(群)的中药质量控制方法,这与李萍课题组以“等效成分群”为标示量的中药质量控制体系的构建思路[20-21]不谋而合。同时,可依据药效成分的量与质建立不同商品药材品规(规格等级)标准,为中成药生产和临床用药选择适宜的原料提供依据。同样,知柏地黄丸中黄柏质量控制指标成分就应放弃小檗碱和巴马汀,改为控制黄柏内酯黄柏酮、木兰碱等功效成分,才更体现黄柏在知柏地黄丸中的特点。
2.2 诠释中药在方剂中具有选择性功效取向(配伍规律)的内涵通过比较分析单味药与方剂进入体内的化学成分,可阐明该中药在方剂中并非所含的全部化学成分都发挥了作用,而是部分成分显现出有效性;通过比较中药在不同方剂中功效成分的差异性,能回答徐灵胎“在此方则此长,在彼方则彼长”的“此与彼”是什么物质的问题,进一步的药效学验证与药理机制揭示,将回答这些功效成分是否具有药理上的优势,以及怎样发挥作用的。除此之外,还能分析中药与其他药的配伍相互影响,即其他药对该中药在体内成分的影响规律,通过药效强弱的表达,分析和证实该中药在方剂配伍中所处的君、臣、佐、使的地位。
2.3 构建多效中药定向功效成分研究的系统方法体系本课题组以黄芪的多效性研究为例,选张仲景的经方黄芪建中汤和防己黄芪汤为代表方剂,以期辨识出黄芪显现“补气-补益”与“利水-驱邪”2种功能的定向药效成分。其中黄芪建中汤由黄芪、桂枝、白芍、生姜、炙甘草、大枣、饴糖7味药组成,病理模型采用慢性萎缩性胃炎大鼠模型,观测指标包括经典的药效学指标(胃体病理组织切片、胃蛋白酶活性、木糖排泄系数、SIgA免疫因子等生化指标)[22-23],以及代谢组学指标[24]。防己黄芪汤由黄芪、防己、白术、甘草、生姜、大枣6味药组成,病理模型采用阿霉素肾病大鼠模型,观测指标包括经典的药效学指标,如24 h尿蛋白定量、肾小球滤过率、肾组织病理切片、血清生化(肌酐和尿素氮)等[25-27],以及代谢组学指标[28]。上述2个方剂分别寻找出黄芪针对不同病症发挥不同药效的功能成分,然后,将2种功能的药效成分进行对比分析,阐释各自的作用机制。最后,采用敲入-敲出法制备是否含药效成分的“阳”和“阴”性方,通过与全复方药效比较,以验证黄芪定向成分的准确性。系统方法体系的构建见图 2。
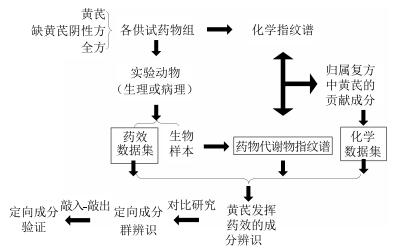
|
图 2 多效中药定向功效成分研究的系统方法体系示意图 Fig.2 Diagram of scientific method for study of oriented effective components of multi-effect CMM |
3 结语
多效中药的定向功效成分研究问题复杂,将中药放在方剂中从体内代谢成分入手是研究的前提,代谢组学技术用于系统寻找差异性并提取特征信息是有力的工具,多种联用分析技术从局部解析化学结构发挥关键作用,两类技术的结合,加上药效学评价,综合辨识出定向功效成分。该研究思路和策略是中药药效物质基础研究的尝试,需要在探索中不断创新和完善。
| [1] | 徐大椿. 醫學源流論[M]. 北京: 人民卫生出版社, 2015. |
| [2] | 于彩娜, 范颖. 方剂中中药选择性发挥作用的影响因素[J]. 中国中医基础医学杂志, 2012, 18(4):439–440. |
| [3] | 常惟智. 影响中药功效及作用方向选择性之相关因素探析[J]. 中医药学报, 2005, 33(2):12–13. |
| [4] | 王喜军, 张宁, 孙晖. 六味地黄丸及其类方血中移行成分的比较研究[J]. 中国中药杂志, 2008, 33(15):1881–1884. |
| [5] | 高琳, 李庆业. 柴胡-黄芩水煎液及其挥发油与黄酮类化学成分群配伍的解热比较作用研究[J]. 成都中医药大学学报, 2009, 32(2):60–62. |
| [6] | 黄萍. 柴胡总皂苷对CCl4诱导的大鼠肝纤维化的保护作用[J]. 中国医药导报, 2009, 6(5):43–44. |
| [7] | 贾广成.逍遥散抗抑郁有效部位配伍的谱效关系研究[D].太原:山西大学, 2012. |
| [8] | 刘佳丽, 杨岚, 崔杰, 等. 基于UPLC-PDA法逍遥散乙醇提取物的石油醚萃取物血清药物化学初探[J]. 中草药, 2013, 44(20):2816–2822. |
| [9] | 王喜军. 基于药物代谢组学的中药及方剂中组分间协同增效作用[J]. 中国天然药物, 2009, 7(2):90–94. |
| [10] | 杨秀伟. 基于体内过程的中药有效成分和有效效应物质的发现策略[J]. 中国中药杂志, 2007, 32(5):365–370. |
| [11] | 邱峰, 姚新生. 中药体内直接物质基础研究的新思路[J]. 中药药理与临床, 1999, 15(3):1–2. |
| [12] | 高燕, 何少明. 基于体内过程的民族药药效物质基础研究进展[J]. 亚太传统医药, 2016, 12(6):16–18. |
| [13] | Song H P, Wu S Q, Qi L W, et al. A strategy for screening active lead compounds and functional compound combinations from herbal medicines based on pharmacophore filtering and knockout/knockin chromatography[J]. J Chromatogr A, 2016, 1456: 176–186. DOI:10.1016/j.chroma.2016.06.009 |
| [14] | Wang X J, Sun W, Sun H, et al. Analysis of the constituents in the rat plasma after oral administration of Yin Chen Hao Tang by UPLC/Q-TOF-MS/MS[J]. J Pharm Biomed Anal, 2008, 46(3): 477–490. DOI:10.1016/j.jpba.2007.11.014 |
| [15] | Wang X J, Sun H, Zhang A, et al. Pharmacokinetics screening for multi-components absorbed in the rat plasma after oral administration traditional Chinese medicine formula Yin-Chen-Hao-Tang by ultra performance liquid chromatography-electrospray ionization/quadrupole-time-of-flight mass spectrometry combined with pattern recognition methods[J]. Analyst, 2011, 136(23): 5068–5076. DOI:10.1039/c1an15752c |
| [16] | Zhou Y, Ren Y, Ma Z, et al. Identification and quantification of the major volatile constituents in antidepressant active fraction of xiaoyaosan by gas chromatography-mass spectrometry[J]. J Ethnopharmacol, 2012, 141(1): 187–192. DOI:10.1016/j.jep.2012.02.018 |
| [17] | 刘佳丽.逍遥散抗抑郁有效部位的PK-PD结合研究[D].太原:山西大学, 2014. |
| [18] | 孔宏伟, 戴伟东, 许国旺. 基于液相色谱-质谱联用的代谢组学研究中代谢物的结构鉴定进展[J]. 色谱, 2014, 32(10):1052–1057. |
| [19] | 熊一峰, 秦雪梅, 李科, 等. 从黄芪化学成分测定分析药材商品品规的合理性[J]. 中草药, 2016, 47(12):2194–2198. |
| [20] | 杨华, 齐炼文, 李会军, 等. 以"等效成分群"为标示量的中药质量控制体系的构建[J]. 世界科学技术--中医药现代化, 2014, 16(3):510–513. |
| [21] | Liu P, Yang H, Long F, et al. Bioactive equivalence of combinatorial components identified in screening of an herbal medicine[J]. Pharm Res, 2014, 31(7): 1788–1800. DOI:10.1007/s11095-013-1283-1 |
| [22] | Hamashima C. Current issues and future perspectives of gastric cancer screening[J]. World J Gastroenterol, 2014, 20(38): 13767–13774. DOI:10.3748/wjg.v20.i38.13767 |
| [23] | Di Mario F, Rugge M, Cavestro G M, et al. Usefulness of serum pepsinogens to identify chronic atrophic gastritis[J]. Gastroenterology, 2011, 140(5): S115–S264. |
| [24] | Cui J, Liu Y, Hu Y, et al. NMR-based metabonomics and correlation analysis reveal potential biomarkers associated with chronic atrophic gastritis[J]. J Pharm Biomed Anal, 2017, 132: 77–86. DOI:10.1016/j.jpba.2016.09.044 |
| [25] | 王闻婧.防己黄芪汤对肾小球滤过屏障的保护作用研究[D].哈尔滨:黑龙江中医药大学, 2014. |
| [26] | Fan H Y, Yang M Y, Qi D, et al. Salvianolic acid A as a multifunctional agent ameliorates doxorubicin-induced nephropathy in rats[J]. Sci Rep, 2015. DOI:10.1038/srep12273 |
| [27] | Pereira W F, Brito-Melo G E, de Almeida C A, et al. The experimental model of nephrotic syndrome induced by Doxorubicin in rodents:an update[J]. Inflamm Res, 2015, 64(5): 287–301. DOI:10.1007/s00011-015-0813-1 |
| [28] | Park J C, Hong Y S, Joo Kim Y, et al. A metabonomic study on the biochemical effects of doxorubicin in rats using 1H-NMR spectroscopy[J]. J Toxicol Envir Health A, 2009, 72(6): 374–384. DOI:10.1080/15287390802647195 |
 2017, Vol. 48
2017, Vol. 48


