2. 天士力控股集团有限公司, 天津 300402
2. Tasly Holding Group Co., Ltd., Tianjin 300402, China
药品说明书是指导患者科学、合理、准确用药的主要信息来源,其准确性和科学性直接影响患者的治疗效果和用药安全。目前,我国在《药品管理法》《中国药品通用名称命名原则》《药品商品名称命名原则》和《药品说明书和标签管理规定》[1]等一系列法律法规中,均规定了药品说明书的完整性和规范性。欧美国家在此基础上还要求药品申请者提交药品说明书可读性测试结果,并出台相关法规指南予以规范。根据欧盟颁布的《人用药品包装说明书和标签可读性指导原则》,药品说明书可读性[2]是指药品说明书和标签阅读者对该药品说明书和标签阅读和理解的难易程度。药品说明书的可读性越强,越能够指导更多患者更加合理、安全地用药。
欧盟关于药品说明书可读性测试的规定,源于1998年颁布的《人用药品包装说明书可读性指导原则》,该指导原则首次提出了关于药品说明书可读性测试的管理要求,并提供了研究指南。2001年,欧盟综合性药品指令《2001/83/EC》进一步明确要求药品申请上市时必须提交药品说明书的可读性测试结果[3]。2006年颁布了《人用药品包装说明书可读性测试指南》[4],并在2009年1月12日,更新公布为《人用药品标签和包装说明书可读性指南》(Guideline on the readability of the labeling and package leaflet of medicinal products for human use)(以下简称“指南”)[5],该指南规定了药品说明书可读性测试开展的方法、程序和通过标准等。
本文以丹参胶囊产品欧盟国家注册过程提交的药品说明书可读性测试研究为例,对欧盟药品可读性测试研究的技术要求和研究过程进行分析和阐述,以期为我国开展药品说明书可读性测试提供借鉴。
1 欧盟药品说明书可读性测试基本技术要求根据指南,开展药品说明书可读性测试是为了确保说明书中的信息能够被读者正确理解,旨在确保公众安全合理用药。
1.1 研究涵盖范围① 首次批准的具有新活性成分的药品;②法律地位发生变化的药品,如处方药转为非处方药的申请以及药品新增适应症和陈述性说明的情况;③变更药品包装,主要针对药品内包装和说明书的变更;④具有重大安全问题的药品,主要针对新增药品不良反应、安全性警示说明或黑框标识内容。无论药品申报者选择集中型、分散型还是成员国型程序递交申报资料,以上范围均适用。
1.2 研究过程 1.2.1 研究机构选择为保证研究过程的客观性,欧盟国家的药品申请者一般选择第3方机构来完成说明书可读性测试研究。
1.2.2 受试者筛选基于适应症和用药人群的不同,受试者应该选择年龄在18~63岁,不同性别和教育程度,最有可能用药的,针对适应症具有代表性的人群(如妇科用药应选择适龄妇女)等;应选择不常使用药品、生活中不从事文案撰写工作、非医学专业且6个月内没有参加过可读性测试的受试者。
1.2.3 测试步骤为了让20名受试者无重复测试,且能使说明书可读性测试结果令人满意,建议使用少数人群依次进行测试,即先由3~6名测试者进行问题测试,如果测试可行,根据测试经验再由2或3人进行小范围测试,也可以直接进入主要测试阶段;根据受试者在测试过程中的反馈对说明书进行必要的修订,通过10名受试者测试过程中的反馈得到满意的说明书版本,再由剩余10名受试者完成对此版本说明书的可读性测试。
1.2.4 测试准备进一步确认测试程序、测试机构、测试人员以及测试问题。
1.3 通过标准根据指南要求,如果90%的受试者能够从说明书中获取到需要的信息,且在此基础上,再有90%的人能够理解其中的含义,此说明书可读性基本符合要求。例如,10名受试者中应有8人能够从说明书中获得并正确理解需要的信息,且通过的标准应细化到每一个问题上,即每一个问题都应有8人最终通过。使用不同的研究方法,通过的标准也是不同的,研究机构应该根据不同情况选择不同的标准。
本文以丹参胶囊产品欧盟国家注册过程提交的药品说明书可读性测试研究为例,详细阐述欧盟关于药品说明书可读性测试研究的要求和特点。
2 丹参胶囊的可读性测试研究本研究由第3方专业机构执行,所有受试者由第3方机构提供。
2.1 研究目的(1) 评估药品说明书可读性,包括总体评论;(2)发现不利于阅读者理解及获取信息的内容;(3)提高药品说明书可读性。
2.2 通过标准研究预设的通过标准与欧盟现行可读性测试指导原则一致,即“20个测试者里应有16人能正确回答问题”。
2.3 研究过程药品说明书的可读性测试分为2轮进行。反映说明书的主要内容制定的受试者的问卷总共包含13个问题。问卷开始前,记录受试者对于药品说明书的总体评论。问卷过程中,记录受试者回答问题过程中的言论和行为,并作为评估说明书可读性的参考标准。根据预设通过标准判定测试结果。
2.3.1 实验设计(1) 第1轮测试:完成10名受试者的面对面问卷调查;(2)结果测评:若测试结果不满足通过标准,则需修订说明书;(3)第2轮测试:完成另外10名受试者的面对面问卷调查,评估说明书修订后的效果;(4)若第2轮测试结果显示说明书仍需改进,再次修订说明书。
2.3.2 受试人群受试人群选择标准:年龄在18~63岁、不同性别和教育程度、非医学专业、6个月内没有参加过可读性测试,多数受试者应不常使用药品且不从事文案撰写工作。受试人群情况见表 1。
|
|
表 1 受试人群情况 Table 1 Situation of subject population |
2.3.3 访谈过程
每个受试者将收到1份产品说明书并阅读。随后,通过问卷调查评估受试者是否能找出并理解特定信息。回答问题过程中,允许和鼓励受试者在说明书中寻找答案。每个受试者访谈时间为20 min。反映说明书的主要内容的受试者的问卷总共包含13个问题,主要用来评估受试者对说明书基本信息的查找、理解和使用能力。
调查问卷问题包括药物的适应症、禁忌症、日服用量、副作用、贮存、警示信息等内容。
2.3.4 测试评估所有受试者的回答会从2方面进行评估:(1)评估受试者是否能够快速找到特定信息,记录受试者寻找说明书中相关信息具体位置的时间。(2)评估受试者是否能够正确理解特定信息,要求受试者用自己的语言说出答案。如果受试者按照说明书逐字读出来,那么要求受试者把读过的内容重新用自己的语言再说一遍,只有两者相近时,受试者的回答才被认为是正确的。受试者的回答以1~5分来评估,评分标准见表 2。
|
|
表 2 评分标准 Table 2 Scale rules |
每轮测试结束后,根据上面提到的5分量表,对以上2个评估项中的每项都要进行单独评估。如果每组受试者中有8名受试者能准确定位并理解正
确答案,则视为满足通过标准。如果8名以上受试者都能正确地回答问题,那么对应的说明书部分不需要做修改。
以上研究由于测试群体样本较小,研究结果只是象征性而非具有代表性统计学意义。
2.4 测试结果 2.4.1 受试者总体印象访谈之初,读完说明书后,大多数受试者认为产品说明书文本清晰易懂。
图 1显示在2轮测试后受试者对说明书字体、字号与分类的意见,“1”表示非常不好,“10”表示非常好。
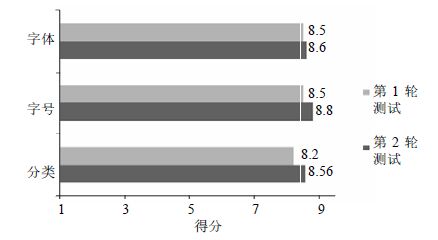
|
图 1 2轮测试受试者对字体、字号与分类意见的统计 Fig.1 Statistics of opinions of subject population on font type,font size,and division of categories in two cycles of testing |
2.4.2 调查问卷测试结果
如果某一问题回答正确的受试者人数比例未达到80%,则药品说明书相关文本需要重新修订。在第1轮和第2轮测试中,受试者均能正确理解并答复访谈中提出的与药品基本使用信息有关的13项问题,且正确率在100%。研究表明大多数潜在使用人群能追溯、理解和应用药品说明书上的信息,所以本次测试的结论符合欧盟指令《2001/83/EC》、《Directive 2004/27/EC》以及欧盟可读性测试指导原则。
3 结语欧盟法规对于药品说明书可读性测试的要求在很大程度上防止和规避了由于患者对药品的不当理解和误用所造成的药害事件,也证明了欧盟重视患者的用药体验,体现了欧盟高度的人性化的服务理念,这是一项非常科学的药品监督和管理制度。
目前,我国还没有系统全面的药品说明书评定准则,尤其在患者可读性研究方面缺乏足够的指南规范和指导意见,这不仅导致药品生产企业在制定药品说明书时缺少依据,也给患者安全、科学、有效用药埋下了隐患。因此,通过借鉴国外经验,制定符合我国国情及药品审评原则的说明书可读性测试指导原则和法规,用以保障药品说明书的客观性、合理性及保证用药安全,是中国药品研发国际化发展趋势。
| [1] | 药品说明书和标签管理规定[S]. 2006. |
| [2] | 赵智恒. 欧盟药品说明书可读性指导原则简介与启示[J]. 中国药物警戒, 2012, 9(4):207–210. |
| [3] | European Commission. Pharmaceutical legislation medicinal products for human use. Directives 2001/83/EC[S]. 2001. |
| [4] | European Commission. Guidance concerning consultations with target patient groups for the package leaflet[S]. 2006. |
| [5] | European Commission. Guideline on the readability of the labeling and package leaflet of medicinal products for human use, ENTR/F/2/SF/jr(2009)D/869[S]. 2009. |
 2017, Vol. 48
2017, Vol. 48


