茅苍术Atractylodes lancea (Thunb.) DC. 为菊科多年生草本植物,其根茎具有燥湿健脾、祛风、散寒、明目等功能[1],是江苏省著名道地药材,公认为优质的苍术商品,近年来由于各种人为因素的影响以及自身的生物学特性,种群自身恢复能力较差,其分布区及种群数量呈现明显衰退倾向,已列为江苏省4种濒危药用植物之一[2]。
茅苍术主要活性成分为挥发油,主要包括β-桉叶醇(β-eudesmol)、茅术醇(hinesol)、苍术酮(atractylone)等倍半萜类和苍术素(atractylodin)等聚炔类成分。倍半萜类成分在植物体内主要通过MVA途径合成,法呢基焦磷酸合酶(farnesyl diphosphate synthase,FPPS)是MVA生物合成途径中的关键酶[3-4],催化2个异戊烯基焦磷酸(isopentenyl pyrophosphate,IPP)分子和1个二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate,DMAPP)分子生成法呢基二磷酸(farnesyl diphosphate,FPP)[5-6],FPP为倍半萜类等化合物提供C15骨架。现已有多种编码该酶的基因被克隆[7-12],迄今,茅苍术FPPS基因(AlFPPS)全长的相关信息未见报道。
本研究采用同源克隆法和RACE技术克隆AlFPPS基因的全长,并对AlFPPS基因表达量与倍半萜类成分量进行相关性分析,研究其在茅苍术品质形成过程中的表达规律,为阐明茅苍术倍半萜类成分生物合成途径及其调控机制奠定基础,为利用植物基因工程改善中药材品质提供科学依据。
1 材料茅苍术采自道地产区江苏句容茅山,经南京中医药大学谷巍教授鉴定为菊科植物茅苍术Atractylodes lancea (Thunb.) DC.。茅苍术样品采集选择其生长发育的6个阶段:出芽期(3月15日)、营养生长期(5月15日)、孕蕾期(7月15日)、开花期(9月15日)、结果期(11月15日)及休眠期(12月15日)。取不同生长阶段茅苍术叶片和根茎分装于冻存管中,在液氮中保存备用;并取不同生长阶段茅苍术根茎用于测定苍术酮、茅术醇及β-桉叶醇量。对照品苍术酮(批号 C-084-15814,质量分数大于98%)购于成都瑞芬思生物科技有限公司;茅术醇(批号D1759,质量分数大于98%)购于上海宝曼生物科技有限公司及β-桉叶醇(批号 140626,质量分数大于95%)购于成都普菲得生物技术有限公司。
2 方法 2.1 RNA提取和cDNA合成RNA的提取按照Tiangen公司总RNA提取试剂盒(批号DP419)操作步骤进行,用1.0%琼脂糖凝胶电泳检测,Bio-Rad Gel Doc XR+凝胶成像系统观察拍照,并用Eppendorf 蛋白核酸分析仪检测RNA纯度和浓度。cDNA合成按照Invitrogen公司反转录试剂盒(批号C28025021)操作步骤进行。
2.2 FPPS基因保守区片段的克隆根椐GenBank提供的FPPS同源基因序列,用引物设计软件Primer primer 5.0设计简并引物CF、CR(引物序列见表 1),引物由上海捷瑞生物工程有限公司合成。以反转录后的cDNA为模板进行保守区片段的PCR扩增。在20 μL反应体系中加入10×PCR缓冲液2 μL,dNTP(10 mmol/L)0.5 μL,MgCl2(25 mmol/L)1 μL,rTaq DNA聚合酶2 U,引物(2.5 mmol/L)各1 μL,cDNA模板1 μL。反应条件为94 ℃预变性5 min;94 ℃、30 s,57 ℃、30 s,72 ℃延伸90 s,40个循环;72 ℃延伸10 min。将以上获得的PCR扩增产物经1.0%琼脂糖凝胶电泳后,切胶,纯化回收,进行TA克隆,筛选5个阳性克隆子进行测序,测序由上海生工生物工程有限公司完成。
|
|
表 1 引物序列 Table 1 Primer sequences |
2.3 RACE及全长的扩增
根据FPPS基因保守区片段的测序结果,在其序列内部设计5’RACE和3’RACE特异引物GSP1和GSP2(引物序列见表 1),利用Clontech公司SMARTerTM RACE cDNA Amplification Kit试剂盒扩增该基因的cDNA 5’端和3’端。5’RACE以5’RACE-ready first-strand cDNA为模板,按照BD Advantage2 PCR kit操作,反应条件:95 ℃,5 min;94 ℃、30 s,57 ℃、30 s,68 ℃、90 s,35个循环;68 ℃、5 min;4 ℃ 终止反应。3’RACE以3’RACE-ready first-strand cDNA为模板,反应条件为95 ℃,5 min;94 ℃、30 s,57 ℃、30 s,68 ℃、90 s,35个循环;68 ℃、5 min;4 ℃ 终止反应。根据5’RACE和3’RACE测序结果拼接得到的全长cDNA设计引物QF和QR(引物序列见表 1)进行全长cDNA扩增。引物均由上海捷瑞生物工程有限公司合成。全长扩增以茅苍术cDNA模板,在50 μL反应体系中加入10×PCR缓冲液5 μL,dNTP(10 mmol/L)4 μL,MgCl2(25 mmol/L)4 μL,rTaq DNA聚合酶2 U,引物(2.5 mmol/L)各1 μL,cDNA模板2 μL。反应条件为94 ℃、5 min;94 ℃、30 s,54 ℃、30 s,72 ℃、90 s,35个循环;72 ℃、5 min;4 ℃ 终止反应。产物由上海生工生物工程有限公司进行测序。
2.4 生物信息学分克隆分析将AlFPPS 基因全长序列通过BLAST搜索NCBI 的蛋白质和核苷酸数据库,并通过DNAMAN软件翻译成氨基酸序列,用Clustal W13.0分析软件与其他植物的FPPS氨基酸序列进行比较,根据同源比对结果,选择18种植物的FPPS氨基酸序列用MEGA 5.0的邻位相联法构建进化树并分析。
AlFPPS cDNA的开放阅读框(ORF)查找与相应的氨基酸序列翻译使用ORF Fider,相对分子质量与理论等电点(pI)预测采用ExPASy在线服务器的Compute Pi/Mw 工具,蛋白的理化性质预测采用ExPASy Proteomics Server提供的在线工具Protparam进行分析。利用在线软件SignalP 4.0 Server预测AlFPPS的信号肽,利用Wolfpsort对AlFPPS蛋白的定位信号进行预测,利用在线软件TMHMM预测AlFPPS跨膜区域。二级结构预测使用Dublin大学的Porter服务器,三级结构预测使用Swiss-Model服务器,结构功能域分析采用ExPASy在线服务器的Prosite Scanprosite。
2.5 qRT-PCR分析qRT-PCR反应使用荧光定量PCR仪(ABI7500,USA),以18 S为内参基因(18 SF和18 SR,引物序列见表 1),以不同生长时期茅苍术根茎cDNA为模板,设计荧光定量引物FPPSF和FPPSR(引物序列见表 1)进行PCR扩增,预计扩增产物200 bp左右,检测样品中AlFPPS基因的相对表达量,引物由上海捷瑞公司合成。在20 μL的反应体系中加入Power SYBR Green Master Mix(Applied Biosystems,USA)10 μL,引物各0.4 μL(10 μmol/L),模板 cDNA 2 μL,并设置3个重复。阴性对照用2 μL水代替模板。反应条件:94 ℃、30 s;94 ℃、10 s,60 ℃、12 s,72 ℃、30 s,循环45次,PCR反应结束后分析荧光值变化曲线以及熔解曲线。本实验以茅苍术生长发育的6个阶段的根茎为材料,每个阶段3个生物学重复,同时每个样品设3个技术重复,并设置阴性对照。数据处理采用相对定量法,参照2−ΔΔCt方法进行计算分析。
2.6 GC-MS分析[13] 2.6.1 供试品溶液的制备按《中国药典》2015年版挥发油测定甲法提取苍术挥发油,每个生长阶段做3个生物学重复,所提挥发油用醋酸乙酯定容,作为供试品溶液,0.45 μm滤膜滤过后供GC-MS分析用。
2.6.2 对照品溶液的制备精密称取苍术酮、茅术醇及β-桉叶醇对照品适量,分别置于5 mL量瓶中,醋酸乙酯溶解并定容至刻度,制成质量浓度分别为20.86、10.50、17.86 mg/mL的对照品储备液备用。
2.6.3 GC-MS分析条件Agilent6890N气相色谱仪和5973型质谱联用仪,谱库为NIST98,HP-5MS毛细管色谱柱(30 m×0.25 mm,0.25 μm)。载气为氦气(99.999%);体积流量1 mL/min;进样口温度250 ℃;分流进样,分流比为40∶1;进样量2 μL;柱升温程序:起始40 ℃,保持5 min,以3 ℃/min升温至185 ℃,保持10 min,再以5 ℃/min升温至250 ℃,保持5 min。EI离子源,源温230 ℃,电子能量为70 eV,连接器温度280 ℃,溶剂延迟5 min。扫描范围m/z 33~350,电子倍增器电压为2.4 kV。
2.7 相关性分析使用SPSS 软件对不同生长期茅苍术根茎中AlFPPS基因表达量与苍术酮、茅术醇及β-桉叶醇量进行相关性分析,采用SPSS 18.0软件计算出Pearson相关系数。
3 结果与分析 3.1 总RNA检测结果茅苍术总RNA的1%琼脂糖凝胶电泳结果显示条带清晰完整,28 S RNA条带的亮度约为18 S RNA条带2倍,Eppendorf蛋白核酸分析仪检测结果显示,总RNAA260/A280为1.98,为典型的RNA吸光度值,说明提取的总RNA质量较好,无降解,蛋白质、多糖、酚和无机盐等杂质已排除,可用于后续实验(图 1-A)。
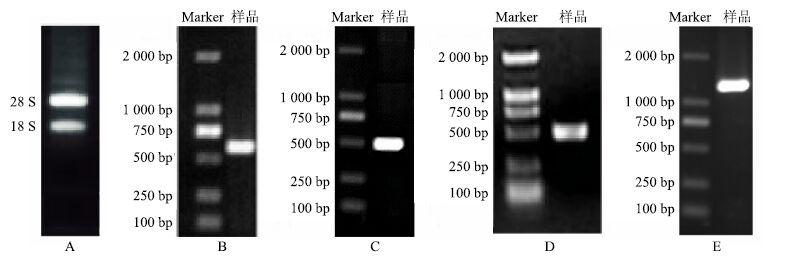
|
图 1 图1 茅苍术总RNA电泳图 (A)、AlFPPS保守区片段 (B)、5’RACE (C)、3’RACE (D) 和AlFPPS全长cDNA (E) 凝胶电泳图 Fig.1 Electropherogram of total RNA (A),AlFPPS conservation fragment (B),5’RACE (C),3’RACE (D),and AlFPPS full-length cDNA (E) from A. lancea |
3.2 AlFPPS基因保守区片段的克隆
以茅苍术叶片总RNA反转录的cDNA为模板,用简并引物扩增得到一条大约600 bp的FPPS基因的特异片段,符合引物设计推断的片段大小(图 1-B)。PCR片段纯化、克隆,经测序后得到其序列,长度为583 bp。
3.3 RACE和AlFPPS全长cDNA序列根据获得的茅苍术FPPS基因保守区序列设计特异引物,进行5’RACE和3’RACE PCR扩增,分别扩增出大约400 bp和500 bp的DNA片段,结果见图 1-C、D。将5’RACE和3’RACE扩增片段克隆测序结果(348 bp和460 bp)与已有保守区片段拼接得到全长cDNA(1 320 bp),将所获得的FPPS基因全长命名为AlFPPS。为了验证全长结果,根据拼接得到的全长序列设计引物,以cDNA为模板,扩增AlFPPS全长序列并测序,测序结果与拼接结果一致(图 1-E)。将AlFPPS核酸序列提交至Genbank数据库,获得的基因登录号为KX443242。
3.4 AlFPPS全长序列生物信息学分析从茅苍术中克隆的AlFPPS基因全长cDNA序列为1 320 bp(图 2),翻译起始点为第86碱基处,终止密码子为TAG,在两端有一个85 bp的5’-UTR和一个206 bp的3’-UTR。包含了一个1 029 bp的完整ORF,编码342个氨基酸的蛋白。使用NCBI Blastx比对,氨基酸序列与三脉紫菀Aster ageratoides Turcz、银胶菊Parthenium hysterophorus L.、向日葵Helianthus annuus L. 等植物的同源性分别达到90%、89%、89%。

|
起始密码子以方框表示,终止密码子以表示,保守功能域以下划线表示 The initiation codon is boxed,asterisk show the termination codon and conserved function motifs are underlined 图 2 AlFPPS基因全长序列及推测的氨基酸序列 Fig.2 Nucleotide and deduced amino acid sequence of AlFPPS full-length cDNA from A. lancea |
3.4.1 AlFPPS理化性质
利用ExPASy Proteomics Server在线软件Protparam对AlFPPS基因编码蛋白的理化性质进行预测分析。推测AlFPPS的分子式为C1781H2762N448O516S12,相对分子质量为5 519,pI为5.49,带正电残基(Arg+Lys):42,负电残基(Asp+Glu):51。该蛋白的不稳定系数为33.04,为稳定蛋白;脂肪系数为 95.15,亲水性系数为−0.196。
3.4.2 AlFPPS的信号肽、亚细胞定位及跨膜区预测在线软件SignalP 4.0 Server分析结果表明AlFPPS无信号肽,为非分泌蛋白。Wolfpsort预测表明AlFPPS最可能定位于细胞质和微粒[细胞质0.450,微粒0.406,线粒体基质空间0.100,溶酶体(腔)0.100]。用TMHMM预测AlFPPS跨膜区域,此蛋白不含跨膜区,全部存在于膜外。
3.4.3 AlFPPS结构域分析通过Clustal W13.0序列比对,AlFPPS的功能域氨基酸组成与其他植物一致,具有FPPS活性所必需的多肽位点,含5个保守的功能域(Asp-motif)(图 3)。FPPS为异戊烯基转移酶,该转移酶具有两个共同的氨基酸序列保守域[LIVM] [LIVM]XDDXXDXXXXRRG和[LIVMFY] GXXFQ [LIVM]XDD [LIVMFY]X [DN],它们也存在于茅苍术AlFPPS推测肽链的90~104氨基酸残基[LVLDDIMDESHTRRG]和224~236氨基酸残基 [MGTYFQVQDDYLD] 处,富含天冬氨酸(DDXXD)。

|
图 3 FPPS基因氨基酸序列同源性比对 Fig.3 Comparison on deduced amino acid sequences of AlFPPS and corresponding parts of other known FPPS |
3.4.4 AlFPPS的二级结构及三维结构预测
AlFPPS 蛋白的二级结构预测结果显示:α-螺旋和无规卷曲是AlFPPS的主要结构元件,β-折叠和延伸链散布于整个蛋白质中。由Swiss-Model Workspace在线分析软件建立AlFPPS三维结构模型如图 4所示,AlFPPS的功能域在空间布局上是主要由α-螺旋围绕成一个“大空穴”的立体结构,“大空穴”的表面藏有5个功能保守motif,其中与底物相结合的2个Asp-motif(DDXXD)位于“空穴”的内壁,推测AlFPPS的酶促催化反应在空穴中进行。
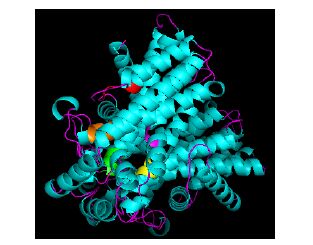
|
5个功能域GKLNR、DDIMD、GQMID、KT、DDYLD分别以红色、绿色、黄色、紫色及橘色表示 The five motif GKLNR,DDIMD,GQMID,KT,DDYLD were colored red,green,yellow,purple and orange,respectively 图 4 茅苍术AlFPPS蛋白三级结构预测 Fig.4 Three-dimensional structure of FPPS from A. lancea |
3.4.5 不同植物FPPS氨基酸序列进化分析
选取GenBank中记载的18种植物的18条FPPS氨基酸序列与茅苍术AlFPPS氨基酸序列在软件MEGA 5.0平台上采用Neighbor-Joining方法构建进化树,进行聚类分析,见图 5。可以看出茅苍术与菊科植物亲缘关系最近,聚为一类,而与五加科科、葫芦科等距离较远。
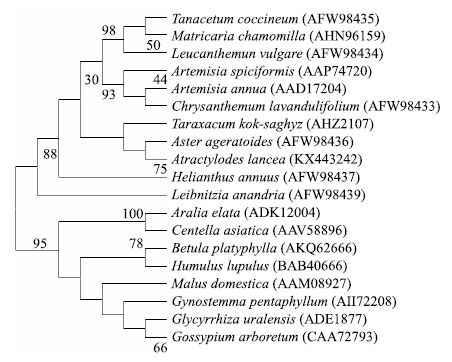
|
图中数字代表置信度,数值越高代表可信度越高 The figure represents the confidence level,the higher value represpents the higher credibility 图 5 19种植物的FPPS氨基酸序列进化分析 Fig.5 Phylogenetic tree of amino acid sequences of FPPS from 19 species |
3.5 不同生长期AlFPPS mRNA表达分析
利用qRT-PCR检测AlFPPS 在茅苍术不同生长阶段根茎中的相对表达量(图 6)。结果显示AlFPPS在茅苍术生长各阶段均有表达,以3月的苍术根茎AlFPPS为校正样本,AlFPPS表达量总体呈上升趋势,九月份略有下降,11月份达到最高,后下降。
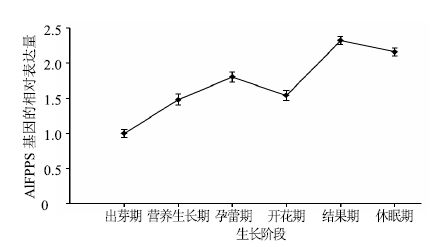
|
图 6 不同生长期AlFPPS mRNA表达分析 Fig.6 mRNA expression of AlFPPS during different growing phases of A. lancea Rhizomes |
3.6 不同生长期茅苍术活性成分测定
GC-MS检测茅苍术不同生长时期根茎中苍术酮、茅术醇、β-桉叶醇的量(图 7),结果显示3种倍半萜成分的量总体呈上升趋势,9月份略有下降。其变化趋势与AlFPPS的表达量变化较为一致。

|
图 7 不同生长期茅苍术活性成分测定 Fig.7 Content of active ingredients at different growing phases in A. lancea |
3.7 相关性分析
使用SPSS 18.0统计软件对茅苍术根茎中的苍术酮、茅术醇及β-桉叶醇的量与AlFPPS基因表达量进行相关性分析,Pearson相关系数分别为0.903(P<0.05)、0.901(P<0.05)及0.927(P<0.01),表明AlFPPS基因表达量与茅苍术主要倍半萜成分量呈显著正相关。
4 讨论法尼基焦磷酸酶是萜类MVA生物合成途径中的一个重要调节酶,在植物体内催化合成法尼基焦磷酸,为倍半萜化合物合成提供前体物质[14]。
AlFPPS氨基酸序列具有典型的该类酶所含保守功能域,其中2个富含DDXXD,被认为是酶与底物结合的位点,代表这一类酶的活性中心[15]。AlFPPS跨膜区及亚细胞定位显示其无跨膜结构,主要存在于细胞质中,与植物FPPS不存在跨膜结构域的观点相一致。通过植物相关氨基酸序列的系统进化分析,茅苍术与菊科植物亲缘关系较近,体现了其在分子系统演化关系中所处的位置,也为植物分类学提供了佐证,为进一步认识植物基因功能提供依据。
qRT-PCR分析表明AlFPPS在不同生长时期茅苍术的根茎中均有表达,其中9月份表达量较低,与倍半萜类成分量测定结果趋势较为一致,这可能是由于9月份为茅苍术盛花期,养分大部分输送给花果,导致根茎因养分供应不足或部分养分转运至花果而出现表达量下降的现象。AlFPPS表达量与倍半萜类成分量呈显著正相关,进一步说明了AlFPPS是茅苍术MVA生物合成途径中的重要调控位点,AlFPPS基因表达量与倍半萜类成分量在12月上旬的量均较高,与传统的采收期一致,也为最佳采收期的确定提供分子水平的科学依据。
利用FPPS基因过量表达可以有效提高活性成分的产量,对改善药材品质具有重要作用。有研究表明,过量表达青蒿的FPPS基因可以使转基因青蒿株系中的青蒿素量有一定的提高,在人参发根中过量表达FPPS可以提高人参总皂苷的量[16-17]。本实验首次克隆获得AlFPPS基因的全长cDNA,初步证明AlFPPS是茅苍术倍半萜类成分生物合成途径中的重要调控位点,为茅苍术倍半萜类成分生物合成途径阐明与生物工程应用提供科学依据。
| [1] | 邵婧, 谷巍, 巢建国, 等. 基于ITS2序列的茅苍术及其近缘种DNA分子鉴定[J]. 中草药, 2015, 46(8):1209–1215. |
| [2] | 李琳, 谷巍, 巢建国, 等. 濒危药用植物茅苍术花粉形态、活力测定及贮存研究[J]. 中国中药杂志, 2012, 37(11):35–38. |
| [3] | Ahmed S, Zhan C, Yang Y, et al. The transcript profile of a traditional Chinese medicine, atractylodes lancea, revealing its sesquiterpenoid biosynthesis of the major active components[J]. PLoS One, 2016, 11(3): 1–19. |
| [4] | 王凌健, 方欣, 杨长青, 等. 植物萜类次生代谢及其调控[J]. 中国科学:生命科学, 2013, 43(12):1030–1046. |
| [5] | 李永波, 樊庆琦, 王宝莲, 等. 植物法呢基焦磷酸合酶基因(FPPS)研究进展[J]. 农业生物技术学报, 2012, 20(3):321–330. |
| [6] | Vranová E, Coman D, Gruissem W. Network analysis of the MVA and MEP pathways for isoprenoid synthesis[J]. Annu Rev Plant Biol, 2013, 64: 665–700. DOI:10.1146/annurev-arplant-050312-120116 |
| [7] | Zhao Y J, Chen X, Zhang M, et al. Molecular cloning and characterisation of farnesyl pyrophosphate synthase from Tripterygium wilfordii[J]. PLoS One, 2015, 10(5): e0125415. DOI:10.1371/journal.pone.0125415 |
| [8] | Su S S, Zhang H M, Liu X Y, et al. Cloning and characterization of a farnesyl pyrophosphate synthase from Matricaria recutita L. and its upregulation by methyl jasmonate[J]. Genet Mol Res, 2015, 14(1): 349–361. DOI:10.4238/2015.January.23.8 |
| [9] | Ferriols V M, Yaginuma R, Adachi M, et al. Cloning and characterization of farnesyl pyrophosphate synthase from the highly branched isoprenoid producing diatom Rhizosolenia setigera[J]. Sci Rep, 2015, 5: 10246. DOI:10.1038/srep10246 |
| [10] | 王峰, 吴秋红, 高辉, 等. 红树林植物杯萼海桑法呢基焦磷酸合酶的基因克隆及序列分析[J]. 中草药, 2013, 44(16):2294–2299. |
| [11] | 徐杰, 高水平, 史国安, 等. 芍药FPPS基因的克隆及生物信息学分析[J]. 中草药, 2016, 47(4):655–660. |
| [12] | Wang J R, Li Y Y, Liu D N. Cloning and characterization of farnesyl diphosphate synthase gene involved in triterpenoids biosynthesis from Poria cocos[J]. Int J Mol Sci, 2014, 15(12): 22188–22202. DOI:10.3390/ijms151222188 |
| [13] | 中国药典[S]. 一部. 2015. |
| [14] | Guo L, Kong J Q. cDNA cloning and expression analysis of farnesyl pyrophosphate synthase from Ornithogalum saundersiae[J]. Z Naturforsch C, 2014, 69(5/6): 259–270. |
| [15] | 谷巍, 吴启南, 巢建国, 等. 建泽泻法呢基焦磷酸合酶分子克隆、分布表达及生物信息学研究[J]. 药学学报, 2011, 46(5):605–612. |
| [16] | Kim Y K, Kim Y B, Uddin M R, et al. Enhanced triterpene accumulation in Panax ginseng hairy roots overexpressing mevalonate-5-pyrophosphate decarboxylase and farnesyl pyrophosphate synthase[J]. ACS Synth Biol, 2014, 3(10): 773–779. DOI:10.1021/sb400194g |
| [17] | Wang Y Y, Jing F Y, Yu S Y, et al. Co-overexpression of the HMGR and FPS genes enhances artemisinin content in Artemisia annua L[J]. J Med Plants Res, 2011, 5(15): 3396–3403. |
 2017, Vol. 48
2017, Vol. 48


