2. 浙江中医药大学, 浙江 杭州 310053
2. Zhejiang Chinese Medical University, Hangzhou 310053, China
西红花为鸢尾科(Iridaceae)番红花属Crocus L. 植物番红花Crocus sativus L. 的干燥柱头,仅以雌蕊上部3根红色柱头入药,产量较低,具有活血化瘀、凉血解毒、解郁安神功效[1]。由于西红花独特的颜色、香气和苦味,是世界上最名贵的香料和食品着色剂,也是最名贵的中药材[2-4]。西红花苷、藏花醛和苦藏花素3种类胡萝卜素类次生代谢产物分别是西红花色、香、味的主要成分,其中以西红花苷和苦藏花素量最为丰富。西红花价格昂贵,质量评价指标的选择尤为重要。《中国药典》2015年版西红花项下以西红花苷中西红花苷-I和西红花苷-II为质量评价指标,对苦藏花素等次生代谢产物则没有规定。在中药复杂成分体系研究中,普遍认为被吸收入血的成分可能是发挥药效的活性成分,分析中药口服给药后血液中的成分是快速、准确地研究中药药效物质基础的有效途径[5]。因此,对西红花入血成分进行研究,确定入血成分,并以此为质量评价指标才能够真实反映西红花药材的质量优劣及品质好坏,控制西红花药材质量才更具有实际意义。目前对西红花中单体成分西红花苷-I吸收代谢的研究已有报道[6-8],而西红花整体给药后吸收入血成分的研究目前尚无报道,制约了其质量评价指标的完善。
本研究在对西红花化学成分分析的基础上,采用HPLC-DAD-ESI-MSn对西红花水提液ig给大鼠后的主要吸收入血成分及其随时间变化的规律进行分析,以期为揭示该西红花口服给药后发挥活血化瘀等药效的潜在体内作用物质基础提供依据,也为更合理地选择质量评价指标以控制西红花药材质量提供参考。
1 材料Agilent 1200高效液相色谱仪,DAD检测器(美国Agilent公司);Agilent 6330离子阱质谱仪,配有电喷雾离子源(ESI)(美国Agilent公司);Milli-Q超纯水仪(美国Millipore公司);KQ-500DB型数控超声波清洗器(昆山市超声仪器有限公司);Thermo Scientific高速离心机(美国Thermo Fisher Scientific公司)。
对照品西红花苷-I(批号111588-201202)、西红花苷-II(批号111589-201304),均购于中国食品药品检定研究院;对照品藏花醛(批号101198434,Sigma公司,质量分数>88%);对照品苦藏花素(自制,面积归一化法计算质量分数>90%);甲醇和甲酸均为色谱纯(美国Tedia公司),其余化学试剂均为分析纯。
西红花药材来源于浙江湖州南太湖西红花种植基地,经浙江中医药大学陈锡林教授鉴定为番红花Crocus sativus L. 的干燥柱头,研磨后避光干燥保存。
SD大鼠,雄性,SPF级,体质量(220±20)g,购于浙江省实验动物中心,许可证号SCXK(浙)2014-0001,于温度(23±2)℃和湿度(55±10)%的动物房内饲养,每天进行12 h的光照,自由饮水和饮食。
2 方法 2.1 液相色谱条件Ultimate XB C18色谱柱(250 mm×4.6 mm,5 μm);柱温30 ℃;流动相为0.4%甲酸水溶液(A)-甲醇(B),梯度洗脱:0~60 min,20%~100% B;DAD波长范围200~600 nm,0~36 min(260 nm);36~60 min(440 nm);体积流量0.8 mL/min;进样量10 μL。在该色谱条件下,各色谱峰有较好的基线分离。
2.2 质谱条件ESI源,正负离子交换模式;扫描范围m/z 50~1 200;干燥气温度350 ℃,干燥气流量12.0 L/min,雾化气压力241 kPa;毛细管电压4.5 kV;碰撞电压1.0 V;进入质谱的流动相体积流量分流至0.4 mL/min。
2.3 西红花水提液的制备取西红花干燥柱头粉末5.0 g,加100 mL蒸馏水,超声提取30 min,制得50 mg/mL西红花水提液,ig给药前摇匀。
2.4 供试品溶液制备精密吸取西红花水提液0.5 mL,置25 mL量瓶,加甲醇定容至刻度,摇匀,过0.22 μm微孔滤膜,用于给药前西红花水提液HPLC-MS分析。
2.5 血液样品的采集与处理SD健康雄性大鼠5只,给药前禁食12 h,期间自由饮水。西红花水提液按0.2 g/kg生药量(根据《中国药典》2015年版,西红花药材用量是1~3 g,选取中间用量,即2 g,根据体表面积换算法,折算成大鼠的用量)ig给予大鼠,分别于给药前和给药后10、30、60、120、180、240、360 min眼眶取血各0.6 mL,置于肝素钠处理的离心管中,3 500 r/min离心10 min,取上清液,得血浆样品。加入3倍量甲醇,涡旋1 min,12 000 r/min离心10 min,取上清液室温下N2吹干,残渣用200 μL甲醇复溶,12 000 r/min离心10 min,取上清液进样10 μL,进行HPLC-MS体内成分分析。空白血浆处理同上。
3 结果与分析 3.1 西红花水提液化学成分分析按上述色谱条件进样分析,得波长切换下的HPLC色谱图和负离子模式下的总离子流图(图 1)。根据各色谱峰在线UV图谱,正负离子模式下检测的分子离子峰及二级三级质谱裂解特征,与对照品对照,并结合相关文献报道[9],西红花水提液的HPLC图中11个主要色谱峰被鉴定,见表 1,主要是代表西红花色、香、味的3类成分。其中包括7个苷元均为西红花酸的西红花苷类成分(图 1-C中y4、y5、y6、y8、y9、y10、y11)。该类成分为西红花水溶性色素成分,是西红花柱头中量最丰富的一类,均显示脱辅基类胡萝卜素类化合物的特征紫外吸收。各化合物间主要区别是苷元西红花酸顺反异构体及结合葡萄糖基数目不同,其中以y4(反式西红花苷-I)和y5(反式西红花苷-II)量最高,也是《中国药典》2015年版西红花质量控制指标成分。2个苦藏花素类成分(y1、y3),为西红花苦味成分;该类成分与西红花苷类成分生物合成途径相同,量仅次于西红花苷类,其中以y1(苦藏花素)为主,y3(2,6,6-三甲基- 4-羟基环己烯甲醛,HTTC)是y1的苷元,量较低,主要是加热干燥过程中由苦藏花素分解生成。1个黄酮类化合物(y2),以山柰酚为苷元,该成分主要存在西红花的花瓣中,在柱头中量较低。1个西红花的香气成分藏花醛(y7),该成分的生成与HTTC类似,主要为西红花加热干燥过程中由苦藏花素水解为HTTC后进一步脱水生成。
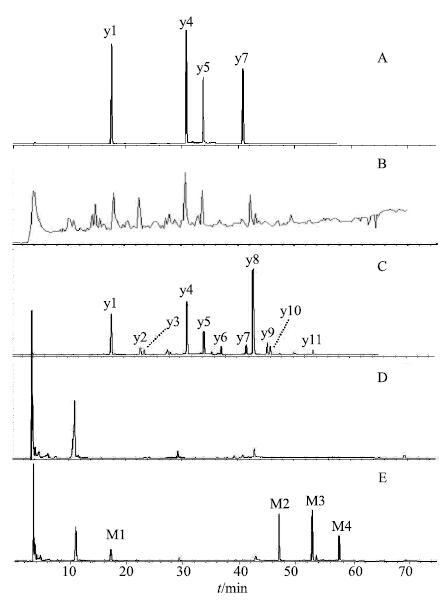
|
A-对照品 B-总离子流图 C-西红花水提液 D-空白血浆 E-给药后2 h血浆样品 A-mix reference substance B-total ion chromatogram C-sample before oral administration of saffron D-blank plasma E-plasma 2 h after oral administration of saffron 图 1 大鼠ig西红花水提液前后的血浆HPLC Fig.1 HPLC of plasma before and after oral administration of saffron |
|
|
表 1 西红花水提液11个主要色谱峰HPLC-DAD-ESI-MS分析结果 Table 1 HPLC-DAD-ESI-MS data of 11 chromatograph peaks in saffron before oral administration |
3.2 西红花水提液在大鼠血中的移行成分分析
比较大鼠空白血浆、给药后大鼠血浆和西红花水提物的HPLC图,确定西红花水提液ig给予大鼠后4个主要血中移行成分,将4个入血成分分为原型入血成分和代谢产物2类。
3.2.1 血浆中西红花原型入血成分分析采用HPLC-DAD-ESI-MSn对西红花水提液ig给药大鼠后吸收入血成分进行分析,在空白血浆中未出现而在给药血浆和西红花水提物中对应位置共同存在的色谱峰(图 1),为西红花原型吸收入血成分。主要发现1个原型入血成分,即图 1-E中的M1号色谱峰,通过与“3.1”项下给药前西红花成分比较,确定该化合物为苦藏花素。该化合物的正负离子一级全扫描得到分子离子峰m/z 353 [M+Na]+和m/z 374.9 [M+HCOOH-H]−,推测相对分子质量为330。二级质谱中出现的m/z 225碎片离子峰为 [Glu+HCOOH-H]−,是由m/z 375糖苷键断裂失去苷元得到的碎片离子,见图 2。口服给药后,其有效物质均以血液为媒介运送至靶点而产生药理作用,苦藏花素以原型被吸收入血,推测该成分可能是西红花的活性成分。
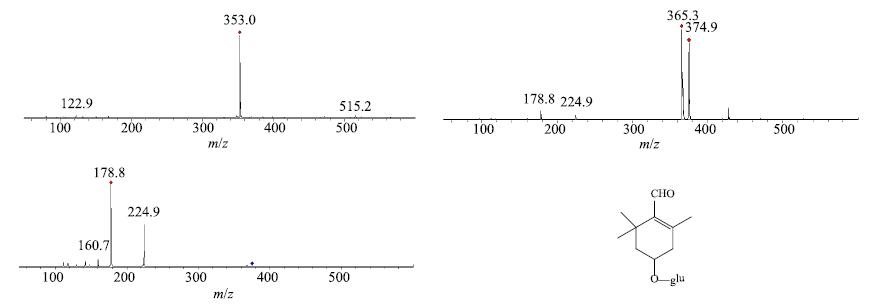
|
图 2 入血原型成分苦藏花素质谱图 Fig.2 MS/MS2 spectra of picrocrocin |
3.2.2 血浆中西红花代谢产物分析
对比空白血浆、给药后血浆和西红花水提液HPLC图(图 1),在空白血浆和给药前西红花水提液中均未出现,而仅在给药血浆中出现的色谱峰,为西红花入血的代谢成分。主要发现3个响应强度较大的代谢产物色谱峰,即图 1-E中的峰M2、M3和M4。3个代谢产物的在线UV图谱(图 3),均出现西红花苷类成分的特征紫外吸收峰,而《中国药典》2015年版西红花项下质量评价指标西红花苷-I和苷-II,及药材中其他西红花苷类成分在所有时间点的血浆中均未检测到,推测3个代谢产物可能是西红花药材中西红花苷类成分(图 1-C中y4、y5、y6、y8、y9、y10)的代谢产物。
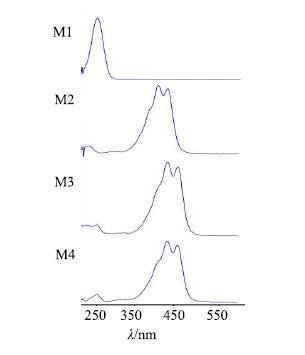
|
图 3 西红花血中移行成分在线UV图谱 Fig.3 UV absorption spectra of absorbed components in plasma |
M2(tR为47.3 min):在HPLC中保留时间比西红花酸短,负离子一级全扫描得准分子离子峰m/z503 [M-H]−,推测相对分子质量为504,比西红花酸相对分子质量多176。m/z 503二级质谱中出现m/z327,是由m/z 503失去葡萄糖醛酸基得到的西红花酸特征离子,三级质谱中m/z 327进一步裂解,得到m/z 283和m/z 239,这是西红花酸中2个羧基依次以CO2的形式脱去的特征碎片离子,m/z 327、m/z 283和m/z 239可作为西红花酸出现的有利证据,见图 4。推测M2为西红花酸单葡萄糖醛酸代谢物(crocetin-GA),可能是西红花苷类成分在肠内菌β-葡萄糖苷酶作用下苷键水解失去葡萄糖基,生成苷元西红花酸,再与葡萄糖醛酸结合进行代谢。
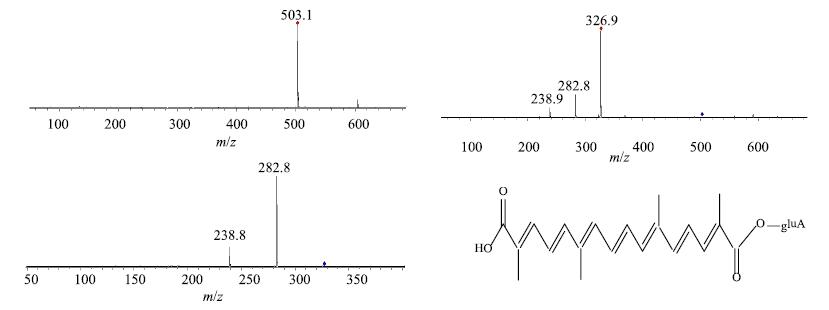
|
图 4 代谢产物西红花酸单葡萄糖醛酸结合物质谱图 Fig.4 MS/MS2/MS3 spectra of crocetin-monoglucuronide |
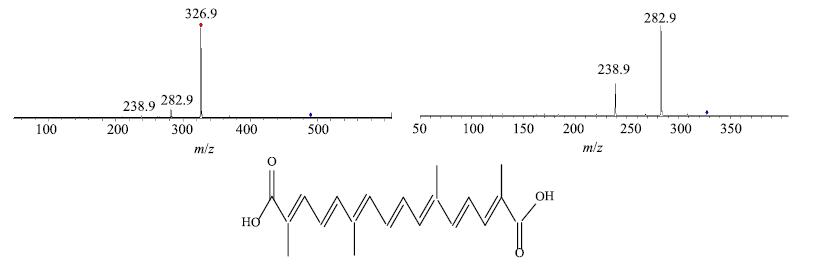
M3(tR为53.2 min):与给药前的HPLC中的y11的保留时间、在线UV图谱、质谱裂解规律相同,鉴定该成分为西红花酸(图 5),为西红花中所有西红花苷类成分的苷元。西红花酸在给药前西红花药材中量极低,而血浆中该成分浓度较高,因此推测血浆中该成分主要是西红花苷(图 1-C中y4、y5、y6、y8、y9和y10)在肠内菌β-葡萄糖苷酶作用下,苷键水解失去葡萄糖基后,以西红花酸形式被吸收入血的代谢成分。
|
图 5 代谢产物西红花酸质谱图 Fig.5 MS/MS2 spectra of crocetin |
M4(tR为57.9 min):在线UV图谱也显示为脱辅基类胡萝卜素类化合物的特征紫外吸收(图 3),在质谱图上该色谱峰没有响应。可能是由于该成分极性较小,使用ESI源,该化合物不容易离子化,有待进一步应用APCI源确定其结构。并且该成分在HPLC图上的保留时间比西红花酸长,极性可能比西红花酸小,可能是西红花中西红花苷类成分失去葡萄糖后得到西红花酸,进一步发生甲基化等的代谢产物。
以上结果表明,大鼠ig西红花水提液后,苦藏花素能以原型被吸收入血;而西红花苷虽是西红花的主要成分,但真正起作用的形式不是西红花苷原型而是其代谢产物。
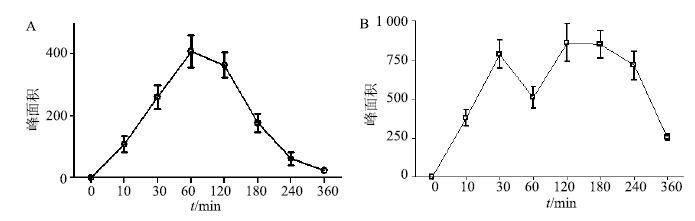
3.3 西红花血中移行成分经时变化取各时间点5只大鼠的血浆样品,按“2.1”项下测定。给药后10~360 min血浆中能全部检测到“3.2”项下认定的4个血中移行成分(包括1个原型入血成分和3个代谢产物),但4个成分在不同时间点相对浓度不同,以原型入血成分苦藏花素和代谢产物西红花酸为例,峰面积-时间变化曲线见图 6。
|
图 6 西红花入血成分苦藏花素 (A) 和西红花酸 (B) 峰面积-时间曲线 (x±s±s,n = 5) Fig.6 Peakarea-time curves of prototype and metabolites in rat plasma after oral administration of saffron extract (x±s,n = 5) |
结果显示,图 1-E中M1(苦藏花素)以原型逐渐被吸收入血,血药浓度逐渐增加,60 min时血药浓度达峰值,而后随着血液循环在体内消除,并且在60~120 min时血药浓度相差不大。
西红花苷类化合物的体内代谢产物图 1-E中M3(西红花酸)吸收入血的药时曲线变化与原型成分苦藏花素不同,出现“双峰”现象。在30 min血药浓度第1次达峰值,随着血液循环在体内消除,在60 min后血药浓度又快速上升,在120 min第2次达峰值,之后血药浓度缓慢下降,2次达峰时的血药浓度相近。出现“双峰”现象推测可能是代谢产物通过肝肠循环,由胆汁将其再次排泄到小肠后重新被吸收进入体内。
4 讨论本研究首次对西红花水提液ig给予大鼠后的入血成分进行分析,指认了1个入血原型成分(苦藏花素)和3个西红花苷类代谢物(西红花酸、西红花酸单葡萄糖醛酸结合物及1个未确定结构),提示这些入血成分可能为西红花发挥药效的物质基础。苦藏花素和西红花苷类成分在西红花柱头发育过程中的生物合成途径相同,均以玉米黄素为底物,在一系列酶的作用下,最终生成2分子苦藏花素和1分子西红花苷类成分。苦藏花素在西红花柱头中量高达10%以上,仅次于总西红花苷类,并已有研究表明苦藏花素具有抗肿瘤、抗抑郁等多种药理活性[10, 11, 12],因此,建议将苦藏花素纳入西红花药材质量控制指标,能更有效控制评价西红花药材质量。
西红花中含有多种以西红花酸为苷元、葡萄糖基数目不同的西红花苷类成分。《中国药典》2015年版西红花项下仅以西红花苷中量较大的西红花苷-I和西红花苷-II为指标对西红花进行质量控制,但不能全面反映总西红花苷的量。并且研究结果表明西红花苷-I和苷-II等所有西红花苷类成分在所有时间点的血浆中均未检测到,而检测到的是其水解去除葡萄糖基的代谢产物——西红花酸和西红花酸葡萄糖醛酸结合物。推测西红花苷类成分真正起作用的形式是其苷元西红花酸。本课题组将继续以此研究结果为切入点,利用葡萄糖苷酶对西红花总苷进行水解,以水解出来的西红花酸作为西红花质量评价指标,将能更好地反映西红花药材质量。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | Nenadis N, Heenan S, Tsimidou M Z, et al. Applicability of PTR-MS in the quality control of saffron[J]. Food Chem, 2016, 196: 961–967. DOI:10.1016/j.foodchem.2015.10.032 |
| [3] | Bononi M, Milella P, Tateo F. Gas chromatography of safranal as preferable method for the commercial grading of saffron (Crocus sativus L.)[J]. Food Chem, 2015, 176: 17–21. DOI:10.1016/j.foodchem.2014.12.047 |
| [4] | Moraga A R, Nohales P F, Pérez J A F, et al. Glucosylation of the saffron apocarotenoid crocetin by a glucosyltransferase isolated from Crocus sativus stigmas[J]. Planta, 2004, 219(6): 955–966. DOI:10.1007/s00425-004-1299-1 |
| [5] | 常存库, 王喜军. 中药血清药物化学理论与方法的意义[J]. 世界科学技术——中医药现代化, 2010, 12(4):634–637. |
| [6] | Asai A, Nakano T, Takahisal A M, et al. Orally administered crocetin and crocins are absorbed into blood plasma as crocetin and its glucuronide conjugates in mice[J]. J Agric Food Chem, 2005, 53(18): 7302–7306. DOI:10.1021/jf0509355 |
| [7] | 张颖, 刘建勋, 林力, 等. 大鼠口服西红花苷-I后吸收入血成分及药动学[J]. 中国药学杂志, 2012, 47(2):136–140. |
| [8] | Xi L, Qian Z Y, Du P, et al. Pharmacokinetic properties of crocin (crocetin digentiobiose ester) following oral administration in rats[J]. Phytomedicine, 2007, 14(9): 633–636. DOI:10.1016/j.phymed.2006.11.028 |
| [9] | Ranjit S V, Deepak M. Analysis of saffron (Crocus sativus L. Stigma) components by LC-MS-MS[J]. Chromatographia, 2010, 71(1): 117–123. |
| [10] | Hamid H, Zahra B, Mohagheghi A M. Effect of picrocrocin on breast cancer and EDA activity in rat[J]. Clin Biochem, 2011, 44(13): 121–125. |
| [11] | 王平, 童应鹏, 陶露霞, 等. 西红花的化学成分和药理活性研究进展[J]. 中草药, 2014, 45(20):3015–3028. |
| [12] | Mohammad R K, Mohammad H B, Mohammad H, et al. The effects of Crocus sativus (saffron) and its constituents on nervous system:A review[J]. Avicenna J Phytomed, 2015, 5(5): 376–391. |
 2017, Vol. 48
2017, Vol. 48


