2. 广州市博泓食品科技有限公司, 广东 广州 510275
2. Guang zhou Bo Hong Food science and technology co. LTD, Guangzhou, 510275, China
玛咖为十字花科独行菜属植物玛咖Lepidium meyenii Walp. 的根茎,原产于秘鲁安第斯山区。自2000年初引种进入中国以来,云南省丽江地区、新疆和西藏等高原地区的种植面积逐步扩大,2011年玛咖被批准为新资源食品[1-2]。化学成分研究表明,玛咖根和叶中含有丰富的营养成分,其中,玛咖烯和玛咖酰胺被认为是玛咖生物活性的标识性成分[3-4]。已有研究表明,玛咖酰胺具有提高性功能和生育能力[5]、运动能力[6]的作用以及具有神经保护[7]、神经调节(FAAH抑制剂)[8-9]等药理作用。
磷酸二酯酶5(PDE5)选择性抑制剂作为治疗勃起功能障碍(ED)一线用药,如西地那非(伟哥)、他达拉非和伐地那非等,服药后,会出现包括头痛、脸红、消化不良、头昏和视力模糊等副作用,且价格昂贵,增加了患者的经济负担[10]。从植物中提取的化学成分,包括毛喉素、淫羊藿苷和育亨宾、玛咖醇提物等[11, 12],有利于提高性能力,但是体内具体机制还不明确。另有研究表明,在触发阴茎勃起的生理性反应中,一氧化氮-环鸟苷酸-磷酸二酯酶5(NO-cGMP-PDE5)通路起着关键性作用[13]。为进一步研究玛咖提高性能力的作用机制,本研究考察了玛咖不同提取部位对通路中PDE5的抑制作用,建立了较强抑制作用部位的指纹图谱,并用灰关联度法研究谱-效关系,为探索玛咖入药部位和具有PDE5抑制活性的成分追踪提供新依据。
1 材料 1.1 药材与试剂实验用药材由广州市博泓食品科技公司和武汉华士特工业科技有限公司提供,玛咖样品经中山大学药学院尹胜教授鉴定为十字花科科独行菜属植物玛咖Lepidium meyenii Walp.。栽培的玛咖购自秘鲁和全国4个省份;均为晒干处理,干燥后粉碎过筛,干燥器内保存。样品来源信息见表 1。
|
|
表 1 样品来源 Table 1 Origins of samples |
亚油酸购自中国食品药品检定研究院,质量分数99%(批号20151115);异硫氰酸苄酯购自北京伊诺凯公司,质量分数99%(批号20151005);N-苄基亚麻酰胺、N-间甲氧基苄基亚油酰胺、N-十六烷酰胺、N-苄基亚油酰胺和N-间甲氧基苄基-亚麻酰胺对照品,购自武汉华士特工业科技有限公司,质量分数均为98%;乙腈、甲醇均为色谱纯,购自彼西络科技有限公司;超纯水,实验室自制;Tris(Bio-rad);MgCl2(天津市大茂化学试剂厂);二硫苏糖醇(Bio-Basic Inc.);氚代环鸟苷酸(cGMP,PerkinElmer公司);胰蛋白胨和酵母提取物(OXOID公司) ;异丙基-D-硫代半乳糖苷(科昊生物工程有限公司);二甲基亚砜(Oceanpak Alexative Chemical);Ba(OH)2溶液(Sigma公司);ZnSO4(Sigma-Aldrich);其他试剂均为分析纯。
1.2 试剂与仪器LC-20AB高效液相色谱仪(包括PDA检测器、LCsolution色谱工作站);色谱柱为BDS Hypersil C18(250 mm×4.6 mm,5 μm);LCMS-IT-TOF液质联用仪,日本岛津公司;SB-800DT超声清洗仪,
宁波新芝有限公司;Sartorius TE612-L分析天平,北京赛多利斯仪器系统有限公司;GX-10A多功能粉碎机,上海高翔食品科技有限公司;EYEL4旋转蒸发仪,东京理化器械株式会社;DZF-6050型真空干燥箱,广东环凯微生物科技有限公司;UP200S细胞破碎仪,德国Hielscher公司;6K1型离心机,Sigma公司;Vortexgeni涡旋仪,美国SI公司;BioPhotomer分光光度计,德国Eppendorf公司;Ni-NTA亲和色谱柱,Qiagen,Valencia公司;Tricarb2910液体闪烁计数器,PerkinElmer公司。
2 方法 2.1 玛咖不同溶剂提取部位的制备取粉碎过筛后的玛咖粉5.0 g,加入料液比1∶15(质量体积比)的石油醚浸泡3 h后,超声提取30 min(600 Hz),同法提取2次,合并滤液,浓缩,得到石油醚部位,平均出膏率0.6%;滤渣保留,挥干溶剂,加入料液比1∶10(质量体积比)的醋酸乙酯,超声提取30 min(600 Hz),同法提取2次,合并滤液,浓缩,得到醋酸乙酯部位,平均出膏率0.4%(g/g);剩余残渣加入料液比1∶10(质量体积比)的无水乙醇,超声提取30 min(600 Hz),同法提取2次,合并滤液,浓缩,得到乙醇部位,平均出膏率8.0%。各部位浸膏真空干燥后,取适量,用甲醇溶解,定容至10 mg/mL。过滤膜,即得指纹图谱用供试液。活性测试所用的提取物浸膏,乙醇总提取物的制备方法:准确称取干燥的玛咖粉末5.0 g至三角瓶内,加入料液比1∶20的 95%乙醇,超声提取30 min(600 Hz),同法提取2 次,合并滤液,浓缩,得乙醇总浸膏。其他各溶剂部位的浸膏,制备方法同指纹图谱供试液。取各部位的浸膏,用二甲基亚砜溶解,配制30 mg/mL储备液,−20 ℃保存备用。
2.2 对照品溶液的制备精密称量亚油酸、异硫氰酸苄酯、玛咖酰胺对照品,用甲醇溶解,定容至5 mg/mL,供指纹图谱用;精密称取苄基异氰硫酸酯、玛咖酰胺对照品,用二甲基亚砜溶解,配制浓度为10 mmol/L的储备液,供活性测试用。
2.3 指纹图谱的方法学考察参考文献方法[14-15],取石油醚部位的供试液,对液相方法进行精密度、稳定性、重复性考察,检测指纹图谱。以第1张图作为参照谱,进行自动匹配。计算各指纹谱的相似度和相似度的RSD。
2.4 指纹图谱的建立吸取“2.1”项下供试液10 μL,LC-20AB高效液相色谱仪测定。色谱条件:色谱柱为BDS Hypersil C18(250 mm×4.6 mm,5 μm);柱温30 ℃,体积流量0.5 mL/min,流动相A为0.02%甲酸水(pH值3.0),流动相B为甲醇。梯度洗脱:0~8 min,40%~50% B;8~16 min,50%~60% B;16~30 min,60% B;30~40 min,60%~80% B;40~50 min,80%~90% B;50~80 min,90% B;80~90 min,90%~40% B;90~120 min,40% B,PDA检测器,采用中药色谱指纹图谱相似度评价系统2004A版软件对商品玛咖药材的指纹图谱进行数据处理,生成对照指纹图谱,计算指纹图谱相似度。
2.5 共有峰分析精密称取亚油酸、异硫氰酸苄酯、玛咖酰胺对照品,甲醇定容至5 mg/mL,LC-20AB高效液相色谱仪测定,液相条件同上述“2.4”项,进样10 μL,梯度洗脱,记录保留时间。液质联用条件采用LCMS-IT-TOF液质联用仪,液相条件同上述“2.4”项,质谱条件为:LC/MS系统使用ESI离子源,分流比为1∶4,在正离子模式与负离子模式下分别采集数据,自动三级碎片分析,正/负离子条件:正、负离子同时扫描;扫描范围:MS1 m/z 100~800,MS2 m/z 50~600,MS3 m/z 50~600;加热模块温度200 ℃;曲形脱溶剂装置(CDL)温度200 ℃;雾化气体积流量1.5 L/min;干燥气压力100 kPa;碰撞气为高纯氩气;离子源电压:正离子模式+4.5 kV,负离子模式−3.5 kV;检测器电压:1.6 kV。应用LCMSsolutuon工作站对采集数据进行记录和处理,结合谱库定性。
2.6 活性测试取“2.1”项下玛咖各提取部位储备液和“2.2”项下对照品溶液,稀释成一定浓度后,用于活性测试。PDE5表达与纯化按文献报道[16]方法进行。
将已构建的质粒pET15b-PDE5(535-860)转化入大肠杆菌菌株(E. coli)BL21(Codonplus,Stratagene)中。携带重组质粒的E. coli细胞在含有100 μg/mL氨苄青霉素、30 μg/mL氯霉素和0.4%葡萄糖的LB培养基(每升培养基含有10 g 胰蛋白胨、5 g 酵母提取物和5 g NaCl)中,37 ℃下长到吸光度值(A600nm)为0.7。然后加入0.1 mmol/L 异丙基-D-硫代半乳糖苷(IPTG)诱导表达,在15 ℃下继续生长16 h。离心收集细胞(转速4 500 r/min,时间为30 min)。离心后细胞放入−80 ℃下冷冻保存。通常2 L培养基能收集约10 g细胞(湿质量)。
大肠杆菌表达的PDE5分别通过Ni-NTA亲和柱、Q-Sepharose离子交换柱、Sephacryl S300分子筛色谱柱来纯化。通常2 L细胞培养基能够收集到>10 mg的PDE5蛋白质。十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上显示PDE5蛋白质的纯度达到90%以上。
将表达好的蛋白靶标用于活性测试。首先,取1/100纯水稀释的氚代cGMP(20 000~30 000 cpm)4 μL,用缓冲液(50 mmol/L Tris pH 8.0、10 mmol/L MgCl2、0.5 mmol/L二硫苏糖醇)稀释至58 μL,然后加入待测药物溶液2 μL,设置的对照组中加入2 μL DMSO,混匀。再加入已用缓冲液稀释的水解率在40%~70%的蛋白质溶液40 μL,阴性对照组中加入40 μL缓冲液,轻轻混匀,在25 ℃下静置反应15 min。最后依次加入0.2 mol/L ZnSO4 200 μL和0.2 mol/L Ba(OH)2溶液200 μL终止反应,振荡混合均匀。14 000 r/min离心5 min。取上清液430 μL,转移至液闪管中,加入闪烁液2.5 mL,振荡混合均匀后用液体闪烁计数仪测定。按以下公式计算抑制率。
抑制率=1-(1-CPM样品加定量靶蛋白)/(1-CPM空白对照加定量靶蛋白)CPM为每分钟计数率
3 结果与分析 3.1 玛咖有效部位的筛选借助于PDE5抑制剂筛选平台,对四川甘孜地区玛咖醇提取物筛选发现,甘孜玛咖(S6)乙醇总提取物具有良好的PDE5抑制活性,且呈浓度依赖性,在较低质量浓度(0.1 mg/mL)下,乙醇总提取物对PDE5的抑制率为86.9%。玛咖乙醇总提取物质量浓度为0.001、0.01、0.1、0.2、0.5、0.7、0.9、1.2 mg/mL时的抑制率分别为8.8%、35.1%、86.9%、87.5%、94.8%、87.0%、96.6%、95.4%。
以抑制率(Y)对质量浓度(X)作图,对数拟合的方程为Y=13.189 lnX+100.2,r=0.969 5,求得半数抑制浓度(IC50)为0.022 mg/mL。为了进一步追踪有效部位,在相同质量浓度下,比较了玛咖不同溶剂提取部位对PDE5的抑制率,结果表明,石油醚部位、醋酸乙酯部位对PDE5具有较好的抑制作用,平均抑制率的大小顺序:石油醚部位>醋酸乙酯部位>乙醇部位,同一产地,不同海拔高度的甘孜玛咖(S1~S6)石油醚提取物对PDE5的抑制率差异不显著,结果见表 2。
|
|
表 2 玛咖不同提取部位对PDE5的抑制率 Table 2 Inhibitory rates of different extracts from L. meyenii on PDE5 |
玛咖叶(S16)石油醚提取物与玛咖根(S1~S7)的PDE5抑制率相当,玛咖叶3个溶剂部位提取物对PDE5的抑制率,随着提取溶剂极性的增加,抑制率下降,这与根部提取物的活性数据变化趋势一致。说明玛咖叶脂溶性提取物中,可能含有与根部类似的成分,且该类成分对PDE5具有较好的抑制作用。
3.2 不同溶剂部位的指纹图谱取各批次供试液,按“2.4”项下的色谱条件建立相应的HPLC图谱,通过中药色谱指纹图谱相似度评价软件(2004A版)处理,选取中位数法分别生成玛咖3个不同提取部位的对照指纹图谱,并计算其相似度。220 nm波长下,各特征峰峰形较好,色谱峰数目最多,石油醚部位有21个共有峰,醋酸乙酯部位有20个共有峰。各部位生成的对照指纹图谱见图 1。
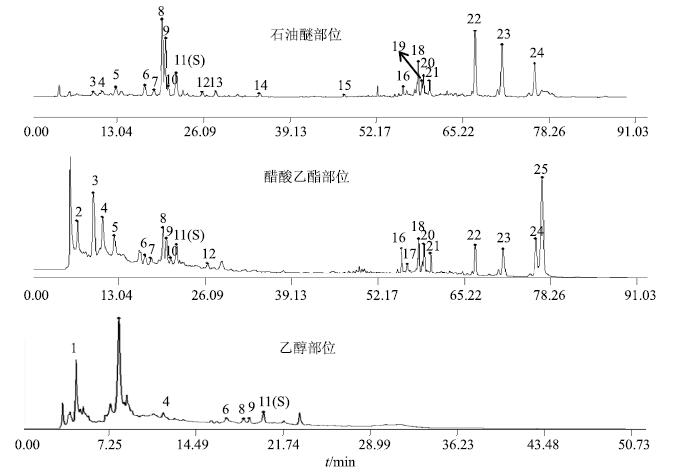
|
15-异硫氰酸苄酯 22-N-苄基亚麻酰胺 23-N-间甲氧基苄基亚油酰胺 24-N-十六烷酰胺 15-benzyl isothiocyanate 22-N-benzyl (9Z,12Z) octadecatrienamide 23-N-(3-methoxybenzyl)-(9Z,12Z) octadecadienamide 24-N-benzyl-hexadecanamide 图 1 玛咖不同提取部位的对照指纹图谱 Fig.1 HPLC fingerprints of different extracts of L. meyenii |
结合对照品的液相保留时间,推测峰号15、22、23、24的峰依次为异硫氰酸苄酯、N-苄基亚麻酰胺、N-间甲氧基苄基亚油酰胺和N-十六烷酰胺,11号峰在3个溶剂提取部位均出现,且该色谱峰在210、220、280 nm下均具有良好的分离度,作为参照峰,计算其他共有峰的相对峰面积,结果见表 3。
|
|
表 3 玛咖不同提取部位指纹图谱的相对峰面积 Table 3 Relative peak areas of HPLC fingerprints of different parts of L. meyenii |
3.3 共有峰分析
为进一步确证指纹图谱中玛咖酰胺类成分,采用LC/MS-IT-TOF液质联用技术对指纹图谱中各特征峰进行定性分析。液相条件同指纹图谱条件,质谱离子源为电喷雾离子源ESI。玛咖石油醚提取物(S4)进样后,同时采用正、负离子检测模式,获得各个色谱峰的三级质谱数据,样品的HPLC图谱和三级质谱的总离子流图见图 2。对比同条件下玛咖酰胺混合对照品(峰15:异硫氰酸苄酯;峰22:N-苄基亚麻酰胺;峰23:N-间甲氧基苄基亚油酰胺;峰24:N-苄基十六烷酰胺)的保留时间,对样品中各峰保留时间进行校正。
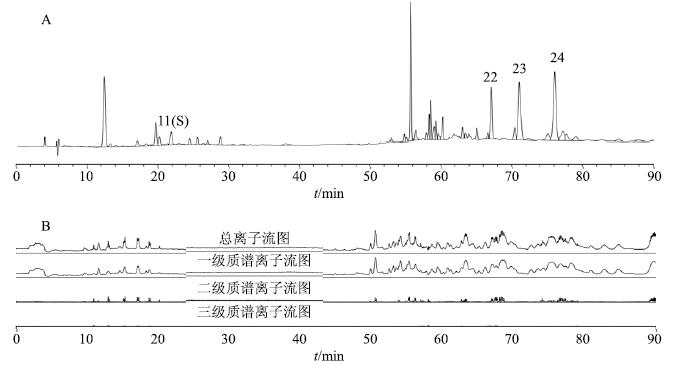
|
图 2 玛咖 (S4) 石油醚提取部位的HPLC (A) 和正离子模式下的总离子流色谱图 (B) Fig.2 HPLC at 220 nm (A) and total ion chromatogram (B) from petroleum ether part of L. meyenii in positive ion mode |
结合对照品及文献数据[17],解析各成分MS1、MS2和MS3谱图的离子碎片归属,对各成分进行指认。峰11(S)的全扫描一级质谱图中,正离子扫描的m/z 216.101 4为 [M+H]+峰,表明该化合物的相对分子质量为215,对m/z 216.101 4离子进行二级质谱分析,产生的主要碎片离子为198.091 4和170.095 5,其中m/z 198.091 4为母离子m/z 216.101 4丢失一分子水生成的离子 [M+H-H2O]+,由m/z 198.091 4的三级质谱,在此基础上m/z 198.091 4离子又失去一个质量数28中性碎片得m/z 170.095 5[M+H-H2O-CO]+,推断为3-苄基取代的吡啶正离子,继续发生断裂,产生m/z 91.054 2的苄基正离子。根据质谱数据、裂解途径及相关文献报道[18],对比文献中该化合物的紫外吸收波长,与该化合物一致。因此推断参照峰11(S)所代表的化合物为生物碱macaridine。同理,确证了玛咖石油醚样品中其他3个成分,成分确证的结果见表 4。
|
|
表 4 玛咖石油醚部位化合物的LC/MS-IT-TOF数据 Table 4 Characterization of chemical compositions from petroleum ether part of L. meyenii with LC/MS-IT-TOF |
3.4 方法学考察
经方法学考察,以石油醚提取部位为例:精密度、稳定性、重复性的指纹图谱相似度均大于0.9,指纹图谱相似度的RSD分别为0.05%、0.40%、1.01%,符合分析要求。
3.5 指纹图谱的聚类分析采用DPS数据处理系统,每个样本各特征峰的相对峰面积,采用欧式距离进行聚类分析,最短距离法的聚类效果最好。如图 3,石油醚部位:10个(S2、S4、S6、S7、S8、S9、S10、S11、S12、S13)样本分成4类,第1类为甘孜玛咖(S2、S4、S6)、秘鲁利马黑玛咖(S8)和云南邵通玛咖(S12);第2类为新疆玛咖(S9)和玉龙玛咖(S13);第3类秘鲁黄玛咖(S7)和西藏林芝(S11);第4类为西藏曲水的玛咖(S10),是一个特殊类别。类似地,醋酸乙酯部位系统聚类的结果分为3类,秘鲁黄玛咖(S7)和西藏曲水的玛咖(S10)为单独的2类。
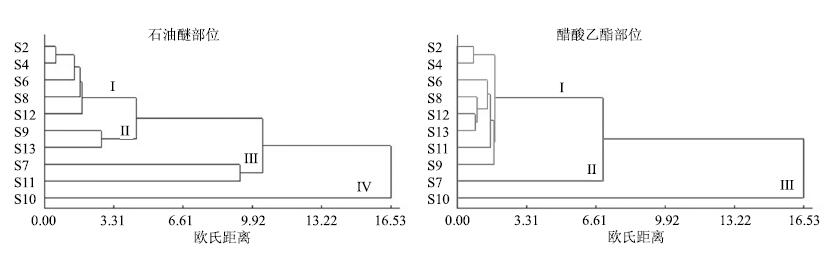
|
图 3 玛咖不同提取部位HPLC图谱的系统聚类分析 Fig.3 Hierarchical clustering analysis (HCA) of HPLC spectra of different extracts of L. meyenii |
3.6 入药部位的考察
玛咖植株地上部分平铺地面,地下部分为萝卜状块茎,根分枝,有长须根,气味辛辣而特殊。张维等[19]研究了云南种植玛咖不同部位化学成分和抗氧化活性差异,发现根部必需氨基酸的量高于玛咖叶。为了进一步阐明玛咖不同部位化学成分的差异,选用甘孜地区同海拔的样品(S1、S15、S16)建立了玛咖根、根须、叶子部位的对照指纹图谱。见图 4。
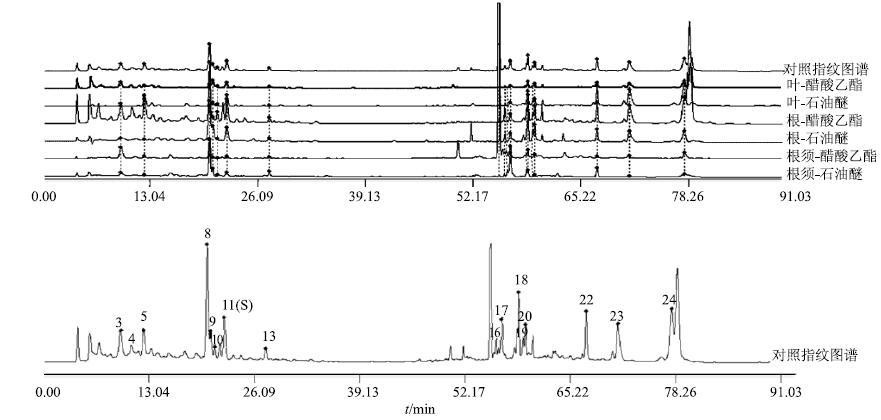
|
图 4 甘孜地区同海拔玛咖不同入药部位 (根S1,根须S15,叶S16) 的HPLC指纹图谱 Fig.4 HPLC fingerprints of different medical parts (root S1,root hairhair S15,leaf S16) of L. meyenii |
对比发现,3个部位均含有特征峰3、4、5、8、9、10、11、13、16、17、18、19、20、22、23、24。3种已知的玛咖酰胺(22、23、24)总峰面积占比大小排序,石油醚部位:根须(37.6%)>根(15.4%)>叶(7.8%);醋酸乙酯部位:根(12.5%)>根须(11.8%)>叶(1.4%)。结果表明,玛咖的根、叶中均含有类似的玛咖酰胺类成分,主要差异在该类成分量的高低。
3.7 谱-效关系研究 3.7.1 统计分析本实验建立了不同溶剂部位的指纹图谱,匹配共有峰,并结合活性测试数据,进行谱效分析。因活性测试的样本量小,主要采用系统聚类方法[20],灰度关联分析法[21]和偏最小二乘法[22],评价各共有峰的相对峰面积与样品PDE5抑制率两者的相关性,确定各色谱峰对药效贡献的大小。系统聚类结果分析可知:第1类为石油醚部位,抑制率最高;第2类和第3类均为醋酸乙酯部位,抑制率较高,但秘鲁利马玛咖(S7)为单独的1类;第4类为乙醇部位,抑制率较低,结果见图 5。
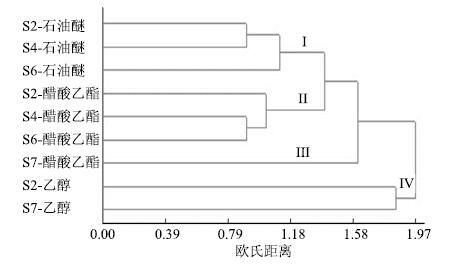
|
图 5 玛咖不同提取部位PDE5抑制率的系统聚类分析 Fig.5 Hierarchical clustering analysis (HCA) of inhibitory rate of different extracts of L. meyenii on PDE5 |
统计分析之前,对各共有峰的相对峰面积和PDE5抑制率进行Persons相关分析,比如,参照峰S(macaridine)的峰面积比与PDE5抑制率的Persons系数r为0.666 4(α=0.05),呈正相关。进而以PDE5抑制率为母序列,玛咖指纹图谱的各共有峰相对峰面积为子序列,进行灰色关联分析时,母序列个数1,数据转换方式选择均值化,分辨系数ρ取0.5,参数Dmin的取值从各个数据序列各个时刻的绝对差值的比较来确定,一般Δmin=0。分析结束时系统输出见表 5。
|
|
表 5 PDE5抑制率和共有峰相对峰面积的关联序 Table 5 Correlation of common peak relative peak area and inhibitory rate on PDE5 |
参考文献报道[20]的数据处理方式,计算共有峰与PDE5抑制作用之间的相对关联度(γ0i)评价二者的相关性,各共有峰的相对峰面积与PDE5抑制率之间的关联度γ0i大小排列为峰20>峰23>峰22>峰24>峰3>峰19>峰18>峰21>峰12>峰10>峰9>峰8>峰5>峰15>峰16>峰25>峰13>峰6>峰4>峰1,第1类峰为γ0i>0.880,包括色谱峰20、22、23、24;第2类峰为0.800<γ0i<0.880,包括色谱峰3、5、8、9、10、12、18、19、21。第3类峰为0.600<γ0i<0.880,包括色谱峰1、4、6、12、15、16、25。结果提示,PDE5抑制作用的药效是多种成分共同作用的结果。
为进一步确定玛咖提取物中具有PDE5抑制作用的有效成分,采用偏最小二乘(partial least-squares)回归分析方法进行回归建模[22],数据标准化处理后,优化回归模型,最终确定潜变量个数为1,模型误差平方和R2最小为0.891 1,Press残差为3.144 8。
回归方程如下:y=0.808 856+0.001 38 f1-0.0219 f3-0.006 292 f4+0.013 087 f5-0.007 723 f6-0.001 213 f8-0.010 241 f9+0.038 284 f10-0.115 273 f12+0.142 438 f13+0.303 254 f15-0.013 776 f16+0.039 906 f18+0.050 684 f19+0.068 425 f20+0.076 423 f21+0.034 204 f22+0.038 148 f23+0.025 162 f24-0.000 222 f25(y为PDE5抑制率,f1~f25为峰1~25的相对峰面积)。
从回归方程看,与PDE5抑制率呈正相关色谱峰的标准回归系数大小依次为峰15>峰13>峰21>峰20>峰19>峰18>峰10>峰23>峰22>峰24>峰5,呈负相关色谱峰的标准回归系数绝对值大小依次为峰12>峰3>峰16>峰9>峰6>峰4>峰1>峰8>峰25。说明异硫氰酸苄酯(15号峰)和玛咖酰胺类成分(22、23、24号峰)对PDE5抑制作用起正相关,而1、3、4、6号峰等未知成分对PDE5抑制作用起负相关。
3.7.2 活性验证为了进一步证明谱-效关系研究的可靠性,本实验测试了5种玛咖酰胺对PDE5的抑制率,对数拟合得到IC50值,测试结果见表 6。
|
|
表 6 玛咖酰胺对照品对PDE5的IC50值 (x±s±s,n = 3) Table 6 IC50 values of different macamides on PDE5 (x±s,n = 3) |
阳性对照药物西地那非(sildenafil)IC50值为5.98 nmol/L,相比之下,玛咖酰胺类成分具有一定的PDE5抑制活性,IC50值接近10 μmol/L。提示该类成分可能为玛咖提取物抑制PDE5的药效物质基础,此外,玛咖酰胺类成分属于脂溶性物质,根据相似相溶原理,石油醚提取物中玛咖酰胺的量较高,这与谱-效关系研究的结果相符。
4 讨论 4.1 提取溶剂本实验比较了石油醚、正己烷、氯仿对玛咖脂溶性部分的提取效率,得率以干燥药材计,依次为氯仿(10 mg/g)>正己烷(8 mg/g)>石油醚(6 mg/g);色谱峰5(tR=12.631 min)、7(tR=18.820 min)、9(tR=20.281 min)的总峰面积比大小依次是石油醚(73%)>正己烷(62%)>氯仿(50%)。3者的HPLC色谱图相似度大于0.96。考虑到毒性和提取溶剂经济性,提取溶剂采用低沸点(30~60 ℃)石油醚。
4.2 液相条件玛咖石油醚提取物化学成分复杂,为了达到理想的分离效果。本实验考察了溶剂系统、流动相比例及洗脱程序对分析的影响。对于溶剂系统的选择,比较了甲醇-水、甲醇-甲酸水,甲醇-三氟甲酸水、乙腈-水,乙腈-甲酸等体系,从HPLC色谱图看,水相中添加一定比例的酸,改善了色谱峰的分离,同时发现乙腈的洗脱能力比甲醇强,缩短了分析时间,但是同等梯度条件下,乙腈对保留时间小于20 min的成分达不到基线分离,为了使指纹图谱色谱信息最大化,优选甲醇-甲酸水体系;对于流动相比例的选择,增加甲醇的比例,能保证样品充分溶解;对于检测波长的选择,考察了210、220、280 nm 3个波长。在220 nm检测时,减小了溶剂甲醇的干扰,分离效果较佳,玛咖酰胺类成分的响应值较高,色谱信息最丰富。
5 结论本实验采用PDE5酶抑制剂筛选平台,首先对玛咖提高性能力的物质基础进行活性成分追踪。结果表明,玛咖根和叶部位脂溶性成分具有较强的PDE5抑制活性,石油醚部位大于醋酸乙酯和乙醇部位;接着建立了玛咖根部不同提取部位的指纹图谱,结合LC/MS-IT-TOF技术,参考相关文献报道及对照品质谱信息,共从玛咖石油醚提取物中鉴定出3个玛咖酰胺类化合物和生物碱macaridine;同时,揭示了玛咖叶和根须部位中含有与根部类似的化学成分,为拓展玛咖的入药部位提供了实验依据;最后在谱-效关系研究时,采用了灰关联度分析法和偏最小二乘法,指纹图谱中各共有峰所代表化学成分与PDE5抑制作用具有关联性,且药效的发挥是化学成分群共同作用的结果。结合对照品的活性数据,提示玛咖酰胺类成分对PDE5抑制作用贡献较大。本实验所得玛咖石油醚和醋酸乙酯部位的对照指纹图谱特征性较强,含有标志性成分玛咖酰胺,但依然有多数色谱峰所属成分无法推断,所以需进一步研究其他化学成分对PDE5活性的影响,为阐明玛咖药效物质基础提供更全面、可靠的依据。
| [1] | 周严严, 赵海誉. 药用植物玛咖研究新进展[J]. 中国中药杂志, 2015, 40(23):4521–4526. |
| [2] | 陈金金, 赵兵. 玛咖酰胺研究进展[J]. 中草药, 2015, 46(21):3284–3288. |
| [3] | Ganzera M, Zhao J P, Muhammad I, et al. Chemical profiling and standardization of Lepidium meyenii (Maca) by reversed phase high performance liquid chromatography[J]. Chem Pharm Bull, 2002, 50(7): 988–991. DOI:10.1248/cpb.50.988 |
| [4] | 潘明佳, 时圣明, 王文倩, 等. 玛咖的化学成分、药理作用及质量评价研究进展[J]. 现代药物与临床, 2015, 30(12):1558–1562. |
| [5] | Zheng B L, He K, Kim C H, et al. Effect of a lipidic extract from Lepidium meyenii on sexual behavior in mice and rats[J]. Urology, 2000, 55(4): 598–602. DOI:10.1016/S0090-4295(99)00549-X |
| [6] | Yang Q, Jin W Wen, Lv X Y, et al. Effects of macamides on endurance capacity and anti-fatigue property in prolonged swimming mice[J]. Pharm Biol, 2016, 54(5): 827–834. DOI:10.3109/13880209.2015.1087036 |
| [7] | Alejandro P F, Diane N, Timothy J M, et al. Neuroprotective effects of Lepidium meyenii (Maca)[J]. Ann NY Acad Sci, 2010, 1199(1): 77–85. DOI:10.1111/j.1749-6632.2009.05174.x |
| [8] | Zsanett H, Simon N, Mark R, et al. Identification of endocannabinoid system-modulating N-alkylamides from Heliopsis helianthoides var. scabra and Lepidium meyenii[J]. J Nat Prod, 2014, 77(7): 1663–1669. DOI:10.1021/np500292g |
| [9] | Hui W, Charles J K, Alejandro P F, et al. Macamides and their synthetic analogs:evaluation of in vitro FAAH inhibition[J]. Bioorg Med Chem, 2013, 21(17): 5188–5197. DOI:10.1016/j.bmc.2013.06.034 |
| [10] | Mario D A, Germana V G, Esther D C, et al. Potent inhibition of human phosphodiesterase-5 by icariin derivatives[J]. J Nat Prod, 2008, 71(9): 1513–1517. DOI:10.1021/np800049y |
| [11] | McKay D. Nutrients and botanicals for erectile dysfunction:examining the evidence[J]. Altern Med Rev, 2004, 9(1): 4–16. |
| [12] | Ning H, Xin Z C, Lin G, et al. Effects of icariin on phosphodiesterase-5 activity in vitro and cyclic guanosine monophosphate level in cavernous smooth muscle cells[J]. Urology, 2006, 68(6): 1350–1354. DOI:10.1016/j.urology.2006.09.031 |
| [13] | Rosenkranz S, Caglayan E, Erdmann1 E. Novel indications for phosphodiesterase type 5 inhibitors[J]. Med Klin, 2007, 102(8): 617–630. DOI:10.1007/s00063-007-1078-4 |
| [14] | 果德安. 中药质量评价及中药注射剂指纹图谱的技术要求实例解析[J]. 中国药品标准, 2000, 1(4):29–32. |
| [15] | 杨英来, 胡芳, 刘小花, 等. 当归补气活性部位的谱-效关系研究[J]. 中草药, 2013, 44(23):3346–3351. |
| [16] | Wang H, Liu Y, Huai Q, et al. Multiple conformations of phosphodiesterase-5:implications for enzyme function and drug development[J]. J Biol Chem, 2006, 281(30): 21469–21479. DOI:10.1074/jbc.M512527200 |
| [17] | Pan Y, Zhang J, Li H, et al. Characteristic fingerprinting based on macamides for discrimination of Maca (Lepidium meyenii) by LC-MS/MS and multivariate statistical analysis[J]. J Sci Food Agric, 2016, 96(13): 4475–4483. DOI:10.1002/jsfa.2016.96.issue-13 |
| [18] | Muhammad I, Zhao J P, Dunbar D C, et al. Constituents of Lepidium meyenii "maca"[J]. Phytochemistry, 2002, 59(1): 105–110. DOI:10.1016/S0031-9422(01)00395-8 |
| [19] | 张维, 张铁, 徐珑峰, 等. 云南种植玛咖不同部分化学成分和抗氧化活性分析[J]. 天然产物研究与开发, 2014, 26(6):813–818. |
| [20] | 张华锋, 刘炯, 张杰, 等. 基于聚类分析和典型相关分析的北柴胡保肝作用谱效关系研究[J]. 中草药, 2013, 44(19):2696–2705. |
| [21] | 杨冰月, 李敏, 任敏, 等. 基于灰色关联度分析法对半夏及其炮制品总有机酸止咳作用的谱-效关系研究[J]. 中草药, 2016, 47(13):2301–2308. |
| [22] | 王园园, 陈景武. 偏最小二乘回归分析在医学中的正确应用[J]. 中国卫生统计, 2010, 27(2):208–209. |
 2017, Vol. 48
2017, Vol. 48


