2. 新疆医科大学公共卫生学院, 新疆 乌鲁木齐 830011;
3. 新疆医科大学 中心实验室, 新疆 乌鲁木齐 830011
2. School of Public Health, Xinjiang Medical University, Urumqi 830011, China;
3. Central Laboratory of Xinjiang Medical University, Urumqi 830011, China
氧化槐果碱(oxysophocarpine,OSC)为苦豆子Sophora alopecuroides L. 种子中提取分离的生物碱[1-2]。近年研究证明,OSC能升高白细胞数、增强机体免疫力,从而起到抗痢疾杆菌、皮肤真菌、阿米巴原虫、滴虫等感染的作用,并有利尿、平喘、抗心律失常等作用[3]。苦豆子含有20余种喹诺里西啶(quinlizidine)类生物碱[4-6],OSC的量较高,在一定条件下可与槐果碱相互转化[7]。
提取OSC的传统方法[8-14]有离子交换萃取法、溶剂萃取法、回流法和水蒸气蒸馏法等。现代方法有超临界流体萃取法、连续逆流液液萃取法、超声提取法[15-18]等。膜萃取为近年来发展迅速的一种萃取方法,包括支撑液膜萃取、微乳液膜萃取、中空纤维膜萃取[19-22]。逆三相膜循环分离萃取是中空纤维膜萃取的分支[23],膜分离萃取和溶剂萃取过程具有较多相似之处,萃取原理基本相同,都由萃取与反萃取2步组成。但是,溶剂萃取中萃取与反萃取是分步进行的,之间的耦合是通过外部设备(循环泵与管线等)实现的,液膜过程的萃取与反萃取则分别发生在膜的两侧界面。而逆三相膜循环萃取分离[24-26]利用聚四氟乙烯膜固定酸碱相界面,酸相和碱相分别在膜的两侧搅拌,有机相在循环泵的作用下在酸碱相之间不停地循环。逆三相膜循环分离萃取与其他方法相比,具有溶剂消耗量低、萃取时间短、成本低、操作简单等优势。
为保证提取物的纯度,本实验利用紫外-可见分光光度法对OSC进行了理化鉴别和定量测定,并采用HPLC法[27-29]测定萃取后OSC的质量分数,为建立萃取物质量标准提供依据。为了提高OSC的萃取率,本实验以OSC的提取率为指标,考察逆三相膜循环萃取提取工艺,采用L16(45) 正交试验对OSC的提取工艺进行探讨,从而确定最佳提取工艺。
1 仪器与试药Agilent 1200-DAD高效液相色谱仪,安捷伦科技公司,包括DAD-G1315C检测器、G1312B脱气机、G1367C自动进样器、G1316B-TCC/SL柱温箱、G1322A二元输液泵;Shim-pack VP-ODS色谱柱(250 mm×4.6 mm,5 μm);UV-2550紫外-可见分光光度计、PRR-2A循环泵,日本岛津公司;JJ-1增力电动搅拌器,金坛市医疗机械厂;KQ-250B型超声波清洗器,昆山市超声仪器有限公司;聚四氟乙烯膜,PTFE膜(聚四氟乙烯膜,是一种膜材料,膜的一种类型),厚度1.2 μm,九江奥泰橡塑有限公司;分液漏斗;三口瓶。
对照品OSC,批号JZ20140508,质量分数99%,购自南京景生物科技有限公司;苦豆子药材采自新疆吐鲁番市鄯善县鲁克沁乡,经新疆医科大学药学院帕丽达教授鉴定为豆科槐属植物苦豆子Sophora alopecuroides L. 的干燥成熟种子;氢氧化钠,天津永晟精细化工有限公司;硫酸,西安化学试剂厂;盐酸、硝酸,四川西陇化工有限公司;磷酸,天津市盛奥化学试剂有限公司;氯仿、石油醚、正丁醇、醋酸乙酯、冰乙酸,均为分析纯;甲醇,色谱纯;实验用水为2次蒸馏水。
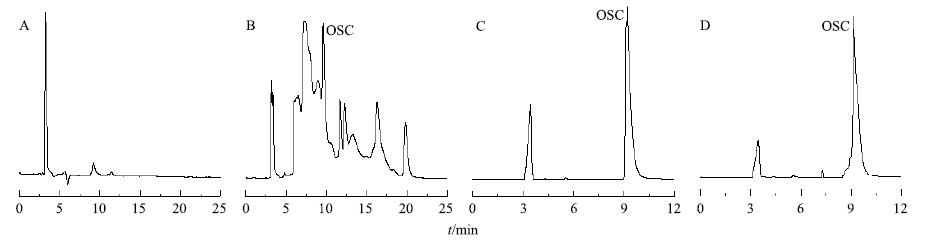
2 方法与结果 2.1 提取物中OSC的定量测定 2.1.1 色谱条件Shim-pack VP-ODS色谱柱(250 mm×4.6 mm,5 μm),流动相为甲醇-0.2%磷酸水溶液(7∶93),梯度洗脱,体积流量1 mg/mL,进样量5 μL,柱温30 ℃,检测波长221 nm。OSC提取液、OSC对照品溶液和苦豆子供试品溶液的色谱图见图 1。
|
图 1 空白 (A)、苦豆子供试品 (B)、OSC对照品 (C) 和OSC提取液 (D) 的HPLC Fig.1 HPLC of blank (A),S. alopecuroides samples (B),oxysophocarpine reference substance (C),and oxysophocarpine extracts (D) |
2.1.2 对照品溶液的制备
精密称取OSC对照品50 mg,0.5 mol/L氢氧化钠水溶液溶解后移入50 mL量瓶内,定容至刻度,摇匀,制成1 mg/mL的对照品溶液,备用。
2.1.3 OSC提取物溶液的制备取苦豆子种子粉末(过40目筛,孔径0.4 mm)0.2 g,置于250 mL三口瓶中,加入0.3 mol/L盐酸水溶液75 mL和氯仿75 mL,在碱相放氢氧化钠溶液75 mL和氯仿75 mL搅拌循环60 min。精密移取提取液,滤过,取续滤液作为OSC提取物的供试品溶液。
2.1.4 苦豆子供试品溶液的制备苦豆子粉碎(过40目筛),称取1 g,加甲醇10 mL,称定质量,超声提取30 min,补足减失的质量,上清液过0.45 μm膜,即为苦豆子供试品溶液。
2.1.5 线性关系考察精密量取OSC对照品溶液0.05、0.50、1.00、1.50、2.00、2.50、3.00、3.50 mL,分别置于5 mL棕色量瓶中,以未加OSC为空白对照,以峰面积值为纵坐标(Y),质量浓度为横坐标(X),得线性回归方程为Y=1 610.90 X-190.06,r=0.997 8,结果表明OSC在0.01~0.7 mg/mL线性关系良好。
2.1.6 精密度试验精密配制0.005、0.01、0.02、0.03、0.04、0.05 mg/L对照品溶液,每个样品重复进样6次,测得吸光度(A)值,计算RSD为0.93%,表明仪器精密度良好。
2.1.7 稳定性试验精密吸取OSC提取物溶液(-4 ℃保存),分别在0、2、4、6、8、9 h进样分析,分别测定色谱峰峰面积。计算RSD为0.88%,表明OSC在9 h内稳定性良好。
2.1.8 重复性试验称取同一批苦豆子药材3份,按“2.1.3”项下方法制备OSC提取物溶液,按“2.1.1”项下色谱条件进样测定,记录HPLC色谱图,测得OSC平均RSD为1.88%,表明方法重复性良好。
2.1.9 回收率试验精密称取苦豆子种子粉末1.00 g(40目),按“2.1.3”项下制备OSC提取物溶液,分别精密加入0.05、0.1、0.3 mg/mL的对照品溶液。按“2.1.1”项下色谱条件进样测定,计算平均回收率为97.47%,RSD为1.95%。
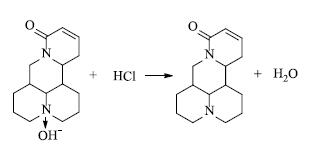
2.2 逆三相膜循环萃取分离OSC的理论分析OSC由于分子结构中氮原子上有1对未共用电子,并且处于并合环之间,立体效应的影响比较小,所以碱性较强,在植物内以盐的形式存在。在酸相中OSC和其他成分都被盐酸萃取出来。在酸相中分子状态的OSC和H+接触时,OSC给出1个OH-而变成游离状态的OSC,见图 2。
|
图 2 >OSC和酸相中H+的化学反应OSC和酸相中H+的化学反应 Fig.2 Reaction of OSC with H+ in acid phase |
OSC中N原子的未对称电子和氯仿中的H+形成氢键,OSC在氯仿中溶解度增加,促进游离态OSC从酸相转移到有机相。萃取OSC的同时也被萃取出来的蛋白质、果胶、纤维素和半纤维素类化合物不能通过PTFE膜,是因为PTFE膜只能通过分子,而不能通过离子。
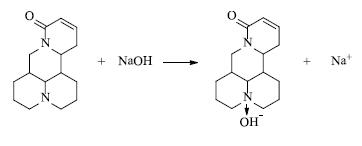
氯仿在循环泵的作用下循环到碱相,接触碱相的OH-时,OSC和OH-发生缔合反应,反应速度快,而且离子状态的OSC不能通过PTFE膜,所以OSC在碱相中富集,见图 3。碱相中的氯仿在循环泵的作用下循环回酸相,在酸碱相中不停地循环而达到富集OSC的目的。
|
图 3 OSC和碱相中OH-的化学反应 Fig.3 Reaction of OSC with OH- in acid phase |
2.3 逆三相PTFE膜循环萃取分离过程
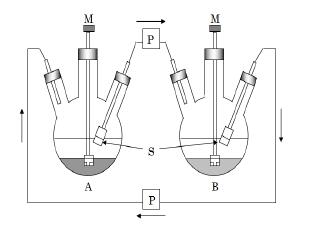
在B瓶中加入OSC、盐酸溶液和75 mL氯仿的混合溶液。在A瓶中加入氢氧化钠溶液和氯仿各75 mL。A、B瓶同时搅拌5 min,使水相和氯仿充分混匀。将分离膜装置插入到A、B瓶中,开始同时搅拌并同步启动循环泵循环氯仿(体积流量6 mL/min),OSC从B瓶中萃取到有机相,有机相通过分离膜和循环泵循环到A瓶。循环一定时间后,B瓶中OSC全部转移至A瓶,碱相中的氯仿在循环泵的作用下循环回到酸相,同时在酸碱相中OSC不停地循环萃取,A、B瓶达到新的萃取平衡。逆三相膜萃取系统示意图见图 4。
|
A-碱相 B-酸相 S-PTFE膜 M-搅拌器 P-循环泵 A-alkali solution B-sulfuric acid solution S-PTFE membrane M-blender P-circulation pump 图 4 逆三相膜萃取系统 Fig.4 Inversephasemembrane extraction system |
2.4 单因素考察实验 2.4.1 水相和有机相体积比对OSC萃取率的影响
在B瓶中加入OSC、0.5 mol/L硫酸和氯仿的混合溶液。在A瓶中加入0.5 mol/L氢氧化钠溶液和氯仿的混合溶液。A、B瓶同时搅拌5 min,使水相和氯仿充分混匀,体积流量6 mL/min下循环35 min(考察循环时间之前,将循环时间设为35 min)。
水相和有机相体积比为0.5∶1、1∶1、1.5∶1、2∶1、2.5∶1、3∶1、4∶1时,OSC的平均萃取率分别为36.65%、57.05%、52.56%、42.90%、41.19%、28.57%、20.49%(n=3)。酸碱相和氯仿体积比0.5∶1时OSC提取率为37.97%。水相溶液越多,细胞内外的浓度差越大,传质推动力也越大,内扩散的速度也越大,有利于OSC的溶出。体积比增大到1∶1时萃取率达到57.05%,超过此比例后,OSC的萃取率逐渐下降,是由于水相溶液的增大导致杂质溶出量增多,而且有机相加入量过低,水相提取液不能与有机相充分接触,引起萃取物不能完全溶解。综合考虑各因素,将体积比1∶1作为萃取OSC的最佳实验条件。
2.4.2 酸相萃取剂在B瓶中加入OSC、不同的酸溶液和氯仿的混合溶液。在A瓶中加入0.5 mol/L氢氧化钠溶液和氯仿各75 mL。A、B瓶同时搅拌5 min,使水相和氯仿充分混匀,体积流量6 mL/min下循环35 min。0.50 mol/L盐酸、0.25 mol/L硫酸、0.50 mol/L硝酸溶液的平均萃取率分别为63.17%、57.48%、53.49%,结果见表 1。用0.50 mol/L盐酸时萃取率最高,因为0.50 mol/L盐酸对植物细胞的穿透能力强,更有利于生物碱的溶解。0.25 mol/L硫酸和0.50 mol/L硝酸的萃取率比盐酸低,可能因为硫酸、硝酸对植物细胞的穿透能力以及和OSC形成氢键的强弱不如盐酸强。所以将0.50 mol/L盐酸溶液作为最佳酸相萃取剂。
|
|
表 1 酸相萃取剂种类对OSC萃取率的影响 (n = 3) Table 1 Effect of different stripping agents on extraction rate of OSC (n = 3) |
2.4.3 盐酸浓度
在B瓶中加入OSC、不同浓度的盐酸和氯仿的混合溶液。在A瓶中加入0.5 mol/L氢氧化钠溶液和氯仿各75 mL。A、B瓶同时搅拌5 min,使水相和氯仿充分混匀,体积流量6 mL/min下循环35 min。盐酸浓度为0.01、0.10、0.20、0.30、0.40、0.50、0.60、0.70、0.80、0.90 mol/L时,OSC的平均萃取率分别为29.07%、42.13%、59.75%、72.95%、68.03%、60.11%、49.73%、42.84%、31.58%、20.28%(n=3)。盐酸浓度在0.01~0.30 mol/L时,盐酸H+和生物碱变成游离状态的生物碱,增大了其在有机相中的溶解度,所以提取率较高,0.30 mol/L时萃取率为72.95%。随着盐酸浓度的继续增加,有机相和生物碱的结合能力不断减弱,OSC在酸相中的溶解度也不断降低。实际选定盐酸浓度在0.30 mol/L。
2.4.4 氢氧化钠浓度在B瓶中加入OSC、0.3 mol/L盐酸和氯仿的混合溶液。在A瓶中加入不同浓度氢氧化钠溶液和氯仿各75 mL。A、B瓶同时搅拌5 min,使水相和氯仿充分混匀,体积流量6 mL/min下循环35 min。OSC在碱相中的萃取率随着OH-浓度增加而增高,氢氧化钠浓度为0.125、0.25、0.5、0.75、1.0、1.25 mol/L时,平均萃取率分别为29.66%、44.68%、64.13%、84.29%、68.29%、51.66%。氢氧化钠浓度在0.75 mol/L时萃取率达到84.29%,OH-浓度再增加时,OSC趋向于成盐状态,在氯仿中的溶解度和萃取率逐渐降低,可能在0.75 mol/L时细胞内外生物碱已达平衡,如果继续增加OH-浓度,提取液中的生物碱浓度会降低,不利于后续分离操作。
2.4.5 循环时间在B瓶中加入OSC、0.30 mol/L盐酸和氯仿的混合溶液。在A瓶中加入0.75 mol/L氢氧化钠溶液和氯仿各75 mL。A、B瓶同时搅拌5 min,使水相和氯仿充分混匀,体积流量6 mL/min下循环一定时间。随提取时间的增加,生物碱的提取率逐渐增加,15、30、45、60、90、120 min的平均萃取率分别为51.83%、84.23%、93.89%、98.97%、97.04%、96.87%。60 min后生物碱的提取率趋于稳定,说明此时细胞内外生物碱已经达到溶解平衡,随提取时间的延长,其他杂质在提取液中的溶出量也会增加,为了减少提取液中其他杂质的溶出量,减轻后续分离工艺的负担,不宜继续延长提取时间,所以将提取时间确定为60 min。
2.5 正交试验优化提取工艺根据以上单因素试验结果,提取次数为3次,采用正交试验设计,选取盐酸浓度(A)、氢氧化钠浓度(B)、提取时间(C)、体积比(D)4个因素,设计每个因素选取4个水平,因素水平见表 2。以OSC萃取率为评价指标,采用L16(45) 正交试验表安排试验,并对试验结果进行单因素方差分析,结果见表 3。由直观分析可知,各因素对提取效果的影响为A>B>C>D,以盐酸浓度影响最大。每个因素4个水平之间的趋势为A2>A3>A1>A4、B3>B4>B2>B1、C4>C2>C3>C1、D1>D4>D2>D3。经方差分析结果(表 6)可知,A、B因素对OSC的提取效果有极显著性影响(P<0.01),C和D因素对OSC的提取效果有显著性影响(P<0.05),因此,从大工业生产和降低成本、节省工时等方面综合考虑,确定最佳萃取工艺为A2B3C4D1,即盐酸浓度为0.30 mol/L、氢氧化钠浓度为0.75 mol/L、提取时间为60 min、体积比为1∶1。
|
|
表 2 L16(45) 正交试验设计及结果 Table 2 Design and results of L16(45) orthogonal test |
|
|
表 3 方差分析 Table 3 Analysis of variance |
为验证上述结果的正确性,保证提取工艺的合理可行,按上述最佳工艺条件,精密吸取“2.1.3”项下提取的OSC提取液,对优选的最佳工艺进行验证,照“2.1.1”项下色谱条件测定提取液中OSC的质量浓度,计算其萃取率。在最佳提取工艺条件下平行进行3组试验,结果OSC萃取率分别为97.41%、98.96%、98.26%,平均萃取率是98.21%。结果表明,该工艺稳定、合理、可靠,可为工业生产提供理论依据。
3 讨论本研究通过单因素试验考察了各提取因素对提取OSC的影响规律。通过正交设计试验得到OSC的最佳提取工艺为水相和有机相溶剂体积比1∶1、盐酸浓度0.30 mol/L、氢氧化钠浓度0.75 mol/L、提取时间为60 min、提取次数3次。按该条件验证试验3次,得到OSC平均萃取率为98.21%。综上所述,本研究优化的提取工艺设计合理,具有一定的重复性和重现性,可作为OSC提取的生产工艺。
在试验因素的考察上,本实验仅选择了盐酸浓度、氢氧化钠浓度和提取时间,尚有溶剂体积比、酸相萃取剂等因素可供选择,其完整的优化工艺有待进一步研究。
对OSC对照品溶液进行紫外扫描,溶剂不同,测出来的最大吸收波长也不同,根据逆三相膜循环萃取分离原理,用氢氧化钠溶液作为溶剂时得到的最大吸收波长215 nm,浓度0.50 mol/L时最大吸收波长为221 nm。为了能在尽量短的时间内获得指标成分的完全分离,本实验比较了甲醇-0.2%磷酸水溶液和甲醇-水的洗脱效果。结果表明使用甲醇-0.2%磷酸水溶液,样品峰可得到完全分离,且峰形良好。预试验发现OSC在实验过程中较不稳定,冰箱冷藏过夜后易变质,无法定量测定。因此,稳定性实验表明样品需在9 h内完成测定。
| [1] | 钱利武, 戴五好, 王丽丽, 等. 槐果碱及氧化槐果碱对小鼠的急性毒性[J]. 中国实验方剂学杂志, 2012, 18(13):256–258. |
| [2] | Zhou Y, Wei Y H, Liu H X, et al. Preparation and in vitro evaluation of ethosomal total alkaloids of Sophora alopecuroides loaded by a transmembrane pH-gradient method[J]. AAPS PharmSciTech, 2010, 11(3): 1350–1358. DOI:10.1208/s12249-010-9509-6 |
| [3] | 刘静. 苦豆子总碱提取与注射液制备及药效学研究[D]. 银川:宁夏大学, 2012. |
| [4] | 冷晓红, 陈海燕, 郭鸿雁, 等. 不同提取方法对苦豆子中氧化槐果碱与槐果碱含量的影响[J]. 西北药学杂志, 2013, 28(5):457–458. |
| [5] | 杨清娥, 张宏利, 韩崇选, 等. 氧化槐果碱的提取分离工艺及其毒性研究[J]. 西北林学院学报, 2006, 21(3):111–113. |
| [6] | 李莉, 张文学, 张顺利. 苦豆子生物碱的免疫调节作用及其作用机制研究进展[J]. 中草药, 2007, 38(4):附7–附8. |
| [7] | 余永婷. 苦豆子生物碱提取分离纯化及抑菌性研究[D]. 乌鲁木齐:新疆农业大学, 2007. |
| [8] | 秦学功. 苦豆子生物碱分离纯化与生物活性研究[D]. 天津:天津大学, 2002. |
| [9] | Rui G, Nannan C, Yan W, et al. Optimized extraction and molecular characterization of polysaccharides from Sophora alopecuroides seeds[J]. Int J Biol Macromol, 2016, 82(1): 231–242. |
| [10] | Chang A H, Zhen C, Zhi H W, et al. Extraction and isolation of alkaloids of Sophora Alopecuroides and their anti-tumor effects in H22 tumor-bearing mice[J]. Afr J Tradit Complem, 2014, 11(2): 245–248. |
| [11] | 李生虎, 张永康, 李勇. 苦豆子植物生物碱的提取及TLC分析[J]. 山东畜牧兽医, 2015, 36(6):12–14. |
| [12] | Lu X, Lin B, Tang J G, et al. Study on the inhibitory effect of total alkaliods of Sophora alopecuroides on osteosarcoma cell growth[J]. Afr J Tradit Complem, 2014, 11(1): 172–175. |
| [13] | Zheng K B, Li C H, Shan X S, et al. A study on isolation of chemical from Sophora flavescens Ait and their anti-glioma effects[J]. Afr J Tradit Complem, 2014, 11(1): 156–160. |
| [14] | Mousavi S H, Motaez M, Zamiri-Akhlaghi A, et al. In-vitro evaluation of cytotoxic and apoptogenic properties of Sophora pachycarpa[J]. Iran J Pharm Res, 2014, 13(2): 665–673. |
| [15] | 郭鸿雁, 冷晓红, 陈海燕, 等. 苦豆子籽总生物碱分离纯化工艺研究[J]. 西部中医药, 2015, 28(10):48–52. |
| [16] | 李军, 郝彩琴, 马小兰, 等. 正交试验法优化苦豆子总生物碱的超声提取工艺[J]. 中国民族民间医药, 2014, 24(8):24–27. |
| [17] | 余永婷. 超声波提取苦豆子生物碱的工艺研究[J]. 中国食品添加剂, 2008, 69(3):69–73. |
| [18] | Yu H G, Wang Z W, Wu Z C, et al. Dynamic membrane formation in anaerobic dynamic membrane bioreactors:role of extracellular polymeric substances[J]. PLoS One, 2015, 10(10): 17–23. |
| [19] | 刘涛, 伍利华, 李鹏程, 等. 清脑复神液精制工艺再评价研究[J]. 中草药, 2015, 46(16):2407–2412. |
| [20] | Björkegren S, Karimi R F, Martinelli A, et al. A new emulsion liquid membrane based on a palm oil for the extraction of heavy metals[J]. Membranes, 2015, 5(2): 168–179. DOI:10.3390/membranes5020168 |
| [21] | Stetter F W, Cwiklik L, Jungwirth P, et al. Single lipid extraction:the anchoring strength of cholesterol in liquid-ordered and liquid-disordered phases[J]. Biophys J, 2014, 107(5): 1167–1175. DOI:10.1016/j.bpj.2014.07.018 |
| [22] | 刘双双, 刘丽芳, 朱华旭, 等. 超滤膜技术用于脉络宁注射液废弃物中多糖分离及其活性筛选研究[J]. 中草药, 2016, 47(13):2288–2293. |
| [23] | 米尔扎提·麦麦提, 尔西丁·买买提, 喀日耶姆·艾海提, 等. 正交试验优化逆三相膜萃取烟碱的工艺研究[J]. 新疆医科大学学报, 2016, 39(11):1436–1439. |
| [24] | Brockmeyer B, Kraus U R, Theobald N. Accelerated solvent extraction (ASE) for purification and extraction of silicone passive samplers used for the monitoring of organic pollutants[J]. Environ Sci Pollut R, 2015, 22(24): 19887–19895. DOI:10.1007/s11356-015-5192-1 |
| [25] | Björkegren S, Karimi R F, Martinelli A, et al. A new emulsion liquid membrane based on a palm oil for the extraction of heavy metals[J]. Membranes, 2015, 5(2): 168–179. DOI:10.3390/membranes5020168 |
| [26] | Liu J, Li W J. Supported liquid membrane extraction technology and its application in detection of meat security[J]. Meat Res, 2010(7): 86–89. |
| [27] | 王晓萍, 石会丽, 李富贤, 等. HPLC法同时测定苦刺花中氧化槐果碱、槐果碱、氧化槐果碱和氧化氧化槐果碱的含量[J]. 陕西中医, 2014, 35(9):1247–1249. |
| [28] | 吴志娇, 赵红, 薛英, 等. HPLC法同时测定氧化槐果碱、槐定碱和氧化槐果碱水[J]. 中国科学院研究生院学报, 2011, 28(3):398–402. |
| [29] | 古丽娜·沙比尔, 阿吉艾克拜尔·艾萨, 石明辉, 等. HPLC同时测定苦豆子中槐定碱、氧化槐果碱和氧化氧化槐果碱的含量[J]. 中国中药杂志, 2007, 32(24):2619–2622. |
 2017, Vol. 48
2017, Vol. 48


