核桃楸皮Cortex Juglandis Mandshuricae为胡桃科(Juglandaceae)胡桃属Juglans L. 植物核桃楸Juglans mandshurica Maxim. 的树皮[1]。原植物核桃楸为落叶乔木,主要分布于我国东北地区(小兴安岭及张广才岭),河北、内蒙古、山西有少量分布,俄罗斯远东地区、朝鲜、日本也有分布[2]。其未成熟果实或果皮、树皮及树叶均可药用,树皮又名楸树皮,味苦性寒,具有清热解毒、止痢明目的功效,主治泄泻、痢疾、白带、目赤[3]。现代研究表明,核桃楸皮具有抗氧化、抗菌、消炎、抗癌等作用[4],特别是抗肿瘤作用尤为显著,其作用机制成为研究热点[5-8]。目前,关于核桃楸皮化学成分的研究报道相对较少,主要为黄酮类化合物[9-13]。其药效物质基础尚不明确,作用机制研究无的放矢,质量控制研究集中于总黄酮和槲皮素定量检测[14-15],缺乏专属性。因此,明确核桃楸皮主要化学成分组成,对于开展药效学及质量控制领域的深入研究、促进药用资源的开发和利用具有重要的意义。
超高效液相色谱(UPLC)通过在色谱柱上使用小颗粒填料以及其他部件的改进,具有更高的分离度、更快的分析速度和更大的峰容量等优点。四级杆-飞行时间串联质谱(Q-TOF)为高分辨质谱仪,不仅具有高分辨、高选择性的特点,通过精确的分子质量快速确定化合物分子式,还可以通过高低能碰撞扫描,提供丰富的二级质谱信息,再通过对照品比对及裂解规律分析,从而鉴定或推断化合物结构。近年来,将液相色谱的高效分离能力和质谱的高灵敏度相结合,尤其是与高分辨质谱和多级质谱联合使用的技术手段,已广泛应用于中草药成分的分析,为研究天然产物开辟了全新的途径[16-18]。
相同科属药用植物不同部位往往具有相似的化学成分组成,在前期总结胡桃科药用植物中268种已报道化合物的一级质谱数据,以及研究一系列对照品二级质谱裂解规律的基础上,本实验采用超高效液相色谱-四极杆飞行时间质谱(UPLC-Q- TOF/MS)技术对核桃楸皮样品进行在线分离分析研究,利用UPLC一维的保留时间锁定化合物,通过二维的精确质量数和同位素峰度比确定分子式,再通过对照品比对或质谱裂解规律分析确定或推断其结构式,揭示其药效物质基础。以期为核桃楸皮质量评价指标及药效机制研究对象的选择提供科学依据,亦为胡桃属药用植物类似化学成分的质谱裂解途径研究提供借鉴和参考。
1 仪器与材料ACQUITY UPLC(美国Waters公司,包括二元高压梯度泵、真空脱气机、自动进样器、柱温箱);AB SCEIX Triple-TOFTM 5600+质谱仪(美国AB SCIEX公司,配有ESI源和APCI源),数据采集软件为Analyst TF 1.6 software(美国AB SCEIX公司);数据处理软件系统为Peakview 2.0/masterview 1.0 software、Markerview 1.2.1(美国AB SCEIX公司);Waters Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),AQUITY UPLC BEH C18 VanGuard Pre-Column预柱(5 mm×2.1 mm,1.7 μm);KQ-300DB型数控超声仪(昆山市超声仪器有限公司);BSA224S-CW型电子天平(赛多利斯科学仪器公司);LG16-W型高速离心机(北京京立离心机有限公司)。
甲醇(分析纯,天津市科密欧化学试剂有限公司),乙腈(色谱纯,Merck,德国),甲酸(色谱纯,Fisher,美国),蒸馏水(广州屈臣氏食品饮料有限公司)。
核桃楸皮药材于2014年7月29日采自黑龙江省宾县铜矿地区,取3个采样点,每个采样点采集2份样品。均经黑龙江省中医药科学院初东君主任药师鉴定为胡桃属植物胡桃楸Juglans mandshurica Maxim. 的树皮,置通风处阴干,15 d后粉碎成细粉用于样品制备。
对照品胡桃醌(批号H-075-131230)、花旗松素(批号E-001-151114)均由成都瑞芬思生物科技有限公司提供,经HPLC质量分数均大于98%。
2 方法 2.1 对照品溶液的制备精密称取胡桃醌、花旗松素对照品适量,加甲醇分别制成约50 μg/mL的溶液作为对照品溶液。
2.2 供试品溶液的制备取不同采样点核桃楸皮各2.0 g,精密称定,分别加甲醇25 mL超声处理(功率300 W,频率40KHz)30 min,放冷,补足甲醇,摇匀,滤过,取续滤液13 000 r/min离心5 min,取上清液,即得。
2.3 色谱条件和质谱条件色谱条件:Waters Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),AQUITY UPLC BEH C18 VanGuard Pre-Column 预柱(100 mm×2.1 mm,1.7 μm),柱温30 ℃,流动相0.1%甲酸水(A)- 0.1%甲酸乙腈(B),梯度洗脱(0~3 min,5%~22% B;3~15 min,22%~60% B;15~20 min,60%~70% B;20~29 min,70%~100% B;29~30 min,100% B;30~30.1 min,100%~5% B;30.1~35 min,5% B),体积流量0.3 mL/min,进样量2 μL。
质谱条件:采用ESI离子源,离子化模式为电喷雾正离子模式,离子源电压为5 500 V,离子源温度为 550 ℃,裂解电压(DP)为80 V,碰撞能量(CE)为35 eV,碰撞能量扩展(CES)为15 eV。雾化气体为氮气,辅助气Gas1为379.2 kPa,辅助气Gas2为379.2 kPa,气帘气Cur Gas为241.3 kPa。一级质谱母离子扫描范围为80~1 500,IDA 设置响应值超过100 cps的8个最高峰进行二级质谱扫描,子离子扫描范围为50~1 500,开启动态背景扣除(DBS)。数据采集软件为Analyst TF 1.6 software;数据处理软件系统为Peakview 2.0/masterview 1.0 software、Markerview 1.2.1。
2.4 数据分析分别吸取胡桃醌、花旗松素对照品及各供试品溶液,进样测定,记录UPLC-MS色谱图,用于数据分析。
2.4.1 目标性筛查通过查阅国内外相关文献,将胡桃属植物化学成分信息汇总,包括分子式、相对分子质量、名称(中、英文)、CAS号、结构式、所属文献来源、所属植物药用部位、成分类型、结构鉴定信息(质谱、氢谱、碳谱等),并且根据已发表文献不断进行成分的补充,形成的一个包含胡桃属植物268种化合物一级质谱的数据库。使用peakview2.0软件中的MasterView功能载入已选择的数,设置Mass Error(质量数偏差)<5×10-6;权重30%,Isotope(同位素分布)差异<10%;权重40%,Formula Finder score(分子式查找)>70%;权重40%,利用masterview 1.0软件目标筛查功能对组分样本进行筛查。
2.4.2 非目标性筛查将采集数据导入Marker View软件,通过peak finding options功能将数据中所有色谱峰按照设置参数母离子强度>3 000 counts,S/N>10;MAX Element C50H200O50提取出来;系统可以显示该离子在6个样本内的XIC峰面积变化,选择共有且响应强度较大的离子作为结构分析的重点化合物。
2.5 结构鉴定在正负离子模式下,大多数化合物会产生 [M+H]+或 [M-H]-分子离子,Triple TOFTM5600+高分辨质谱能够在5×10-6误差范围内测定大多数离子的精确质量数,并准确测定同位素丰度比。因此,通过Peakview 2.0 software软件的Formula Finder功能,依据精确质量数及同位素丰度比可确定化合物的分子式。对于有对照品的化合物,进一步比对保留时间及二级质谱信息进行结构鉴定;对于无法获得对照品的化合物,首先依据其碎片离子的精确质量数计算其碎片组成,对比chemspider数据库给出的可能结构式,再研究相似结构化合物的质谱裂解规律,通过Peakview 2.0软件分析化合物质谱裂解特征以及文献对比,结合二级谱图相似度,从而推测化合物结构。
3 结果 3.1 UPLC-Q-TOF/MS分析经过色谱条件和质谱条件的优化,按照“2.3”及“2.4”项条件分析,对照品及供试品溶液在正负离子模式下,均获得了良好的分离效果及离子化效率,其总离子流图见图 1。

|
图 1 胡桃醌 (A)、花旗松素 (B) 对照品和核桃楸皮供试品的正 (C)、负 (D) 离子模式下的TIC图 Fig.1 TIC chromatograms of juglone (A),taxifolin (B) reference substance and Cortex Juglandis Mandshuricae in ESI+(C) and ESI- (D) mode |
3.2 结构鉴定
鉴定或推断了核桃楸皮中44个化合物的结构,包括13个萘醌类化合物,3个二芳基庚烷类化合物,15个黄酮类化合物及13个其他类化合物,结果见表 1。
|
|
表 1 核桃楸皮共有离子结构信息 Table 1 Characterization of common chemical constituents in Cortex Juglandis Mandshuricae by UPLC-ESI-Q-TOF/MS |
3.2.1 萘醌类
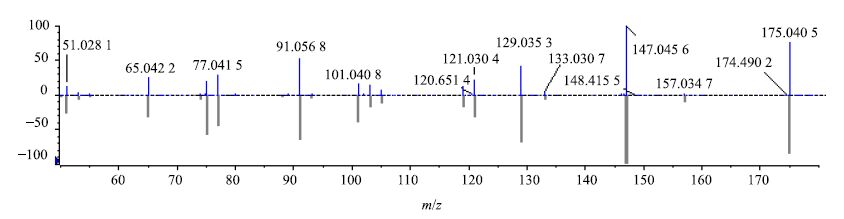
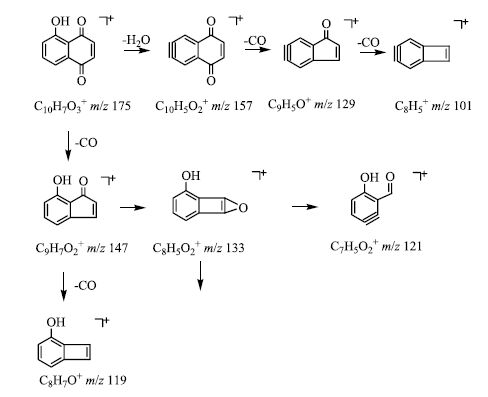
萘醌类化合物是核桃属植物中主要的抗肿瘤活性物质[19],准分子离子连续失去H2O和CO是其典型的质谱裂解规律[20-21]。以化合物2为例,其准分子离子175 [M+H]+丰度比较高,易失去CO中性碎片形成丰度最高的147 [M+H-CO]+碎片离子,此离子再失去CO形成119 [M+H-2CO]+碎片离子,同时147 [M+H-CO]+碎片离子在高能碰撞下发生开环反应形成133 [M+H-CO-CH2]+、121 [M+H-CO-C2H2]+两个丰度较小的碎片离子,准分子离子175 [M+H]+亦能丢失1分子H2O形成丰度较小的157 [M+H-H2O]+离子,并连续丢失CO碎片形成129 [M+H-H2O-CO]+、101 [M+H-H2O-2CO]+碎片离子。此裂解途径与胡桃醌对照品二级碎片基本吻合,因此,鉴定化合物2为胡桃醌,其二级质谱、裂解可能途径分别见图 2、图 3。
|
图 2 化合物2二级质谱图及对照品比对镜像图 Fig.2 MS/MS spectrum for compound 2 |
|
图 3 化合物2结构解析图 Fig.3 Chemical structure and fragmentation pathway for compound 2 |
3.2.2 二芳基庚烷类
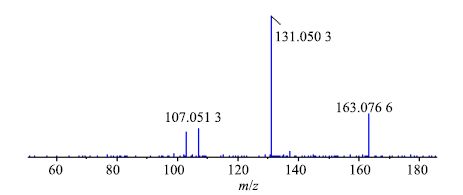
二芳基庚烷类化合物是一类比较特殊的天然产物,其特点是2个特征性很强的芳环与七碳线型长链相连,此类成分是胡桃属植物中另一类重要的抗肿瘤活性成分[19]。关于此类化合物的质谱裂解规律很少报道,以17号化合物为例,对其质谱裂解规律进行了初步的推断。其准分子离子327 [M+H]+丰度极低,易失去右侧的芳环并发生重排形成163 [M+H-C10H12O2]+碎片离子,同时也极易失去左侧的芳环后发生重排形成207 [M+H-C8H8O]+碎片离子,此离子进一步发生裂解并重排后环合形成丰度最大的131 [M+H-C11H16O3]+碎片离子,此碎片离子开环形成107 [M+H-C13H16O3]+及103 [M+H-C12H16O4]+碎片离子。综合以上信息,并结合文献报道,推断化合物17为1-(4′-羟基苯基)-7-(3″-甲氧基-4″-羟基苯基)-4-烯-3-庚酮,其二级质谱、裂解可能途径分别见图 4和5。
|
图 4 化合物17二级质谱图 Fig.4 MS/MS spectrum for compound 17 |

|
图 5 化合物17结构解析图 Fig.5 Chemical structure and fragmentation pathway for compound 17 |
3.2.3 黄酮类
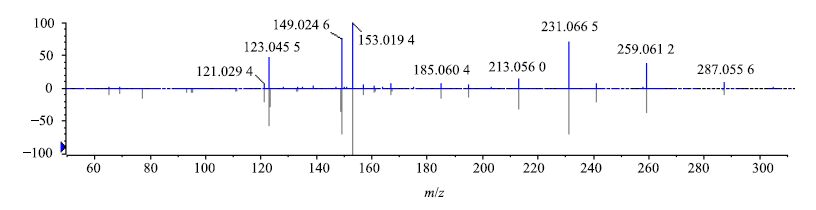
黄酮类成分是广泛存在于自然界的一大类化合物,多种黄酮类化合物都具有明显的抗肿瘤和逆转肿瘤细胞多药耐药作用,但黄酮类成分没有萘醌类和二芳基庚烷类化合物作用显著[19]。关于此类化合物的质谱裂解规律报道较多[20-21],以36号化合物为例,其正离子模式下,准分子离子305 [M+H]+丰度比较低,说明在此电压下碎裂程度高,易失去B环形成丰度最高的153 [M+H-C8H8O3]+碎片离子,此离子进一步失去2个O形成123 [M+H-C8H6O5]+碎片离子,同时305 [M+H]+碎片离子C环上易失去一分子H2O形成287 [M+H-H2O]+碎片离子,此碎片进一步裂解失去2分子CO分别形成259 [M+H-H2O-CO]+及231 [M+H-H2O-2CO]+碎片离子,同时259 [M+H-H2O-CO]+失去B环并发生重排而形成121 [M+H-C8H8O5]+及149 [M+H-H2O-CO-C6H6O2]+ 2个碎片离子,此二级碎片信息与对照品二级碎片完全吻合。综合以上信息,推断化合物36为花旗松素,其二级质谱、裂解可能途径以及离子碎片数据计算分别见图 6和7。
|
图 6 化合物36二级质谱图 Fig.6 MS/MS spectrum for compound 36 |
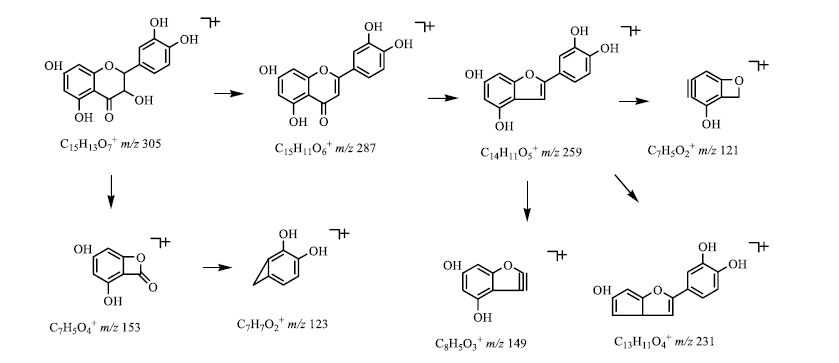
|
图 7 化合物36结构解析图 Fig.7 Chemical structure and fragmentation pathway for compound 36 |
4 讨论
本研究采用UPLC-Q-TOF/MS联用技术,首次对核桃楸皮的化学成分进行了研究。对核桃楸皮的44种主要化学成分进行鉴定或推断。这44种成分在不同海拨、不同树龄、不同生境(阴阳坡、伴生植物等)的3个采样点的6个样本中均稳定出现,说明这些化合物是核桃楸皮的主要药效物质基础,可选取其中药理活性较强的化合物对核桃楸皮质量进行评价和控制。
本研究发现的核桃楸皮中44种化学成分,黄酮类化合物15种,是主要的化学物质组成,这与核桃楸果皮以醌类、二芳基庚烷为主要的化学组成存在差异。黄酮类成分没有萘醌类和二芳基庚烷类化合物作用显著,但核桃楸皮具有良好的抗肿瘤活性,可能与新颖结构的黄酮化合物具有明显的抗肿瘤和逆转肿瘤细胞多药耐药作用有关,值得深入研究。
本研究为核桃楸皮的化学成分鉴定提供了一种高效的分析方法,该方法能够在较短时间内完成化学成分分析的工作,避免了从粗提物纯化才能鉴别的繁琐过程以及结构的变化,在核桃科植物化学成分研究基础上,实现核桃楸皮多组分的结构鉴定与推断。但高分辨质谱技术在结构鉴定方面依然存在一定的局限性,本研究鉴定的化合物大多数源于目标筛查,而非目标筛查获得的化合物结构确认较为困难。高分辨质谱技术可根据碎片精确质量数确定碎片结构,可区分差异母核的同分异构体。但对于结构高度相似的同分异构体——“同分类构体”,例如,取代基取代不同位点的确认,几何构型、糖基的连接位置,仍需要进一步结合核磁共振技术进行分析,获得化合物的准确结构。因此,笔者认为液质联用技术高通量的在线分析与传统植物化学的单一成分的精细鉴定相结合将有力推动中药的化学成分研究。
| [1] | 赵守讯, 黄泰康, 丁志遵, 等. 中药辞海(第三卷)[M]. 北京: 中国医药科技出版社, 1996. |
| [2] | 朱有昌. 东北药用植物[M]. 哈尔滨: 黑龙江省科技出版社, 1989. |
| [3] | 中国科学院中国植物志编委会. 中国植物志(第二十一卷)[M]. 北京: 科学出版社, 1979. |
| [4] | 易醒, 谢明勇, 肖小平. 胡桃科植物化学及生物活性研究概况[J]. 中草药, 2001, 32(6):559–561. |
| [5] | 李岩, 辛念, 李玉娟, 等. 核桃楸树皮提取物抗肿瘤及免疫调节作用的研究[J]. 北京理工大学学报, 2011, 31(5):618–621. |
| [6] | 林瑞新, 杨淑莉, 房学东, 等. 核桃楸树皮乙酸乙酯提取物对原位移植荷胃癌小鼠的抑瘤作用[J]. 吉林大学学报:医学版, 2011, 37(2):260–263. |
| [7] | 潘丽艳, 郭喜平, 李淑红, 等. 胡桃楸树皮提取物对SMMC-7721、MCF-7和A549肿瘤细胞的抑制作用及其机制[J]. 吉林大学学报:医学版, 2009, 35(1):124–127. |
| [8] | 蔡小燕, 张咏莉. 中药材核桃楸皮单体抗肿瘤作用及分子机理研究现状[J]. 海峡药学, 2013, 25(8):13–17. |
| [9] | 石建辉, 王金辉, 车东, 等. 核桃楸树皮化学成分研究[J]. 中药研究与信息, 2005, 7(1):7–8. |
| [10] | 石建辉, 王金辉, 袁征, 等. 核桃楸皮的化学成分[J]. 沈阳药科大学学报, 2006, 23(8):501–504. |
| [11] | Kim S H, Lee K S, Son J K, et al. Cytotoxic compounds from the roots of Juglans mandshurica[J]. J Nat Prod, 1998, 61: 643–645. DOI:10.1021/np970413m |
| [12] | Lee K S, Li G, Kim S H, et al. Cytotoxic diarylhetanoids from the roots of Juglans mandshurica[J]. J Nat Prod, 2002, 65: 1707–1708. DOI:10.1021/np0201063 |
| [13] | Li G, Xu M L, Choi H G, et al. Four new diarylheptanoids from the roots of Juglans mandshurica[J]. Chem Pharm Bull, 2003, 51(3): 262–264. DOI:10.1248/cpb.51.262 |
| [14] | 孟令锴, 常乐, 雷涛, 等. 核桃楸皮总黄酮含量测定[J]. 牡丹江医学院学报, 2011, 32(5):5–7. |
| [15] | 雷涛, 孟繁钦, 吴宜艳, 等. 核桃楸皮槲皮素含量测定[J]. 实验室科学, 2012, 15(1):88–90. |
| [16] | 郭宜城, 欧阳辉, 何明珍, 等. UPLC/Q-TOF-MS/MS鉴定西南银莲花中的皂苷类成分[J]. 中草药, 2014, 45(10):1378–1386. |
| [17] | 张水寒, 蔡萍, 陈林, 等. 高效液相色谱-四级杆-飞行时间串联质谱分析雪峰虫草化学成分[J]. 中草药, 2015, 46(6):817–821. |
| [18] | 李振华, 徐金娣, 鞠建明, 等. 川楝子水提化学成分的UPLC-ESI-Q-TOF-MS分析[J]. 中草药, 2015, 46(4):496–501. |
| [19] | 周媛媛, 王栋. 胡桃属植物抗肿瘤作用化学成分研究进展[J]. 中国药房, 2010, 21(43):4119–4120. |
| [20] | 吴立军. 天然药物化学[M]. 北京: 人民卫生出版社, 2005. |
| [21] | 刘淑莹, 宋凤瑞, 刘志强. 中药质谱分析[M]. 北京: 科学出版社, 2012. |
 2017, Vol. 48
2017, Vol. 48


