秦艽Gentianae Macrophyllae Radix为龙胆科龙胆属多年生草本植物,为临床常用中药,《中国药典》2015年版规定其来源为秦艽Gentiana macrophylla Pall.、麻花秦艽Gentiana straminea Maxim.、粗茎秦Gentiana crassicaulis Duthie ex Burk.和小秦艽Gentiana dahurica Fisch.的干燥根[1]。秦艽是重要的传统中药之一,被列为中品,《神农本草经》记载其味苦、平,性微寒,可祛风湿、舒筋络、清虚热、利湿退黄[2]。
环烯醚萜苷类、黄酮类及三萜类不仅是秦艽的标志性化学成分,也是整个龙胆属植物的特征性化学成分,此外,秦艽中还含有木脂素类等化学成分。近年来,针对秦艽化学成分及药理作用的系统性报道较少,因此,本文对近20年来秦艽的化学成分、药理作用研究进行综述,以期为秦艽的进一步研究和开发提供参考。
1 化学成分 1.1 环烯醚萜苷类根据环烯醚萜母核中环戊烷环的C7-C8键是否发生断裂又可以将环烯醚萜苷类进一步分为裂环环烯醚萜苷类和环烯醚萜苷类。
1.1.1 裂环环烯醚萜苷类日本学者Herrissey于1905年首次用灭菌法得到龙胆苦苷(1),并确定其化学结构,为秦艽中量最高的化学成分,也是秦艽中主要活性成分及苦味成分[3-6]。保肝制剂秦龙苦素粉末注射剂(龙胆苦苷单体)已经处于Ⅲ期临床阶段(批准号2003L03260),同时,龙胆苦苷的提取、分离、纯化技术也在不断改善优化[7-9]。吴靳荣等[10]采用HPLC法测定了秦艽中獐牙菜苦苷(2)、獐牙菜苷(3)及6′-O-β-D-glucopyranosylgentiopicroside(4)的量,发现其在秦艽中的量也较高。He等[11]首次从粗茎秦艽中分得6′-O-β-D-xylopy-ranosylgentio picroside(5)、gentiananoside A~D(6~9),并通过核磁共振氢谱确定其化学结构。He等[11]相继从秦艽中分离得到olivieroside C(10)、scabran G3(11)、scabran G4(12)、(R)-gentiolacton(13)、6β-hydroxy-swertia japoside A(14)、swerimilegenin H(15)与swerimilegenin Ⅰ(16)。Lv等[12]从粗茎秦艽中分离得到秦艽苷A、B(17、18)和4′-O-β-D-glucopyranosyl-gentiopicroside(19),发现秦艽苷A抗炎活性较好(IC50为0.05 μmol/L)。Fan等[13]首次从小秦艽中分离得到龙胆苦苷乙酰基取代物6′-O-acetylgentiopicroside(20)与3′-O-acetylgentiopi-croside(21),并通过核磁共振氢谱确定其化学结构。Wei等[14]采用LC-UV-ESI-MS法从麻花秦艽中分离鉴定出7(S)-n-butyl-morroniside(22)、7(R)-n-butyl-morroniside(23)、2′-O-(2, 3-hydroxyl-benzoyl)-sweroside(24)、6′-O-(2-hydroxyl-3-O-β-D-glucopy-ranosyl-benzoyl)-sweroside(25)。Tan等[15]首次从秦艽中分离得到紫药苦苷(26)、三花苷(27)、rindoside(28)、大叶苷A(29)、大叶苷B(30)。Jiang等[16]首次从秦艽中分离得到(Z)-5-ethylidene-3, 4, 5, 6-tetrahydro-cis-6, 8-dimethoxy-1H, 8H-pyrano [3, 4-c] pyran-1-one(31)与gentima-croside(32)。Xu等[17]采用反复柱色谱法从麻花秦艽中分离得到了3个新的环烯醚萜苷类成分,即secologanic acid(33)、gentiastraminoside A(34)和gentiastraminoside B(35)。秦艽中裂环环烯醚萜苷类成分见表 1,结构见图 1。
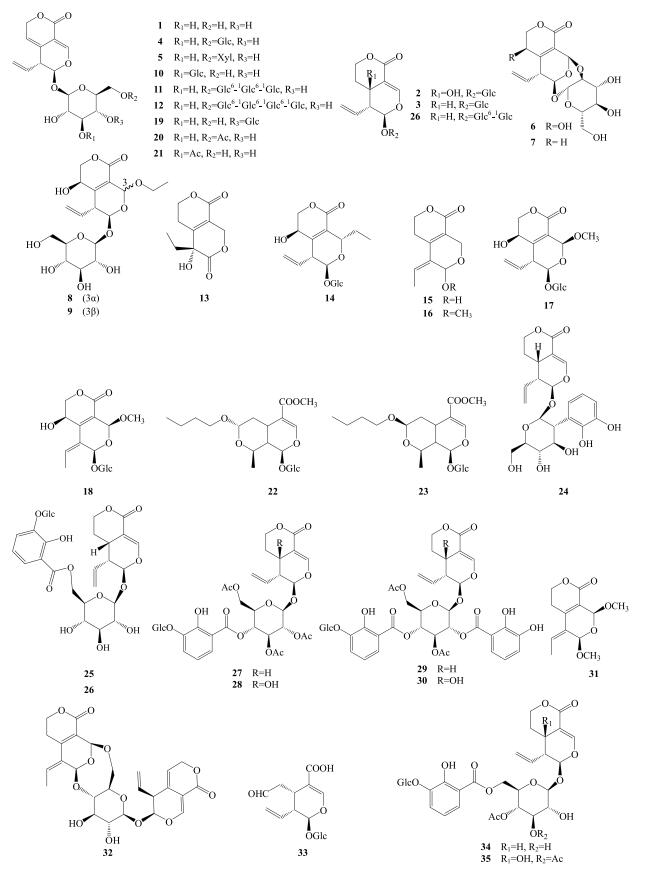
|
图 1 秦艽中裂环环烯醚萜苷类化合物结构 Fig.1 Structures of secoiridoids from Gentianae Macrophyllae Radix |
|
|
表 1 秦艽中裂环环烯醚萜苷类成分 Table 1 Secoiridoids from Gentianae Macrophyllae Radix |
1.1.2 环烯醚萜苷类
Lv等[12]从粗茎秦艽中分离得到新的环烯醚萜苷类化合物秦艽苷C(36),并运用核磁共振氢谱解析其结构,此外,还分离得到了马钱苷酸(37)及其葡萄糖基取代物6′-O-β-D-glucopyranosyl loganic acid(38)。Wang等[18]从小秦艽中分离得到环烯醚萜苷类化合物loganin(39)、epi-kingiside(40)、kingiside(41),并发现其抗炎作用并不显著。Chen等[19]用柱色谱法从秦艽中分离得到哈巴苷(42)。Pan等[20]从麻花秦艽中发现了11-O-β-D-gluucopyranosyl loganoate(43)。Zeng等[22]从秦艽中分离得到山栀苷甲酯(44)。环烯醚萜苷类成分见表 2,结构式见图 2。
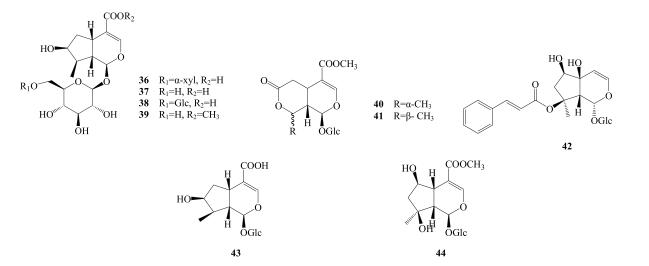
|
图 2 秦艽中环烯醚萜苷类化合物结构 Fig.2 Structures of iridoids from Gentianae Macrophyllae Radix |
|
|
表 2 秦艽中环烯醚萜苷类成分 Table 2 Iridoids from Gentianae Macrophyllae Radix |
1.2 木脂素类
Lv等[12]从粗茎秦艽中分离得到木脂素berchemol-4′-O-β-D-glucoside(45)。Wang等[18]从小秦艽中分离得到liriodendrin(46)、7S, 8R, 8R′-(−)-lariciresinol-4-O-β-D-glucopyranosy-4′-O-(2-O-β-D-glucopyranosy)-β-D-glucopyranoside(47)、syringaresinol-β-D-glucopyranoside(48)、laricresinol-4′-β-D-glucopyranoside(49)、dehydrodiconiferyl alcohol-4, γ′-di-O-β-D-glucopyranoside(50),发现它们的抗炎作用并不显著。木脂素类成分见表 3,结构见图 3。
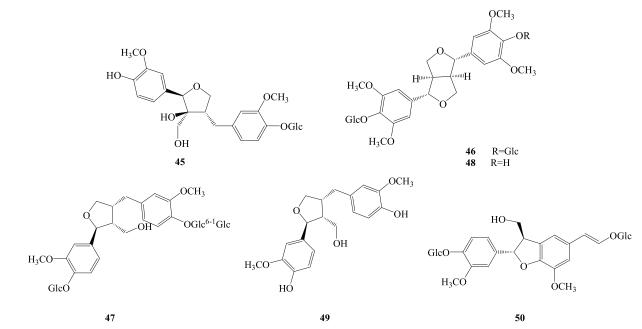
|
图 3 秦艽中木脂素化合物结构 Fig.3 Strctures of lignans from Gentianae Macrophyllae Radix |
|
|
表 3 秦艽中木脂素类成分 Table 3 Lignans from Gentianae Macrophyllae Radix |
1.3 黄酮类
Tan等[15]首次从秦艽中分离得到黄酮类化合物苦参酮(51)与苦参新醇(52),Liang等[23]微波提取辅助高速逆流色谱法从粗茎秦艽中分离得到异红草苷(53)。秦艽中黄酮类成分见表 4,结构见图 4。
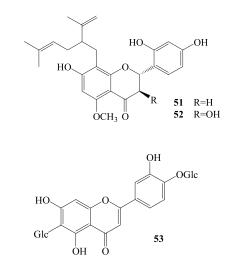
|
图 4 秦艽中黄酮类化合物结构 Fig.4 Structures of flavonoids from Gentianae Macrophyllae Radix |
|
|
表 4 秦艽中黄酮类成分 Table 4 Flavonoids from Gentianae Macrophyllae Radix |
1.4 三萜类
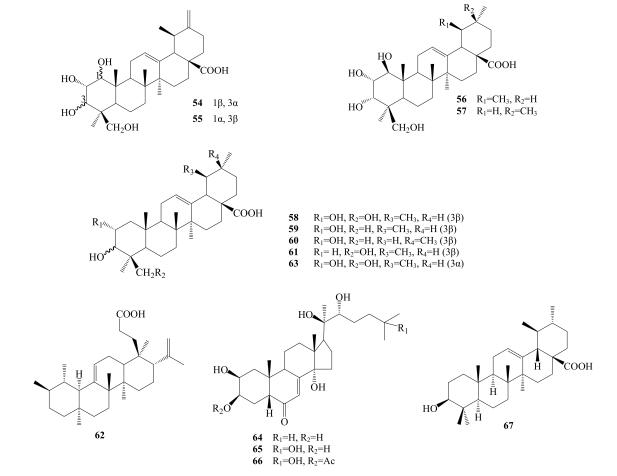
Fan等[13]首次从小秦艽中分离出三萜类化合物1β, 2α, 3α, 24-tetrahydroxyursa-12, 20(30)-dien-28-oic acid(54)、1α, 2α, 3β, 24-tetrahydroxyursa-12, 20(30)-dien-28-oic acid(55)、1β, 2α, 3α, 24-tetrahydroxyurs-12-en-28-oic acid(56)、1β, 2α, 3α, 24-tetrahydroxyolean-12-en-28-oic acid(57)、2α, 3β, 24-trihydroxyurs-12-en-28-oic acid(58)、2α-hydroxyursolic acid(59)、maslinic acid(60)、3β, 24-dihydroxyurs-12-en-28-oic acid(61)。Wang等[18]从小秦艽中分离得到栎瘿酸(62)、2α, 3α, 24-trihydroxyolean-12-en-28-oic acid(63)、ajugasterone C(64)、20-hydroxyecdysone(65)、20-hydroxyecdysone-3-acetate(66)。Jiang等[16]首次从秦艽中分离得到熊果酸(67)。秦艽中三萜类成分见表 5,结构见图 5。
|
图 5 秦艽中三萜类化合物结构 Fig.5 Structures of triterpenoids from Gentianae Macrophyllae Radix |
|
|
表 5 秦艽中三萜类成分 Table 5 Triterpenoids from Gentianae Macrophyllae Radix |
1.5 其他类
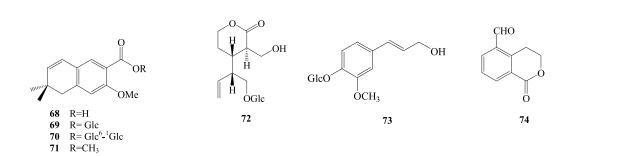
Tan等[15]首次从秦艽中分离得到2-甲氧基鳝藤酸(68)、大叶苷C(69)、大叶苷D(70)与2-methoxyanofinicmethyl ester(71)。Wang等[18]从小秦艽中分离得到1-O-β-D-glucopyranosyl-amplexi(72)与coniferin(73)。Jiang等[16]首次从秦艽中分离得到红白金花内酯(74)。秦艽中其他类成分见表 6,结构见图 6。
|
图 6 秦艽中其他成分化学结构 Fig.6 Structures of other constituents from Gentianae Macrophyllae Radix |
|
|
表 6 秦艽中其他成分 Table 6 Other constituents from Gentianae Macrophyllae Radix |
2 药理作用 2.1 抗炎、镇痛作用
秦艽在应用于抗炎、镇痛时多采用乙醇提取,龙胆苦苷(1)和獐牙菜苦苷(2)是其抗炎的主要活性成分。赵勤等[24]发现分别ig给予大鼠2.5、5、10 g/kg麻花秦艽95%醇提物均可显著改善佐剂性关节炎模型大鼠关节肿胀,而对大鼠免疫器官没有明显的损伤。王佳等[25-26]以胶原诱导大鼠关节炎模型,发现ig给予0.9 g/kg大叶秦艽60%或70%醇提物后可改善滑膜炎症状,保护关节,其作用机制可能与降低血清中Th1型细胞因子γ干扰素(INF-γ)、抗环瓜氨酸肽抗体与肿瘤坏死因子-α(TNF-α)水平及升高血清白细胞介素-4(IL-4)水平有关。牛筛龙等[27]通过体内实验发现,分别ig给予0.8 g/kg和0.4 g/kg大叶秦艽总环烯醚萜苷均能够抑制二甲苯致小鼠耳廓肿胀与醋酸致小鼠腹腔毛细血管通透性增加(炎症早期)、大鼠气囊滑膜炎(炎症中期)、小鼠棉球肉芽肿(炎症后期),其作用机制可能与抑制炎性因子的渗出、消除自由基和抑制脂质过氧化有关。高祥祥等[28]观察了秦艽30%醇提取物对尿酸钠痛风大鼠模型的作用,结果显示1.0 g/kg秦艽乙醇提取物可以通过下调血清TNF-α、白细胞介素-1β(IL-1β)、白细胞介素(IL-6)、前列腺素E2(PGE2)和基质金属蛋白酶-3(MMP-3)水平来改善大鼠关节肿胀症状。Yu等[29]发现ig给予佐剂性关节炎大鼠0.1 g/kg大叶秦艽70%乙醇提取物可显著降低大鼠炎性组织中PGE2水平,进而改善大鼠关节肿胀症状,其抗炎作用与强的松相当。林清等[30]发现2 g/kg秦艽70%醇提物可显著改善大鼠的足趾肿胀程度、减少冰醋酸致小鼠扭体次数与提高小鼠的痛阈值。Jia等[31]研究发现分别ig 0.6、0.3、0.15 g/kg的大叶秦艽或麻花秦艽75%乙醇提取物均能够改善二甲苯诱导的小鼠耳廓肿胀(急性炎症)及角叉菜胶诱导的大鼠足趾肿胀(亚急性炎症)程度,其作用机制可能与抑制细胞核因子-κB(NF-κB)转录活性与p65、p50(NF-κB家族成员)二聚体的核移位有关。
研究报道[32]ig给予0.5 g/kg的龙胆苦苷(1)可通过抑制TNF-α、IL-1β的释放及下调NF-κB p65蛋白的表达来干预牛胆酸钠逆行灌注大鼠胆胰管所诱导的急性胰腺炎模型。Zhao等[33]研究表明0.05、0.5、1.5 ng/mL的龙胆苦苷干预IL-1β(10 ng/mL)所诱导的大鼠关节软骨细胞24 h后,其对细胞的形态及结构没有显著影响,可使P38、JNK和ERK蛋白(MAPKs蛋白家族成员)活性降低,PGE2、环氧合酶-2(COX-2)释放减少,提示龙胆苦苷可用于治疗骨性关节炎。Saravanan等[34]应用组织病理学和影像学方法评价了ig獐牙菜苦苷(2、5、10 mg/kg)对佐剂性关节炎大鼠的影响,结果提示龙胆苦苷可以显著改善关节炎症状,其作用机制可能涉及减少IL-1β等炎症因子的生成,促进抗炎因子IL-10、IL-4释放及调节NF-κB抑制蛋白(NF-κB/I κB)与蛋白质酪氨酸激酶2/信号传导子与激活子3(JAK2/STAT3)蛋白表达水平,并采用体外RAW 264.7细胞模型实验及分子对接实验加以证实。Saravanan等[35]报道50 μg/mL獐牙菜苦苷(2)能够有效干预IL-1β诱导的成纤维样滑膜细胞炎症模型,其作用机制可能是通过抑制p38的基因及蛋白水平的表达来减少COX-2、PEG2等炎症因子的释放。
Jaishree等[36]采用热板法及醋酸扭体法观察了口服獐牙菜苦苷(2,100 mg/kg)的镇痛作用,结果显示其镇痛作用略强于扑热息痛(100 mg/kg)。
2.2 保肝作用目前研究主要以CCl4诱导的动物肝损伤模型或酒精性肝损伤模型观察了秦艽的保肝作用,并对其可能作用机制进行探讨。康宏杰等[37]发现秦艽水提物可对抗ip 10% CCl4花生油溶液所诱导的小鼠急性肝损伤模型,保护肝脏组织病理变化,使肝组织中超氧化物歧化酶(SOD)活性恢复、丙二醛(MDA)量明显下降,从而抑制自由基和脂质过氧化物的产生,发挥保肝作用。张鹏等[38]研究发现秦艽醇提物可以通过降低肝组织MDA量、提高SOD活性来保护ig 50%乙醇所诱导的小鼠酒精性肝损伤,对抗肝脏组织病理变化。张霞等[39]以CCl4诱导的肝损伤大鼠模型血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)为评价指标,对秦艽乙醇提取物4个萃取部位进行了抗肝损伤活性筛选,结果显示水溶性部位抗肝损伤活性显著。苏晓聆等[40]研究了大叶秦艽与麻花秦艽水煎液对CCl4致小鼠急性肝损伤的保护机制,结果显示大叶秦艽和麻花秦艽水煎液均可显著降低血清TNF-α水平,升高IL-10的水平,表明秦艽可增强CCl4损伤肝组织中IL-10的表达,而IL-10是介导秦艽保肝效应的重要细胞因子。
此外,Jaishree等[41]发现分别ig给予大鼠100、200 mg/kg的獐牙菜苦苷(2)可以保护200 mg/kg D-半乳糖胺所诱导的大鼠急性肝损伤,其作用机制可能与其显著升高血清、肝脏、肾脏中过氧化氢酶(CAT)、SOD和谷胱甘肽(GSH)的活性有关,表明獐牙菜苦苷的保肝作用是通过改善脂质过氧化与增强自由基清除能力实现的。Deng等[42]报道了龙胆苦苷(1)可用于治疗急性黄疸和慢性肝炎,通过体外实验研究了龙胆苦苷对细胞色素P450酶(CYP450)的抑制和诱导作用,其发挥作用的机制可能与CYP450酶系的活性水平变化无关,具体机制有待进一步研究。
2.3 降压作用高兰月等[43]给家兔耳缘iv 2 g/kg秦艽水煎醇沉液后,家兔血压下降,2~3 min后恢复,再分别用1%阿托品、0.01%肾上腺素和5%氯化钙(均0.1 mL/kg)后再给予秦艽,血压下降,2~3 min后恢复,但对心率无明显影响,其作用机制需要进一步探讨。高亦珑等[44]发现家兔耳缘iv 2 g/kg秦艽水煎醇沉液可以显著降低0.01%肾上腺素(0.1 mL/kg)引起家兔高血压,且对家兔心率无影响,与上述研究结果一致。Szumny等[45]发现结膜内给予0.7%马钱苷酸溶液可以显著降低正常新西兰白兔眼内压,首次使用3 h后即可使眼内压降低25%,其作用强于噻吗心安滴眼液。
2.4 免疫抑制作用龙启才等[46]研究表明秦艽醇提物可抑制正常小鼠脾脏淋巴细胞和胸腺淋巴细胞增殖,其抑制脾脏淋巴细胞增殖作用存在一定的量效关系,秦艽醇提物还可抑制小公牛主动脉内皮细胞模型中环氧合酶-1(COX-1)和巨噬细胞COX-2模型中COX-2的活性,也呈量效关系,推测秦艽发挥抗类风湿关节炎作用可能主要是通过抑制体液免疫介导,部分是通过体液免疫机制。董建勇等[47]采用刀豆蛋白A(ConA)诱导脾T淋巴细胞的增殖反应来筛选大叶秦艽调节免疫的有效部位,结果发现大叶秦艽正丁醇提取部位有显著的调节免疫作用。
2.5 抗病毒作用李福安等[48]报道秦艽水提物和醇提物均可显著延长50 μL病毒尿囊液滴鼻感染的甲型流感病毒小鼠的存活率、存活天数,还可显著抑制甲型流感病毒感染小鼠的肺指数的升高。张传杰等[49]研究表明秦艽和黄芪混合提取液有明显的抗50 μL病毒尿囊液滴鼻感染的甲型流感病毒作用,其作用机制可能为膜稳定作用增强抵抗能力,直接的抗病毒物质诱导干扰素合成,增强NK细胞活性,从而杀灭部分病毒,减轻对心肌细胞的损害。
2.6 抗肿瘤作用汪海英等[50]采用MTT法检测秦艽总苷对人肝癌SMMC-7721细胞生长的影响,流式细胞仪分析细胞凋亡率,瑞-姬氏染色观察细胞形态变化,结果显示125、250、500、1 000 μg/mL秦艽总苷可不同程度抑制SMMC-7721细胞生长,且有浓度和时间依赖性,250、500、1 000 μg/mL秦艽总苷可以诱导细胞凋亡,凋亡细胞发生形态学改变。汪海英等[51]研究表明250、500、1 000 μg/mL秦艽总苷可抑制淋巴癌细胞U937增殖(抑制率分别为19.7%、30.9%、34.2%)和诱导细胞凋亡。Wu等[52]体外实验发现2α-hydroxyursolic acid对HL-60细胞具有抑制作用,其IC50值为(69.5±3.1)μmol/L。
2.7 其他作用 2.7.1 对心脑血管作用刘建红等[53]采用“四管闭塞法”制备家兔全脑缺血模型,实验开始前7 d ig秦艽水煎液,缺血5 min后分别再灌注12、24、48 h,使用免疫组化技术检测家兔全脑缺血再灌注损伤模型双侧海马CA区HSP70的表达,结果显示秦艽可以通过上调HSP70的表达,达到对脑损伤的保护作用。王玮等[54]研究显示大秦艽汤可延长大鼠的凝血酶原时间、活化部分凝血活酶时间、凝血酶时间,减少纤维蛋白原水平,降低血小板黏附率和聚集率,表明大秦艽汤具有抗凝血和抗血小板黏附、聚集的作用。
2.7.2 抗菌作用李娅等[55]采用试管2倍稀释法联合琼脂平板法测定秦艽醇提取物对8种细菌的最低抑制浓度,发现秦艽醇提取物对金黄色葡萄球菌、表皮葡萄球菌、粪链球菌的抗菌活性较强(MIC分别为62.5、250、62.5 g/L),对福氏志贺氏杆菌、变形杆菌、伤寒杆菌、乙型副伤寒杆菌的抗菌活性较弱(MIC均为500 g/L),对大肠杆菌的抗菌活性较差(MIC>500 g/L)。
2.7.3 降尿酸作用刘颖等[56]采用ig腺嘌呤和乙胺丁醇成功诱导大鼠高尿酸血症模型,并观察了秦艽50%醇提物对模型大鼠血尿酸水平的影响,结果显示,秦艽醇提物可显著降低血清尿酸水平。免疫组化和Western blotting分析结果提示其作用机制可能与调节模型组大鼠阴离子转运蛋白URAT1、OAT1、OAT3表达水平及增加尿酸排泄量有关。
3 展望秦艽生物活性成分丰富,其传统功效经现代药理学的科学评价正逐渐被证实和挖掘。秦艽具有诸多药理活性,包括抗炎镇痛、保肝、免疫抑制、降血压、抗病毒、抗肿瘤等,与其含有多种化学成分如裂环烯醚萜苷类、环烯醚萜苷类萜类、木脂素类、黄酮类与三萜类等密切相关。在近20年里,关于秦艽的化学成分和药理活性研究虽然已有较多文献报道,然而由于临床试验设计的局限性,其对人体健康有益的真实原因还尚不明确,如秦艽抗高尿酸血症机制值得进一步研究。此外,目前的研究多集中在秦艽传统主治功效方面,对于其相关的副作用或毒性研究还有待开展。目前,秦艽开发出来的相关产品以艽龙胶囊(龙胆总苷,批准号Z20030101)为代表,随着秦艽越来越多治疗效果的科学证据被发现,秦艽相关产品及产业化会具有更广阔的发展前景。
| [1] | 中国药典[S].一部. 2015. |
| [2] | 中华本草编委会. 中华本草[M]. 第17卷. 上海: 上海科学技术出版社, 1999. |
| [3] | 李艳秋.龙胆苦苷(gentiopicroside)的主要药效学研究[D].西安:西北大学, 2002. |
| [4] | Cao X Y, Wang Z Z. Simultaneous determination of four iridoid and secoiridoid glycosides and comparative analysis of Radix Gentianae Macrophyllae and their related substitutes by HPLC[J]. Phytochem Anal, 2010, 21(4): 348–354. DOI:10.1002/pca.v21:4 |
| [5] | Liu F F, Wang Y M, Zhu H T, et al. Comparative study on "Long-Dan", "Qin-Jiao" and their adulterants by HPLC analysis[J]. Nat Prod Bioprospect, 2014, 4(5): 297–308. DOI:10.1007/s13659-014-0039-x |
| [6] | 蔺建新, 李茂星, 张汝学, 等. 大孔吸附树脂纯化秦艽中龙胆苦苷[J]. 中草药, 2006, 37(11):1666–1668. |
| [7] | Liang J R, Ito Y, He J, et al. Rapid preparative separation of six bioactive compounds from Gentiana crassicaulis Duthie ex Burk. using microwave-assisted extraction coupled with high-speed counter-current chromatography[J]. J Separation Sci, 2013, 36(24): 3934–3940. DOI:10.1002/jssc.v36.24 |
| [8] | Chien C F, Lin L C, Tsai T, et al. Solation of gentiopicroside from Gentianae Radix and its pharmacokinetics on liver ischemia/reperfusion rats[J]. J Ethnopharmacol, 2012, 141(2): 668–673. DOI:10.1016/j.jep.2011.08.001 |
| [9] | Zhao S, Liu Q, Chen X, et al. Separation and determination of gentiopicroside and swertiamarin in Tibetan medicines by micellar electrokinetic electrophoresis[J]. Biomed Chromatogr, 2004, 18(1): 10–15. DOI:10.1002/(ISSN)1099-0801 |
| [10] | 吴靳荣, 吴立宏, 赵志礼, 等. 中药秦艽和习用品中5种环烯醚萜类成分的HPLC含量测定[J]. 中国中药杂志, 2014, 39(4):715–720. |
| [11] | He Y M, Zhu S, Ge Y W, et al. Secoiridoid glycosides from the root of Gentiana crassicaulis with inhibitory effects against LPS-induced NO and IL-6 production in RAW264 macrophages[J]. J Nat Med, 2015, 69(3): 366–374. DOI:10.1007/s11418-015-0903-y |
| [12] | Lv T, Xu M, Wang D, et al. The chemical constituents from the roots of Gentiana crassicaulis and their inhibitory effects on inflammatory mediators NO and TNF-α[J]. Nat Prod Bioprospect, 2012, 2(5): 217–221. DOI:10.1007/s13659-012-0067-3 |
| [13] | Fan H, Zang Y, Zhang Y, et al. Triterpenoids and iridoid glycosides from Gentiana dahurica[J]. Helv Chim Acta, 2010, 93(12): 2439–2447. DOI:10.1002/hlca.v93.12 |
| [14] | Wei S H, Zhang P C, Feng X Z, et al. Qualitative and quantitative determination of ten iridoids and secoiridoids in Gentiana straminea Maxim. by LC-UV-ESI-MS[J]. J Nat Med, 2012, 66(1): 102–108. DOI:10.1007/s11418-011-0560-8 |
| [15] | Tan R X, Wolfender J L, Zhang L X, et al. Acyl secoiridoids and antifungal constituents from Gentiana macrophylla[J]. Phytochemistry, 1996, 42(5): 1305–1313. DOI:10.1016/0031-9422(96)00149-5 |
| [16] | Jiang Z B, Liu H L, Liu X Q, et al. Chemical constituents of Gentiana macrophylla Pall[J]. Nat Prod Res, 2010, 24(14): 1365–1369. DOI:10.1080/14786411003745494 |
| [17] | Xu M, Zhang M, Zhang Y J, et al. New acylated secoiridoid glucosides from Gentiana straminea (Gentianaceae)[J]. Helv Chim Acta, 2009, 92(2): 321–327. DOI:10.1002/hlca.v92:2 |
| [18] | Wang Y M, Xu M, Wang D, et al. Anti-inflammatory compounds of "Qin-Jiao", the roots of Gentiana dahurica (Gentianaceae)[J]. J Ethnoparmacol, 2013, 147(2): 341–348. DOI:10.1016/j.jep.2013.03.016 |
| [19] | Chen G, Wei S H, Yu C Y. Secoiridoids from the roots of Gentiana straminea[J]. Biochem System Ecol, 2009, 37(6): 766–771. DOI:10.1016/j.bse.2009.12.004 |
| [20] | Pan Y, Zhao Y L, Zhang J, et al. Phytochemistry and pharmacological activities of the genus Gentiana (Gentianaceae)[J]. Chem Biodiv, 2016, 13(2): 107–150. DOI:10.1002/cbdv.v13.2 |
| [21] | 王长生, 董红娇, 包雅婷, 等. UPLC-Q-Exactive四级杆-静电场轨道阱高分辨质谱联用快速分析粗茎秦艽化学成分[J]. 中草药, 2016, 47(18):3175–3180. |
| [22] | Zeng R, Hu H, Ren G, et al. Chemical profiling assisted quality assessment of Gentianae macrophyllae by high-performance liquid chromatography using a fused-core column[J]. J Chromatogr Sci, 2015, 53(8): 1274–1279. DOI:10.1093/chromsci/bmu227 |
| [23] | Liang J R, Ito Y, Zhang X X, et al. Rapid preparative separation of six bioactive compounds from Gentiana crassicaulis Duthie ex Burk. using microwave-assisted extraction coupled with high-speed counter-current chromatography[J]. J Separ Sci, 2013, 36(24): 3934–3940. DOI:10.1002/jssc.v36.24 |
| [24] | 赵勤, 王乐乐, 魏立鹏, 等. 麻花秦艽醇提物对佐剂性关节炎大鼠的影响[J]. 中药药理与临床, 2015, 31(1):145–147. |
| [25] | 王佳, 王钢, 王丽琴, 等. 秦艽醇提物治疗类风湿关节炎的实验研究[J]. 西部中医药, 2015, 28(7):11–14. |
| [26] | 王钢, 王丽琴, 王佳, 等. 秦艽醇提物对胶原诱导性关节炎大鼠血清抗-CCP及TNF-α的影响[J]. 中国实验方剂学杂志, 2013, 19(19):302–305. |
| [27] | 牛筛龙, 孙富增, 张兴耐. 秦艽总环烯醚萜苷的抗炎作用及其机制[J]. 药学实践杂志, 2013, 31(30):198–200. |
| [28] | 高祥祥, 王海峰, 张红. 秦艽对尿酸钠痛风模型大鼠的保护作用[J]. 中药药理与临床, 2015, 31(4):141–144. |
| [29] | Yu F R, Yu F H, Li R D, et al. Inhibitory effects of the Gentiana macrophylla (Gentianaceae) extract on rheumatoid arthritis of rats[J]. J Ethnopharmacol, 2004, 95(1): 77–81. DOI:10.1016/j.jep.2004.06.025 |
| [30] | 林清, 高秀娟, 喇孝瑾, 等. 秦艽醇提取物抗炎镇痛作用的实验研究[J]. 西部中医药, 2013, 26(7):28–30. |
| [31] | Jia N, Li Y, Wu Y, et al. Comparison of the anti-inflammatory and analgesic effects of Gentiana macrophylla Pall. and Gentiana straminea Maxim., and identification of their active constituents[J]. J Ethnopharmacol, 2012, 144(3): 638–645. DOI:10.1016/j.jep.2012.10.004 |
| [32] | Lv J, Gu W L, Chen C X. Effect of gentiopicroside on experimental acute pancreatitis induced by retrograde injection of sodium taurocholate into the biliopancreatic duct in rats[J]. Fitoterapia, 2015, 102: 127–133. DOI:10.1016/j.fitote.2015.03.002 |
| [33] | Zhao L, Ye J, Wu G T, et al. Gentiopicroside prevents interleukin-1 beta induced inflammation response in rat articular chondrocyte[J]. J Ethnopharmacol, 2015, 172: 100–107. DOI:10.1016/j.jep.2015.06.031 |
| [34] | Saravanan S, Islam V, Babu N P, et al. Swertiamarin attenuates inflammation mediators via modulating NF-kB/I kB and JAK2/STAT3 transcription factors in adjuvant induced arthritis[J]. Eur J Pharm Sci, 2014, 56(1): 70–86. |
| [35] | Saravanan S, Islam V, Thirugnanasambantham K, et al. Swertiamarin ameliorates inflammation and osteoclastogenesis intermediates in IL-1β induced rat fibroblast-like synoviocytes[J]. Inflamm Res, 2014, 63(6): 1–12. |
| [36] | Jaishree V, Badami S, Kumar M R, et al. Antinociceptive activity of swertiamarin isolated from Enicostemma axillare[J]. Phytomedicine, 2009, 16(3): 227–232. |
| [37] | 康宏杰, 张霞, 侯延辉, 等. 秦艽对四氯化碳致小鼠急性肝损伤的保护作用[J]. 中药药理与临床, 2012, 28(6):98–100. |
| [38] | 张鹏, 刘瑢, 张霞, 等. 秦艽对小鼠酒精性肝损伤的保护作用[J]. 中国医院药学杂志, 2014, 34(21):1822–1825. |
| [39] | 张霞, 毛凯, 张鹏, 等. 秦艽抗肝损伤活性部位筛选[J]. 中华中医药杂志, 2014, 29(12):3933–3935. |
| [40] | 苏晓聆, 李福安, 魏全嘉, 等. 秦艽水煎液对小鼠急性肝损伤肿瘤坏死因子-α和白细胞介素-10表达的影响[J]. 时珍国医国药, 2010, 21(4):827–828. |
| [41] | Jaishree V, Badami S. Antioxidant and hepatoprotective effect of swertiamarin from Enicostemma axillare against d-galactosamine induced acute liver damage in rats[J]. J Ethnopharmacol, 2010, 130(1): 103–106. DOI:10.1016/j.jep.2010.04.019 |
| [42] | Deng Y, Wang L, Yang Y, et al. In vitro inhibition and induction of human liver cytochrome P450 enzymes by gentiopicroside:potent effect on CYP2A6[J]. Drug Metab Pharm, 2013, 28(4): 339–344. DOI:10.2133/dmpk.DMPK-12-RG-090 |
| [43] | 高兰月, 高亦珑, 赵淑红. 秦艽对心血管的作用及毒性研究[J]. 中国民族民间医药, 2010, 19(11):24. |
| [44] | 高亦珑, 赵淑红, 徐力生, 等. 宁夏栽培秦艽的降温和对心血管作用的实验研究[J]. 宁夏医科大学学报, 2011, 33(5):401–402. |
| [45] | Szumny D, Sozański T, Kucharska A Z, et al. Application of cornelian cherry iridoid-polyphenolic fraction and loganic acid to reduce intraocular pressure[J]. Evidence-Based Compl Alter Med, 2015, 2015: 1–8. |
| [46] | 龙启才, 邱建波. 威灵仙、秦艽、桑寄生醇提物体外对淋巴细胞和环氧酶的影响[J]. 中药药理与临床, 2004, 20(4):26–27. |
| [47] | 董建勇, 李广远, 李长天. 大叶秦艽抗炎、调节免疫有效部位的初步研究[J]. 甘肃中医学院学报, 2006, 23(1):17–19. |
| [48] | 李福安, 李永平, 童丽, 等. 秦艽抗甲型流感病毒的药效学实验研究[J]. 世界科学技术-中医药现代化, 2007, 9(4):41–44. |
| [49] | 张传杰, 刘丽娟, 张蓬华, 等. 黄芪和秦艽提取物抗甲型流感病毒研究[J]. 郧阳医学院学报, 2010, 29(4):138–140. |
| [50] | 汪海英, 童丽, 李福安. 秦艽总苷对人肝癌细胞SMMC-7721体外作用的研究[J]. 时珍国医国药, 2010, 21(1):53–55. |
| [51] | 汪海英, 袁冬萍, 李福安. 秦艽总苷对人肝癌细胞等几种肿瘤细胞的体外作用[J]. 青海医学院学报, 2009, 30(3):173–175. |
| [52] | Wu Q X, Liu X, Shi Y P. Chemical components from Gentiana aristata[J]. Chem Biodiv, 2007, 4(2): 175–182. DOI:10.1002/(ISSN)1612-1880 |
| [53] | 刘建红, 李福安, 李建华. 秦艽水煎液对家兔全脑缺血再灌注损伤模型HSP70表达的影响[J]. 青海医学院学报, 2008, 29(1):29–32. |
| [54] | 王玮, 邓庚, 陈利达, 等. 大秦艽汤对脑缺血大鼠凝血及血小板黏附、聚集功能的影响[J]. 中国中医药科技, 2010, 17(2):116–117. |
| [55] | 李娅, 赵锡兰, 杨凤琴, 等. 秦艽醇提取物对8种细菌的体外抑菌实验[J]. 中国医院药学杂志, 2011, 31(23):1940–1942. |
| [56] | 刘颖, 郑立运, 崔立然. 秦艽抗大鼠高尿酸血症作用机制研究[J]. 中国医学创新, 2013, 10(22):143–144. |
 2017, Vol. 48
2017, Vol. 48


