2. 浙江中医药大学生命科学院, 浙江 杭州 310053;
3. 南昌大学第一临床医学院, 江西 南昌 330000
2. College of Life Science, Zhejiang Chinese Medical University, Hangzhou 310053, China;
3. College of Clinical Medicine, Nanchang University, Nanchang 330000, China
铁皮石斛Dendrobium officinale Kimura et Migo是兰科(Orchidaceae)石斛属Dendrobium Sw.多年生附生草本植物,是《中国药典》2015年版记载的5种药用石斛之一。《神农本草经》中将其列为上品,味甘、质重、柔韧、黏性大,具有大补五脏虚劳,久服厚肠胃,益寿延年、增强精气、益胃生津、滋阴清热的功效[1]。铁皮石斛中含有的活性成分为石斛多糖、石斛碱、氨基酸及其衍生物以及多种挥发性成分[2-3]。大量现代药理学研究结果表明,铁皮石斛的有效成分具有抗氧化、抗炎、抗肿瘤、增强免疫功能、降糖等作用[4],被国际药用植物界称为“药界大熊猫”。此外,铁皮石斛相关的产品不仅用于治疗疾病,还可加工成食品、保健品等,如石斛茶、果冻。因此,铁皮石斛的开发和应用具有很好的前景[5]。
植物内生真菌是指那些在其生活史的一定阶段或全部阶段生活于健康植物的各种组织和器官内部,而不使宿主植物表现出明显感染症状的真菌,是植物微生态系统中的重要组成成分[6]。研究发现,内生真菌广泛存在于几乎所有植物中,且种类繁多。其与药用植物在长期的生活过程中,形成了互惠互利的共生关系,在宿主的生长发育和系统演化过程中起重要作用。此外,内生真菌的代谢产物十分丰富,具有多种生物活性,是新化合物、新药源的潜在资源。本实验对广西产的铁皮石斛不同部位内生真菌进行了分离鉴定,并进行抑菌及其代谢产物的活性研究,旨在筛选出能产生新型抗菌、抗肿瘤物质的真菌以及具有生物活性的代谢产物,为铁皮石斛的综合利用、新药开发提供前期实验研究基础。
1 材料 1.1 药材铁皮石斛,采自广西容县,经浙江中医药大学李荣群副教授鉴定为铁皮石斛Dendrobium officinale Kimura et Migo。对采集的铁皮石斛根部、茎部和叶部样本进行编号,即广西根部(GXR)、广西茎部(GXS)和广西叶部(GXL)。
1.2 菌株与细胞株大肠杆菌(Escherichia coli,ATCC 25922)、金黄色葡萄球菌(Staphylococcus aureus,ATTC 25923)、枯草芽孢杆菌(Bacillus subtilis,ATCC6633)、人肝癌HepG2细胞,均由浙江中医药大学基础医学院微生物与免疫学教研室提供。
1.3 试剂与仪器MS培养基、分离培养基(PDA培养基)、LB培养基均由实验室配制;0.25%胰蛋白酶-0.02% EDTA(吉诺生物医药技术有限公司);胎牛血清、高糖DMEM培养基(杭州普域公司);其他试剂均为国产分析纯;354型酶标仪(美国Thermo公司);IX70倒置相差显微镜(日本Olympus公司)。
2 方法 2.1 内生真菌的分离与纯化从新鲜健康的广西铁皮石斛完整植株取下根、茎、叶3个部位,用自来水冲洗干净,剔除腐叶,用滤纸吸干表面水分。按下列程序进行表面消毒:75%乙醇浸泡30 s,无菌水冲洗4~6次;0.1%升汞浸泡2 min,无菌水冲洗4~6次;置于培养皿中,用滤纸吸干多余水分;无菌条件下,将根、茎切割成0.5 cm3的小块,叶切割成0.5 cm2的小块,置于MS培养基上,28 ℃恒温培养,同时取最后1次冲洗样本的无菌水200 μL涂布于PDA培养基上,28 ℃恒温培养,检验表面消毒是否彻底。逐日观察,待组织块切面长出菌后及时挑取菌丝转移到PDA培养基上,采用平板划线法进行纯化,直至平板中菌落形态、菌丝、孢子形态和菌落颜色稳定,得到菌落纯菌株,编号并保存菌种备用。
2.2 内生真菌的形态鉴定根据菌落的形状、大小、颜色、纹饰等特征,在PDA培养基中于28 ℃培养3~8 d,观察菌落和菌丝等形态及颜色,结合革兰氏染色进行形态初步鉴定。
2.3 内生真菌的分子鉴定取各内生真菌菌丝0.8~1.0 g,于液氮中(加0.01 g聚乙烯吡咯烷酮)研磨成细粉状后,放入1.5 mL离心管中,采用CTAB法提取内生真菌DNA,以真菌通用引物ITS1:5’-TCCGTAGGTGAAC-CTGCGG-3’和ITS4:5’-TCCTCCGCTTATTGA-TATGC-3’扩增ITS rDNA基因序列。扩增产物纯化后送上海生工生物工程有限公司测序。
根据测序结果,登录GenBank进行BLAST比对,搜索同源序列,选出与该序列相关性较高的核酸序列进行分析。采用Clustal W[7]软件进行多序列比对分析,利用Mega5.0构建系统发育进化树。
2.4 菌株抑菌活性筛选采用平板对峙法[8],将指示菌菌液(约1×106 cfu/mL)涂布于LB平板,制成含菌平板,将直径7 mm的圆形内生真菌菌片置于LB培养基上,每个样品重复3次。于37 ℃生化培养箱中培养24 h,观察抑菌圈大小,并做记录。
2.5 内生真菌的发酵培养及发酵产物的提取取抑菌活性较强的内生真菌接种于PDA液体培养基中,28 ℃、150 r/min恒温振荡培养7 d。发酵液用等体积的醋酸乙酯提取3次,提取液减压浓缩得浸膏,4 ℃保存进行抑菌和抗肿瘤活性实验。
2.6 代谢产物抑菌活性筛选以醋酸乙酯溶解浸膏(质量浓度为20 mg/mL),进行抑菌活性实验。采用管碟法[9]测定代谢产物抑菌活性,将指示菌菌液(约1×106 cfu/mL)均匀涂布于LB培养基上,放入牛津杯,并向杯中加入配好的醋酸乙酯代谢产物溶液100 μL,以等体积醋酸乙酯溶剂做阴性对照,每个样品重复2次。于37 ℃生化培养箱中培养24 h,测量抑菌圈大小并记录。
2.7 代谢产物体外抗肿瘤活性检测采用MTT法[10]进行抗肿瘤活性检测,以人肝癌HepG2细胞为受试对象,于37 ℃、5% CO2条件下的DMEM培养液中培养,取对数生长期细胞,用0.25%胰蛋白酶-0.02% EDTA消化并制成细胞悬液,调整细胞浓度至5×104~6×104个/mL,接种于96孔细胞培养板中,每孔加100.0 μL细胞悬液,置37 ℃、5% CO2培养箱中过夜。24 h后换液,每孔加入测试样品溶液(终质量浓度为10 mg/mL)。以DMEM培养液为阴性对照,每组设3个复孔。培养48 h后,加入MTT作用4 h,吸弃培养基,加入150.0 μL DMSO震荡10 min,在570 nm波长处检测吸光度(A)值,并计算细胞增殖抑制率。
细胞增殖抑制率=1-处理组A值/阴性对照组A值
3 结果 3.1 铁皮石斛内生真菌的分离鉴定采用组织分离法从广西铁皮石斛的根、茎和叶中共分离得到28株内生真菌,其中从根中分离出12株(42.86%)、茎中10株(35.71%)、叶中6株(21.43%)。从分离部位看,根部分离的菌株最多,其次为茎,叶中最少。
通过菌落形态和革兰氏染色对分离纯化的28株内生真菌进行初步鉴定,结果见表 1。染色结果表明,28株菌中,7株菌的菌丝染色呈红色(25%),21株菌的菌丝染色呈紫色(75%)。各菌株的菌落形态特征、菌丝的染色结果及孢子的形态等均有差异。菌落形态丰富,有毛毯状、絮状、棉絮状、绒毛状等,各菌落颜色也不尽相同,有白色、蛋黄色、灰白色、灰绿色等。
|
|
表 1 内生真菌革兰氏染色结果及菌落形态特征 Table 1 Colony appearance of entophytic fungi from D. officinale |
利用分子生物学方法得到测序结果,登录NCBI网站,进行BLAST比对,比对结果见表 2。镰刀菌属Fusarium为12株、链格孢属Alternaria、刺盘孢属Colletotrichum、小球壳孢属Microsphaeropsis、黑孢霉属Nigrospora、炭角菌属Xylaria和未知真菌各为2株,生赤壳属Bionectria、枝孢属Cladosporium、Meyerozyma属、鼓孢瘤座霉属Pithomyces各为1株。其中,镰刀菌属Fusarium为铁皮石斛内生真菌的优势种群,占分离得到的内生真菌的42.86%。
|
|
表 2 铁皮石斛内生真菌菌属鉴定结果 Table 2 Identification of entophytic fungi from D. officinale |
3.2 铁皮石斛内生真菌的抑菌活性
平板对峙实验结果显示,7株内生真菌至少对1种指示菌有抑菌作用(抑菌圈直径大于7 mm),抗大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌的活性菌株分别有3、5、3株(表 3)。部分菌株对峙结果见图 1。
|
|
表 3 铁皮石斛内生真菌抑菌活性筛选 Table 3 Antimicrobial activity of entophytic fungi in D. officinale |
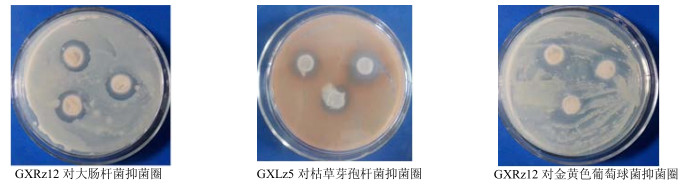
|
菌饼直径7.0 mm,图 2同 Diameter of bacterium tablets: 7.0 mm, Fig. 2 is same 图 1 铁皮石斛部分内生真菌抑菌活性结果 Fig.1 Antimicrobial activity of entophytic fungi from D. officinale |
3.3 铁皮石斛内生真菌发酵液的抑菌活性
对分离纯化得到的内生真菌进行发酵培养,采用管碟法,对28株铁皮石斛内生真菌发酵液醋酸乙酯部分样品进行抑菌实验,结果见表 4。
|
|
表 4 内生真菌发酵产物醋酸乙酯萃取相抑菌活性 Table 4 Antimicrobial activity of ethyl acetate extracts from fermentation broth of entophytic fungi from D. officinale |
在10 mg/mL质量浓度下有7个测试样品至少对1种指示细菌具有抑制作用,对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌有抑菌活性菌株分别为3、5、3株。部分菌株代谢产物醋酸乙酯萃取相抑菌活性结果见图 2。
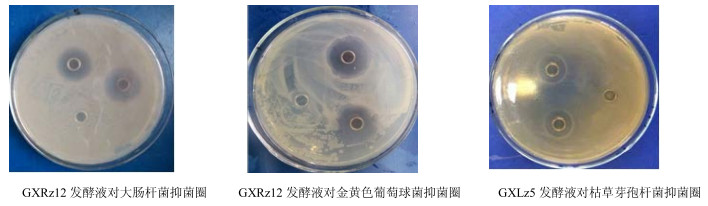
|
图 2 铁皮石斛部分内生真菌发酵液的抑菌活性 Fig.2 Antimicrobial activity of fermentation broth of endophytic fungus from D. officinale |
3.4 代谢产物醋酸乙酯部分体外抗肿瘤活性
采用MTT法检测28株铁皮石斛内生真菌代谢产物醋酸乙酯萃取部分对人肝癌细胞HepG2的细胞毒性,结果见表 5。7株菌株代谢产物醋酸乙酯萃取部分在10 mg/mL质量浓度下对HepG2的增殖具有不同程度的抑制作用,抑制率在30%以上的有4株,50%以上的有3株。菌株代谢产物有良好的体外抗肿瘤活性,可在后续实验中进一步研究。部分菌株抗肿瘤活性结果如图 3所示。
|
|
表 5 内生真菌代谢产物醋酸乙酯萃取相对HepG2细胞增殖的抑制作用(x±s, n=3) Table 5 Antitumor activity of ethyl acetate extracts from fermentation broth of entophytic fungi isolated from D.officinale(x±s, n=3) |

|
图 3 内生真菌代谢产物醋酸乙酯相对HepG2细胞增殖的抑制作用 Fig.3 Antitumor activity of ethyl acetate extracts from fermentation broth of entophytic fungi isolated from D. officinale |
4 讨论
近年来,随着人们对人工合成化学品安全性问题的关注,对天然产物的应用开发在学术界日益得到重视。以铁皮石斛为原料的保健品、食品、化妆品越来越多,但从资源利用角度来说,野生铁皮石斛生长环境特殊,自身繁殖困难[11-12],自然界中的资源少。本实验对铁皮石斛内生真菌进行深入研究,以期寻找到产生与宿主植物相同或相似化学物质的内生真菌来缓解甚至解决这一问题。
植物内生真菌具有普遍性和多样性,其代谢产物中的生物活性成分具有很好的开发利用价值[13-15]。杨明俊等[16]以金黄色葡萄球菌、大肠杆菌、绿脓杆菌、肺炎克雷伯菌和人肝癌细胞HepG2作为受试对象,对从水仙中分离出的18株内生真菌发酵液的醋酸乙酯提取物进行抑菌和抗肿瘤活性筛选,结果表明,各菌株发酵液的醋酸乙酯提取物对4种供试细菌和HepG2细胞都有抑制作用。王卓等[17]对人参内生真菌进行了抗肿瘤活性研究,其中有2株内生真菌的次级代谢产物具有良好的体外抗肿瘤活性。钱一鑫等[18]采用MTT法对54株白苞蒿内生真菌发酵产物粗提物的体外抗肿瘤活性进行筛选,发现对3种肿瘤细胞增殖有抑制作用。这些研究结果提示可进一步对内生真菌代谢产物进行分离提纯,寻找具有抑菌、抗肿瘤活性的成分。
本实验以铁皮石斛作为研究对象,从中分离得到28株内生真菌,发现内生真菌的种群及分布具有差异,根中内生真菌的数量和种类较多,叶中最少;其中,12株内生真菌鉴定为镰刀菌属,是铁皮石斛内生真菌的优势种群。同时采用管碟法和MTT法对内生真菌代谢产物的抑菌活性及体外抗肿瘤活性进行检测,发现具有抑菌活性的内生真菌,其发酵液醋酸乙酯萃取相同样具有不同程度的抑菌和抗肿瘤活性。其中,GXRz12菌株具有较强的抗菌作用及良好的体外抗肿瘤活性,提示可对其代谢产物进行进一步的分离纯化,为抗肿瘤药物及抗菌药物的研究提供新的对象。
| [1] | 中国药典[S].一部. 2015. |
| [2] | 李燕.铁皮石斛化学成分的研究[D].北京:中国协和医科大学, 2009. |
| [3] | 周佳, 周先丽, 梁成钦, 等. 铁皮石斛化学成分研究[J]. 中草药, 2015, 46(9):1292–1295. |
| [4] | 郑会丹. 石斛及其复方制剂降血糖作用及其疗效机制综述[J]. 海峡药学, 2011, 23(10):24–26. |
| [5] | 肖正杭.铁皮石斛种质资源遗传多样性及HPLC指纹图谱分析[D].福州:福建农林大学, 2013. |
| [6] | 周永强, 程玉鹏, 刘丹丹, 等. 药用植物内生真菌代谢产物的活性研究进展[J]. 中医药信息, 2014, 31(3):158–161. |
| [7] | Thompson J D, Gibson T J, Plewniak F, et al. The Clustal-X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Res, 1997, 25(24): 4876–4882. DOI:10.1093/nar/25.24.4876 |
| [8] | 李娟.单蕊黄芪内生真菌的分离鉴定及其次级代谢产物生物活性的研究[D].兰州:兰州理工大学, 2014. |
| [9] | 陈国妮, 孙飞龙, 闫亚茹, 等. 抗菌剂抗菌性能测定与抗菌效果评价技术研究[J]. 化工技术与开发, 2015, 44(2):19–22. |
| [10] | Chanvorachote P, Pongrakhananon V. Ouabain downregulates Mcl-1 and sensitizes lung cancer cells to TRAIL-induced apoptosis[J]. Am J Physiol Cell Physiol, 2013, 304(3): 263–272. DOI:10.1152/ajpcell.00225.2012 |
| [11] | 张翼轸, 张文驹, 穆青, 等. 人参化学成分的药理活性及其含量积累的研究进展[J]. 安徽农业科学, 2011, 39(20):121581–12163. |
| [12] | 聂少平, 蔡海兰. 铁皮石斛活性成分及其功能研究进展[J]. 食品科学, 2012, 33(23):356–361. |
| [13] | Kusarl S, Hertweck C, Spiteller M. Chemical ecology of endophytic fungi:Origins of secondary metabolites[J]. Chem Biol, 2012, 19(7): 792–798. DOI:10.1016/j.chembiol.2012.06.004 |
| [14] | Pimentel M R, Molina G, Dionísio A P, et al. The use of endophytes to obtain bioactive compounds and their application in bio-transformation process[J]. Biotechnol Res Int, 2011. DOI:10.4061/2011/576286 |
| [15] | 邓墨渊, 王伯初, 杨再昌, 等. 分子生物学技术在植物内生菌分类鉴定中的应用[J]. 氨基酸和生物资源, 2006, 28(3):9–14. |
| [16] | 杨明俊, 李娟, 薛鸿燕, 等. 水仙内生真菌的分离及抑菌和抗肿瘤活性研究[J]. 中草药, 2014, 45(6):819–824. |
| [17] | 王卓, 于慧美, 刘鼎, 等. 人参内生真菌的分离及其抗肿瘤活性研究[J]. 中国现代中药, 2016, 15(9):748–751. |
| [18] | 钱一鑫, 康冀川, 雷帮星, 等. 白苞蒿内生真菌的分离及其抗肿瘤抗菌活性筛选[J]. 菌物研究, 2013, 11(2):149. |
 2017, Vol. 48
2017, Vol. 48


