2. 丽水市畲族医药研究所, 浙江 丽水 323000;
3. 温州医科大学药学院, 浙江 温州 325035
2. Sheyao Research Institute of Lishui City, Lishui 323000, China;
3. Pharmacy School, Wenzhou Medical University, Wenzhou 325035, China
小檗碱是从中药中提取的天然产物,如从黄连根茎中提取的黄连碱。传统的研究表明,小檗碱主要用于治疗心血管疾病,如抗心律失常、抗心衰、降血压、调节血脂等[1],另外对胃肠炎、细菌性痢疾等肠道感染、眼结膜炎、化脓性中耳炎等也有效。随着中药的广泛应用,越来越多的研究发现小檗碱在体外和体内均具有不同程度的抗肿瘤作用[2-3],其抗肿瘤机制主要是通过调节细胞周期阻滞在G2期从而抑制肿瘤细胞增殖和扩散[4],诱导线粒体损伤从而抑制ATP生成[5],或诱导肿瘤细胞凋亡[3, 6]等途径。然而,小檗碱的抗肿瘤活性在不同类型的肿瘤中作用机制不尽相同,且抗癌机制尚不完全明确。因此,本实验旨在采用分子生物学技术研究小檗碱对结直肠腺癌的药理学机制,通过建立裸鼠移植瘤模型,探讨小檗碱的体内抗肿瘤活性,从而为临床上合理用药提供一定的理论依据。
1 材料 1.1 药品与试剂小檗碱购自美国Sigma公司,用二甲基亚砜(DMSO)溶解,储存浓度为100 mmol/L;青-链霉素、DMEM培养基、MDC染液及DAPI染液、自噬抑制剂3-MA、p38途径抑制剂SB205380以及凋亡抑制剂Z-DEVD-FMK(氟甲基酮)均购自Sigma公司。CCK-8试剂盒购自合肥博美生物科技有限责任公司;实验用抗体均购自武汉博士德生物工程有限公司;胎牛血清购自浙江天杭生物科技有限公司。
1.2 细胞与动物人结直肠腺癌HCT-15细胞(中国科学院上海细胞库);实验用裸鼠均出生5周生长健康,大小均一,体质量约30 mg,购自上海斯莱克动物实验有限公司。所有动物实验遵循SYXK(浙)2015-0009规章。动物实验经过相关部门培训并取得实验动物伦理学资格。
1.3 主要仪器IX73型倒置光学显微镜购自奥林巴斯;9602A型酶标仪购自南京朗普医疗器械有限公司;7100型荧光显微镜购自奥林巴斯;syntek电子数显游标卡尺购自德清盛泰芯电子科技有限公司。
2 方法 2.1 细胞培养HCT-15细胞用含10%胎牛血清(青-链霉素各100 U/mL)的DMEM培养基于37 ℃、饱和湿度、5% CO2培养箱孵育培养,待细胞长至80%融合时进行实验。
2.2 细胞形态学观察将处于对数生长期的HCT-15细胞接种到6 cm的细胞培养皿中,待细胞长到80%左右,分别用不同浓度的小檗碱(0、50、100 μmol/L)处理细胞24 h,以及用50 μmol/L小檗碱作用HCT-15细胞不同的时间(0、24、48 h)后,将细胞培养皿放置于倒置光学显微镜下观察细胞形态变化并拍照记录。
2.3 细胞增殖检测将对数生长期的细胞按照7×103个/孔接种于96孔板中,12 h后,分别加入不同浓度的小檗碱(0、50、100 μmol/L)处理24 h,以及用50 μmol/L小檗碱作用HCT-15细胞不同的时间(0、24、48 h),每组设置6个平行孔。待小檗碱处理后,每孔加入10 μL CCK-8试剂孵育10 min后,用酶标仪读出吸光度(A)值,并计算细胞增殖率(A小檗碱/A对照)。
2.4 MDC染色观察自噬泡以及DAPI染色观察核裂取对数生长期细胞,用胰酶消化,充分吹打,使之成单细胞悬液。按5×104个/mL接种到6孔板,置37 ℃、5% CO2培养箱中培养。待细胞长至80%融合时,分别加入不同浓度的小檗碱(0、50、100 μmol/L)处理24 h,以及用50 μmol/L小檗碱作用HCT-15细胞不同的时间(0、24、48 h),置于37 ℃孵育,吸弃培养液,每孔加终浓度为50 μmol/L的MDC或者DAPI,37 ℃、5% CO2培养箱中避光孵育30 min。30 min后,吸弃MDC染液或者DAPI,用预热的PBS洗涤3次。封片,荧光显微镜观察并拍照。
2.5 免疫印迹法检测凋亡和自噬相关蛋白表达取不同浓度的小檗碱(0、50、100 μmol/L)处理24 h的细胞或以50 μmol/L小檗碱作用0、24、48 h后的细胞,加入细胞裂解液研磨15 min,用BCA法测量蛋白质量浓度。各组不同处理的样品分别取30 μg用聚丙烯酰胺凝胶电泳分离,电转移至PVDF膜上,分别加一抗LC3(1:1 000)、ATG5(1:500)、β-actin(1:3 000)、Bax(1:500)、Bcl-2(1:500)、caspase-3(1:1 000)、Survivin(1:1 000)、p38(1:1 000)、p-p38(1:500),室温孵育2 h。PBST洗脱30 min后,孵育二抗,分别为羊抗兔以及兔抗鼠(1:2 000)。用ECL发光法显色曝光,胶片用扫描仪扫描分析。
2.6 自噬、凋亡抑制剂与小檗碱合用对HCT-15细胞增殖的影响分别将不同浓度的小檗碱(0、50、100 μmol/L)与3-MA(2 mmol/L)或Z-DEVD-FMK(10 μmol/L)合用作用细胞24 h,以及将50 μmol/L小檗碱与3-MA(2 mmol/L)或Z-DEVD-FMK(10 μmol/L)合用作用细胞0、24、48 h,同时设相应的单用小檗碱组,按“2.3”项方法检测细胞增殖。
2.7 小檗碱抑制细胞增殖与激活MAPK-P38通路的关系分别设对照组、小檗碱(100 μmol/L)组及小檗碱(100 μmol/L)+SB205380(10 μmol/L)组,处理细胞24 h后按“2.5”项方法检测p38途径相关蛋白表达。分别以不同浓度小檗碱(0、50、100 μmol/L)单用或与SB205380(10 μmol/L)联用,分别作用于细胞24 h,按“2.3”项方法检测细胞增殖。
2.8 裸鼠模型制备收集处于对数生长期的HCT-15细胞制成1×103个/mL的单细胞悬液,每只裸鼠的右腋部sc 0.2 mL细胞悬液,共注射30只。将30只裸鼠随机分成3组,分别为对照组、10 mg/kg小檗碱处理组、20 mg/kg小檗碱处理组。于细胞接种后第4天开始ig给药,连续给药20 d。接种细胞后,每隔4 d用游标卡尺测量瘤的长径(a)和宽径(b),用公式计算瘤的体积(V=0.5 ab2)。实验结束后剥离皮下瘤并称瘤体的质量,计算抑瘤率。
抑瘤率=(对照组平均瘤体质量-实验组平均瘤体质量)/对照组平均瘤体质量
2.9 统计学方法应用SPSS 17.0统计软件分析,组间比较采用单因素方差分析和t检验,结果以x±s表示。
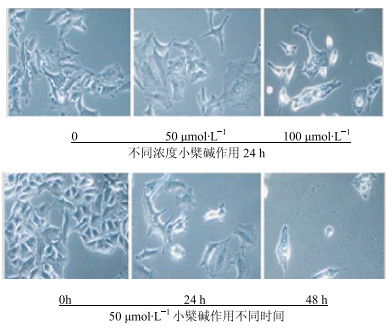
3 结果 3.1 小檗碱对HCT-15细胞形态的影响在普通光学显微镜下检测不同浓度小檗碱(0、50、100 μmol/L)作用HCT-15细胞24 h,以及用50 μmol/L小檗碱作用HCT-15细胞0、24、48 h后的形态变化。结果显示,实验组HCT-15细胞的生长状态发生明显改变,随着小檗碱的浓度增加以及作用时间的延长,细胞数量减少且逐渐变得扁平皱缩,细胞外形变长且细胞间隙增大(图 1)。
|
图 1 小檗碱对HCT-15细胞形态的影响 Fig.1 Effect of berberine on morphology of HCT-15 cells |
3.2 小檗碱对HCT-15细胞增殖的影响
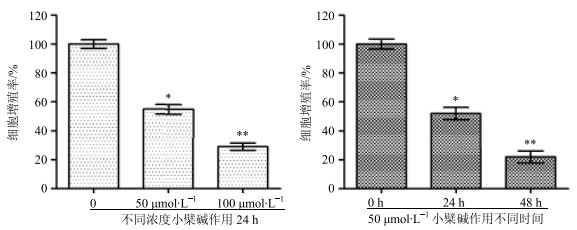
分别采用不同浓度的小檗碱(0、50、100 μmol/L)处理HCT-15细胞24 h以及用50 μmol/L小檗碱作用HCT-15细胞0、24、48 h后用CCK-8试剂检测细胞增殖情况。结果见图 2。在小檗碱的作用下,细胞的增殖率与小檗碱的浓度呈现剂量负相关。0、50、100 μmol/L的小檗碱处理24 h后,HCT-15细胞的增殖率分别为100%、55%和29%。而50 μmol/L的小檗碱处理细胞0、24、48 h后细胞的增殖率分别为100%、52%和22%。进一步计算显示小檗碱对HCT-15细胞在24 h的半数抑制浓度(IC50)约为50 μmol/L。因此采用50、100 μmol/L的浓度研究小檗碱的药理学活性可以显著地观察到细胞增殖抑制。
|
与对照组比较:*P < 0.05 **P < 0.01 *P < 0.05 **P < 0.01 vs control group 图 2 小檗碱对HCT-15细胞增殖的影响(x±s, n=6) Fig.2 Effect of berberine on proliferation of HCT-15 cells (x±s, n=6) |
3.3 小檗碱对HCT-15细胞自噬与凋亡的影响
细胞自噬和凋亡是肿瘤细胞维持生理平衡的重要过程,通常情况下肿瘤细胞受到外界刺激的时候,都会自主调节自噬和凋亡的过程,以适应环境的改变。自噬和凋亡过程已经被用作临床肿瘤治疗的潜在靶点。自噬和凋亡的主要特征分别是自噬泡以及凋亡小体的形成。
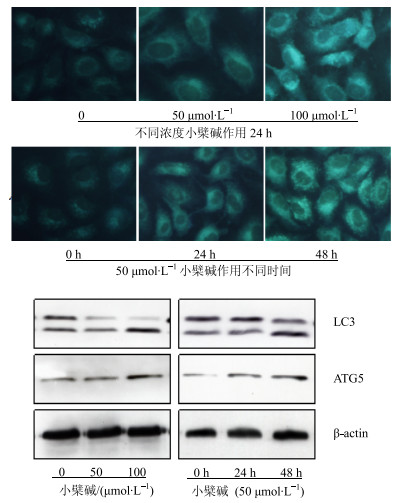
3.3.1 对自噬及相关蛋白表达的影响MDC染色法是常用的检测自噬泡的手段,分别采用不同浓度(0、50、100 μmol/L)小檗碱处理HCT-15细胞24 h以及用50 μmol/L小檗碱作用HCT-15细胞0、24、48 h后用MDC法染色观察到自噬泡的数量随着小檗碱的浓度以及时间的增加而增多(图 3),进一步用免疫印迹法观察到自噬的标志性蛋白ATG5以及LC3的表达与小檗碱处理呈剂量与时间依赖性上调(图 3),说明小檗碱诱导了HCT-15细胞发生自噬。
|
图 3 小檗碱对HCT-15细胞自噬及相关蛋白表达的影响 Fig.3 Effect of berberine on autophagy and related protein expression of HCT-15 cells |
3.3.2 对凋亡及相关蛋白表达的影响
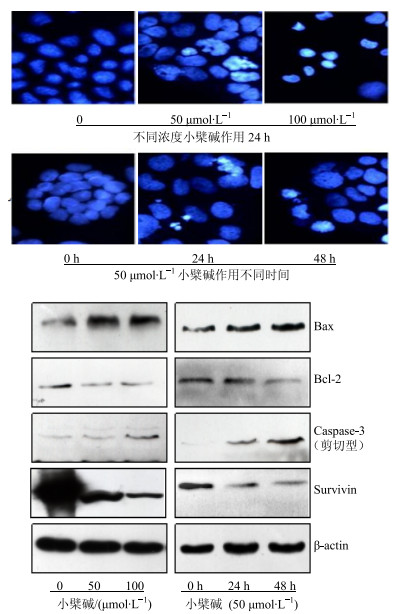
凋亡小体(DAPI)的染色结果见图 4,主要体现在细胞核分裂,随着小檗碱处理浓度的增加以及时间的延长,细胞核分裂所占的比例明显增大。进一步检测了凋亡过程中主要蛋白的表达,结果显示剪切型Caspase-3明显增多,线粒体凋亡相关蛋白Bax的表达明显增加,但Bcl-2表达减少,细胞生存相关指标Survivin的表达明显减少,这些结果进一步证明小檗碱诱导了细胞凋亡。
|
图 4 小檗碱对HCT-15细胞凋亡及相关蛋白表达的影响 Fig.4 Effect of berberine on apoptosis and related protein expression of HCT-15 cells |
3.4 自噬或凋亡抑制剂对小檗碱抑制细胞增殖的影响
用自噬抑制剂3-MA以及凋亡抑制剂Z-DEVD-FMK来抑制小檗碱诱导的自噬和凋亡的过程,进一步检测对细胞增殖的影响。CCK-8结果(图 5)显示,3-MA以及Z-DEVD-FMK能明显提高小檗碱处理后的细胞增殖率,说明小檗碱处理的肿瘤细胞发生的自噬与凋亡过程促进了细胞的死亡,从而达到抑制细胞增殖的目的。
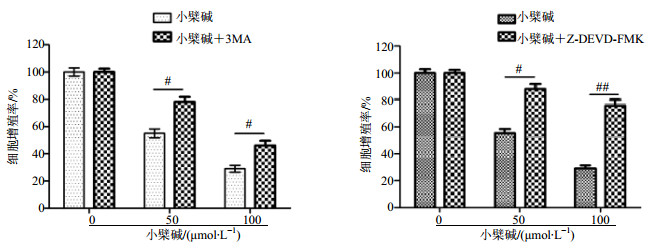
|
与小檗碱组比较:#P < 0.05 ##P < 0.01,下同 #P < 0.05 ##P < 0.01 vs berberine group, same as below 图 5 小檗碱和自噬抑制剂3-MA或者凋亡抑制剂Z-DEVD-FMK共同处理细胞后细胞增殖率(x±s, n=6) Fig.5 Proliferation rate of HCT-15 cells treated by berberine combined with 3-MA or berberine combined with Z-DEVD-FMK (x±s, n=6) |
3.5 小檗碱对MAPK-p38途径蛋白表达的影响及SB203580与小檗碱合用对细胞增殖和相关蛋白表达的影响
MAPK途径的激活参与了肿瘤的生理平衡过程。大多数情况下,当肿瘤细胞受到外界刺激时,MAPK途径会被激活。通常评价MAPK途径的活化程度的指标为其家族的相关蛋白的磷酸化修饰,例如JNK、ERK以及p38经过磷酸化修饰后变成p-JNK、p-ERK以及p-p38。用不同浓度的小檗碱处理细胞24 h,或者50 μmol/L小檗碱作用细胞0、24、48 h后,用免疫印迹法检测发现p38的磷酸化增多,而总的p38表达没有变化(图 6),说明小檗碱诱导了p38途径的激活。为了证明该途径的激活参与了小檗碱诱导的细胞增殖抑制作用,用p38相关的抑制剂SB203580处理细胞,发现小檗碱与SB203580共同处理的细胞p38的磷酸化水平降低(图 7)。CCK-8结果显示SB203580可以减弱小檗碱对细胞的增殖抑制作用(图 8)。综上所述,小檗碱导的HCT-15细胞的增殖抑制作用与激活MAPK-p38途径有关。
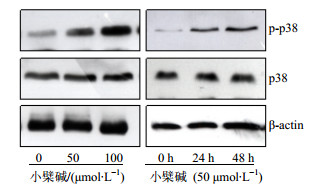
|
图 6 小檗碱对HCT-15细胞p38蛋白磷酸化的影响 Fig.6 Effect of berberine on p38 protein phosphorylation of HCT-15 cells |
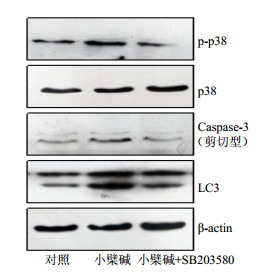
|
图 7 小檗碱和SB203580合用对HCT-15细胞MAPK-p38途径相关蛋白表达的影响 Fig.7 Effect of berberine combined with SB203580 on expression of protein related to MAPK-p38 pathway in HCT-15 cells |
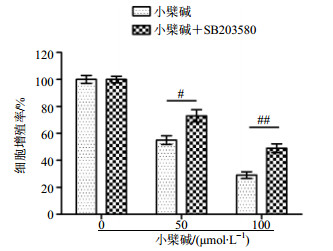
|
图 8 小檗碱和SB203580合用对HCT-15细胞增殖的影响(x±s, n=6) Fig.8 Effect of berberine combined with SB203580 on proliferation of HCT-15 cells (x±s, n=6) |
3.6 小檗碱对裸鼠体内肿瘤生长的影响
为了进一步证实小檗碱能在体内抑制肿瘤的生长,将相同数量处于对数期生长的HCT-15细胞接种到裸鼠的皮下部位。结果显示接种后小鼠的成瘤率为100%。从接种后的第5天开始测量,各组瘤体的生长状况基本相同(图 9),同时从第5天开始给予不同剂量的小檗碱处理小鼠,第10天开始,对照组裸鼠的肿瘤体积增长明显快于其他组,每组10只裸鼠所测量得到的结果取平均值,药物处理组和对照组比较差异具有统计学意义(P < 0.05、0.01)。待第30天实验结束后,剥出皮下肿瘤并称量肿瘤的质量,结果显示小檗碱处理组肿瘤质量明显低于未处理组,抑瘤率达到74%(表 1)。
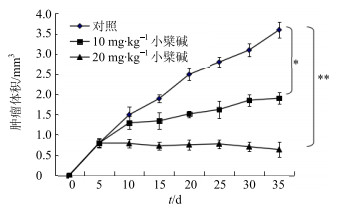
|
与对照组比较:*P < 0.05 **P < 0.01 *P < 0.05 **P < 0.01 vs control group 图 9 小檗碱对裸鼠体内肿瘤生长的影响(x±s, n=10) Fig.9 Effect of berberine on tumor growth of nude mice (x±s, n=10) |
|
|
表 1 小檗碱对裸鼠肿瘤质量的影响(x±s, n=10) Table 1 Effect of berberine on tumor weight of nude mice (x±s, n=10) |
4 讨论
小檗碱药理作用广泛[7-8],其抗癌机制还需要进一步的阐述[9-10]。由于其强大的抗菌活性,小檗碱通常被用于治疗各种传染病,包括细菌性腹泻、肠道寄生虫感染、眼部沙眼感染等。尽管许多研究也报道了小檗碱具有抗肿瘤活性,包括将肝癌HepG2细胞周期阻滞在G2/M期,诱导癌细胞凋亡等[11-12]。但其机制尚不明确。本研究阐述了小檗碱诱导HCT-15细胞发生自噬与凋亡,从而达到抑制癌细胞增殖的能力,进一步证实小檗碱通过激活p38途径达到其抑制增殖的作用。
越来越多的关于抗肿瘤药物的研究表明,其抑制肿瘤的增殖主要是通过诱导肿瘤细胞自噬和凋亡实现。自噬和凋亡为细胞程序性死亡的2种表现形式,自噬通常被认作是一种主动的死亡过程,而凋亡是一种被动的细胞死亡程序,有研究发现自噬可能是凋亡过程的一部分,自噬发生在凋亡的前期,当自噬达到一定程度后就会诱发凋亡[13]。本实验以小檗碱诱导HCT-15细胞为模型,通过免疫荧光以及免疫印迹发现小檗碱诱导的自噬现象指标以及凋亡指标都很明显,表明小檗碱同时诱导了HCT-15细胞的自噬和凋亡。当用自噬抑制剂3-MA阻滞小檗碱诱导的自噬,细胞的增殖率升高,表明小檗碱诱导的细胞自噬抑制了细胞增殖。同样的,用凋亡抑制剂Z-DEVD-FMK干预小檗碱诱导的细胞凋亡过程,细胞的增殖率也提高了,这些结果表明小檗碱诱导的自噬和凋亡共同抑制了细胞增殖,从而起到抗肿瘤的作用。
MAPK家族是细胞中广泛表达的丝氨酸/酪氨酸激酶,该信号的激活在哺乳动物的生命活动中起着重要的作用。MAPKs有3个主要家族ERK、JNK和p38。其中p38信号通路是MAPK通路重要的分支之一,其主要是在炎症反应、细胞应激、凋亡、细胞周期和生长等多种生理和病理过程中发挥作用。研究发现p38通路的激活参与了多种刺激引起的信号级联反应[14-15]。同时,p38在细胞凋亡中也显示调节效应,近年来的研究发现p38信号的激活是导致肿瘤药物发挥其抗肿瘤疗效、引起肿瘤细胞凋亡的必须途径[16-19]。因此其在凋亡中的作用受到众多研究者的关注。本实验中小檗碱诱导了细胞自噬和凋亡,从而抑制细胞的增殖,研究清楚小檗碱是如何诱导这一过程将有助于提高小檗碱的临床应用价值。实验结果表明小檗碱能诱导p38途径的活化,当用p38特异性抑制剂SB203580来阻止p38途径的激活时,能显著减弱小檗碱对HCT-15细胞的增殖抑制作用,同时在SB203580抑制p38途径的激活后,可以明显地阻滞小檗碱诱导的细胞自噬和凋亡,表明p38途径的激活是小檗碱发挥疗效的必经之路。鉴于p38信号在小檗碱诱导的细胞自噬和凋亡中的作用,下一步将考虑以p38为核心,在动物体内研究联合用药。
综上所述,小檗碱作为一种具有广泛药理作用的异喹啉类生物碱,在体内外均具有良好的抗肿瘤活性,主要是通过激活p38信号通路,激活自噬和凋亡的过程,从而抑制HCT-15细胞的增殖。
| [1] | 姜甜, 贾友宏, 李一石. 小檗碱调脂作用机制的研究进展[J]. 现代药物与临床, 2016, 31(5):727–730. |
| [2] | Tang J, Feng Y, Tsao S, et al. Berberine and Coptidis rhizoma as novel antineoplastic agents:a review of traditional use and biomedical investigations[J]. J Ethnopharmacol, 2009, 126(1): 5–17. DOI:10.1016/j.jep.2009.08.009 |
| [3] | Sun D, Kumarasamy V. A natural alkaloid, berberine, as a novel transcriptional repressor of RET proto-oncogene in medullary thyroid carcinoma[J]. Cancer Res, 2015, 75(15): 5546–5546. |
| [4] | Serafim T L, Oliveira P J, Sardao V A, et al. Different concentrations of berberine result in distinct cellular localization patterns and cell cycle effects in a melanoma cell line[J]. Cancer Chemoth Pharm, 2008, 61(6): 1007–1018. DOI:10.1007/s00280-007-0558-9 |
| [5] | Pereira G C, Branco A F, Matos J A, et al. Mitochondrially-targetted effects of berberine on K1735-M2 mouse melanoma cells-comparison with direct effects on isolated mitochondrial fractions[J]. J Pharmacol Exp Ther, 2007, 323(2): 636–649. DOI:10.1124/jpet.107.128017 |
| [6] | Pandey M K, Sung B, Kunnumakkara A B, et al. Berberine modifies cysteine 179 of IkappaBalpha kinase, suppresses nuclear factor-kappaB-regulated antiapoptotic gene products, and potentiates apoptosis[J]. Cancer Res, 2008, 68(13): 5370–5379. DOI:10.1158/0008-5472.CAN-08-0511 |
| [7] | 黄兴, 李艳芬, 寇冠军, 等. 小檗碱抗动脉粥样硬化作用机制研究进展[J]. 药物评价研究, 2016, 39(3):469–473. |
| [8] | Deng Y J, Zhang Y P, Yang Q H, et al. Effects of berberine on hepatic sirtuin 1-uncoupling protein 2 pathway in non-alcoholic fatty liver disease rats induced by high-fat diet[J]. Chin Herb Med, 2016, 8(4): 359–365. DOI:10.1016/S1674-6384(16)60063-1 |
| [9] | 温宝芳, 李文涛, 庄宝祥, 等. 盐酸小檗碱/叶酸-壳聚糖纳米粒的制备及其对CNE-1细胞的抑制作用[J]. 中草药, 2016, 47(20):3594–3601. |
| [10] | 张娜, 郭旭辉, 李林森. 小檗碱抗肿瘤作用机制研究进展[J]. 中华中医药杂志, 2013, 28(4):1030–1032. |
| [11] | Yu R, Zhang Z Q, Wang B, et al. Berberine-induced apoptotic and autophagic death of HepG2 cells requires AMPK activation[J]. Cancer Cell Int, 2014, 14(1): 1–8. DOI:10.1186/1475-2867-14-1 |
| [12] | Yip N K, Ho W. Berberine induces apoptosis via the mitochondrial pathway in liver cancer cells[J]. Oncol Rep, 2013, 30(3): 1107–1112. |
| [13] | Kapuy O, Vinod P, Mandl J, et al. A cellular stress-directed bistable switch controls the crosstalk between autophagy and apoptosis[J]. Mol Biosyst, 2013, 9(2): 296–306. DOI:10.1039/C2MB25261A |
| [14] | 龚小卫, 姜勇. 丝裂原活化蛋白激酶(MAPK)生物学功能的结构基础[J]. 中国生物化学与分子生物学报, 2003, 19(1):5–11. |
| [15] | Kamel WA-E, Sugihara E, Yamaguchi S I, et al. Statins induce apoptosis in osteosarcoma cells by activation of Ampk and p38-MAPK via suppression of mevalonate pathway[J]. Cancer Res, 2016, 76(14): 4182. |
| [16] | Ono K, Han J. The p38 signal transduction pathway activation and function[J]. Cell Signal, 2000, 12(1): 1–13. DOI:10.1016/S0898-6568(99)00071-6 |
| [17] | 王国军, 刘亚伟, 李玉花, 等. p38丝裂原活化蛋白激酶抑制剂研究进展[J]. 生物技术通讯, 2009, 20(3):399–403. |
| [18] | Hsieh Y H, Wu T T, Huang C Y, et al. p38 mitogen-activated protein kinase pathway is involved in protein kinase C α-regulated invasion in human hepatocellular carcinoma cells[J]. Cancer Res, 2007, 67(9): 4320–4327. DOI:10.1158/0008-5472.CAN-06-2486 |
| [19] | Semaan J, Pinon A, Rioux B, et al. Resistance to 3-HTMC-induced apoptosis through activation of PI3K/Akt, MEK/ERK, and p38/COX-2/PGE2 pathways in human HT-29 and HCT116 colorectal cancer cells[J]. J Cell Biochem, 2016, 117(12): 2875–2885. DOI:10.1002/jcb.v117.12 |
 2017, Vol. 48
2017, Vol. 48


