苦参总碱(Sophora flavescens alkaloids,SFA)系从苦参根中提取的生物碱[1],是苦参的主要活性成分,因苦参具有清热燥湿、祛风止痒的功效而历来为中医治疗皮肤病所推崇[2]。现代药理学研究表明,SFA可以安全地用于急性、亚急性湿疹的治疗[3]。但是,目前,SFA在治疗湿疹方面的剂型主要为汤剂、注射剂、乳膏、软膏、洗剂,存在使用不方便,药物发挥作用时间短,易污染衣物等缺点。而纳米乳凝胶(nanoemulsion-based gels,NBGs)可以改善以上缺点,其具有提高药物稳定性,增加难溶性药物的溶解度,无油腻感、易清除,对皮肤与黏膜无刺激性,延长药物作用时间,增加药物的透皮吸收等优点[4-6]。
明确药物在皮肤中的透皮作用机制对设计经皮给药系统十分重要。目前药物透过皮肤发挥治疗作用主要有以下几种方式:以融合扩散的方式通过角质层、改变表皮各层的超微结构、降低皮肤屏障作用、通过毛囊途径作用于机体[7-11]。因此本实验使用了扫描电子显微镜(scanning electron microscope,SEM)法、HE染色法、激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM)技术,从皮肤整体水平方法和微观结构研究了SFA纳米乳(SFA nanoemulsion,SFA-NEs)和SFA-NEs凝胶(SFA-nanoemulsion-based gels,SFA-NBGs)的透皮作用机制,这将对其制剂疗效发挥的正确评价,剂型选择的合理性,经皮给药的可行性以及经皮制剂的进一步开发应用具有重要的指导作用和实际意义。
1 仪器与试药 1.1 仪器与设备BSI10S型万分之一电子分析天平,赛多利斯仪器系统有限公司;HJ-6A型多头磁力搅拌器,常州国华电器有限公司;KH7200DB型数控超声波清洗器,昆山超声仪器有限公司。JEM-1230透射电子显微镜(TEM),日本电子株式会社;马尔文动态激光散射仪,英国马尔文公司;TK-12D型透皮扩散试验仪,上海锴凯科技贸易有限公司;Anton Paar Physica MCR302系列高级旋转流变仪,奥地利安东帕(中国)有限公司;Quanta 250环境扫描电子显微镜,捷克FEI公司;显微镜BA400,麦克迪奥实业集团公司;FV1000激光共聚焦扫描显微镜,日本Olympus公司。
1.2 试药与材料SFA提取物(1 g相当于原生药材125 g,SFA提取物中含苦参总碱以氧化苦参碱计为40.092 mg/g,以苦参碱计为180.997 8 mg/g),购自宁夏紫荆花制药有限公司;SFA-NEs、SFA-NBGs均为实验室自制;氯化钠,天津光复科技发展有限公司;香豆素6对照品,北京百灵威科技有限公司;中性福尔马林试剂(10%,NBF),北京高华伟业食品添加剂有限公司;肉豆蔻酸异丙酯(IPM),国药集团化学试剂有限公司;聚氧乙烯35蓖麻油(EL35),北京凤礼精求商贸有限责任公司;无水乙醇,北京化工厂;聚丙烯酸钠700(NP700),美国国际特品公司;卡波姆(CP-934),廊坊聚通化工有限公司。
1.3 实验动物SD大鼠,雄性,体质量180~220 g,购于北京维通利华实验动物技术有限公司,动物许可证编号SCXK(京)2012-0001。
昆明种小鼠,雄性,体质量18~22 g,购于北京维通利华实验动物技术有限公司,动物许可证编号SCXK(京)2012-0001。
2 方法与结果 2.1 SFA-NEs和SFA-NBGs的制备及质量评价将SFA 100.0 mg溶入90.6 mg IPM,再加入1.730 7 g EL35和1.352 0 g无水乙醇,在室温25 ℃以200 r/min的转速磁力搅拌0.5 h搅拌至均匀,作为含SFA的内相。然后缓慢滴入32.645 6 g去离子水,并以200 r/min的转速搅拌至澄清透明,即得SFA-NEs[12]。精密称取20.1 mg(0.4%)NP700与12.5 mg(0.25%)CP-934凝胶基质,再加入甘油1 mL研磨润湿,然后逐渐加入上述制备的3.074 3 g SFA-NEs研磨均匀,放置,即得SFA-NBGs。
用TEM对SFA-NEs和SFA-NBGs进行形态考察,发现SFA-NEs为外观圆整、均匀的球体,SFA-NBGs基本呈圆整均一的球体。马尔文动态光散射粒径仪测定结果显示SFA-NEs的粒径为15.60 nm,粒径分布值为0.185,SFA-NBGs的粒径为20.32 nm,呈正态分布,多分散系数为0.365。采用Franz扩散池对SFA-NEs和SFA-NBGs进行体外透皮行为的考察,其稳态渗透系数(Js)分别为24.353、15.157 μg/(cm2·h),而水溶液仅为5.418 9 μg/(cm2·h)。Anton Paar Physica MCR302系列高级旋转流变仪对其进行黏度考察,结果表明所制备SFA-NEs的黏度不随剪切速率变化而变化,属于牛顿流体,黏度为8.69 mPa·s(剪切速率为100 s−1),而SFA-NBGs的黏度随剪切速率的增大而减小,为非牛顿流体。因此,本实验所建立的SFA-NEs和SFA-NBGs制备工艺简单,体外透皮性能较好,可以显著提高SFA的经皮渗透量及透过速率,黏度适中,有利于在皮肤的黏附和涂展,可为SFA经皮给药制剂选择提供参考。
2.2 SEM法观察SFA-NEs和SFA-NBGs对皮肤角质层的影响 2.2.1 实验动物的分组与处理取昆明种小鼠36只,随机分为6组,每组6只,用25%的乌拉坦进行ip麻醉小鼠,用脱毛膏去掉腹部体毛,分别给予SFA-NEs、SFA-NBGs、生理盐水,另取对照组中小鼠未作任何处理的相同部位皮肤作为对照。根据预试验又将SFA-NEs和SFA-NBGs分为作用2 h组和作用6 h组。给药2 h后,剥取SFA-NEs和SFA-NBGs组小鼠皮肤;给药6 h后,剥取SFA-NEs、SFA-NBGs和生理盐水组小鼠皮肤,同时剥取对照组中未涂药的空白皮肤作对照,用生理盐水洗净皮肤后,滤纸吸干,备用。
2.2.2 SEM样品的制备及观察将处理好的皮肤分别用2.5%的戊二醛溶液固定1.5 h后,依次经70%、90%、100%乙醇梯度脱水。然后将脱水后的皮肤经二氧化碳干燥后表面喷胶体金颗粒制备成扫描电镜所需的皮肤样品,置于SEM下观察并拍照。结果如图 1所示。由图 1可知,正常小鼠皮肤的角质层平滑光整(图 1-A),经生理盐水处理6 h后,角质层出现轻微褶皱(图 1-B);SFA-NBGs作用2 h后,皮肤角质层出现明显褶皱,一些部位比较明显(图 1-C);SFA-NEs处理皮肤2 h后,角质层表面变得粗糙不平,褶皱较多且明显(图 1-D);SFA-NBGs作用6 h后,皮肤角质层出现严重皱缩,皱痕深且多,角质层结构已发生变化(图 1-E);而SFA-NEs作用皮肤6 h后,角质层不仅皱缩严重,而且明显可见碎裂的角质层(图 1-F)。由此说明,SFA-NEs和SFA-NBGs可以破坏皮肤角质层结构,使其失去原有的屏障功能,从而达到药物的透皮作用,而且SFA-NEs的作用强于SFA-NBGs。

|
A-正常皮肤角质层 B-SFA生理盐水处理6 h后的皮肤角质层 C-SFA-NBGs处理2 h后的皮肤角质层 D-SFA-NEs处理2 h后的皮肤角质层 E-SFA-NBGs处理6 h后的皮肤角质层 F-SFA-NEs处理6 h后的皮肤角质层 A-normal skin cutin layer B-skin cutin layer after 6 h of treatment with SFA saline C-skin cutin layer after 2 h of treatment with SFA-NBGs D-skin cutin layer after 2 h of treatment with SFA-NEs E-skin cutin layer after 6 h of treatment with SFA-NBGs F-skin cutin layer after 6 h of treatment with SFA-NEs 图 1 小鼠皮肤角质层SEM扫描图 Fig.1 SEM scintigram of mouse skin stratum corneum |
2.3 HE染色法研究SFA-NEs和SFA-NBGs对皮肤超微结构的影响 2.3.1 实验动物的处理
取雄性SD大鼠12只,随机分成2组,每组6只,经10%水合氯醛ip麻醉后,剪去腹部皮肤体毛后作为涂药区,一部分皮肤分别给予SFA-NEs、SFA-NBGs,另取附近未涂药皮肤作为空白对照,涂布生理盐水。给药8 h后,脱颈处死大鼠,剥取给药部位的皮肤,除去脂肪,生理盐水洗净,滤纸吸干,备用。
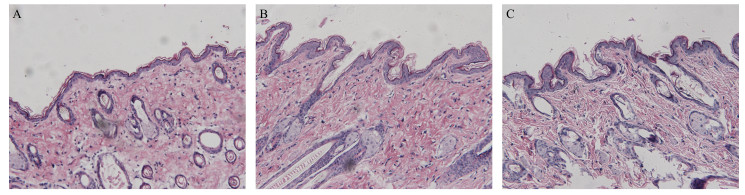
2.3.2 皮肤切片的制备及观察将已处理好的皮肤浸泡在中性福尔马林固定液中固化48 h,常规取材,用不同体积分数乙醇脱水,进行石蜡包埋切片,制片,HE染色后,置于显微镜下观察并拍照,结果见图 2。
|
A-生理盐水组B-SFA-NBGs组C-SFA-NBGs组 A-saline group B-SFA-NBGs group C-SFA-NBGs group 图 2 不同处理条件下的皮肤超微结构图(×200) Fig.2 Skin ultrastructure under different treatment conditions (× 200) |
从图 2可看出,生理盐水组的皮肤结构完整,各层排列紧密且清晰,角质层无增厚(图 2-A),SFA-NBGs处理后,皮肤结构发生变化,分层结构不明显,基底层排列不清,角质层明显疏松(图 2-B),而SFA-NEs作用后的皮肤分层结构紊乱,间隙增大,同时角质层结构疏松变薄,并出现脱落现象(图 2-C)。因此,通过皮肤超微结构的变化,可进一步表明,SFA-NEs和SFA-NBGs经皮渗透的作用还与其改变皮肤结构有关,且与SEM结果一致,SFA-NEs的作用强于SFA-NBGs。
2.4 CLSM技术研究SFA-NEs和SFA-NBGs对大鼠皮肤的影响 2.4.1 CLSM技术的检测原理CLSM技术作为一种新型的透皮分析技术现已广泛用于药物的经皮给药研究[13],用于透皮作用机制研究的原理是通过检测有荧光的药物或经皮给药制剂在皮肤各部位中的荧光分布情况,来分析不同部位对其透皮过程所起的作用[14]。其技术的关键点是研究对象必须有荧光现象[15],针对这一特点,本实验采用预试验采用过的香豆素6包埋法制备荧光标记的SFA-NEs和SFA-NBGs,然后采用CLSM技术法观察两者在皮肤中的分布情况。
2.4.2 荧光标记样品的制备(1)对照组溶液的制备:精密称取香豆素6对照品适量,加入IPM超声溶解,配制成0.5%的香豆素6溶液,作为对照组。
(2)荧光标记SFA-NEs的制备:按前期SFA-NEs的制备方法制备SFA-NEs,在加入水相前,滴加0.5%香豆素6溶液10滴,然后继续搅拌,再加入水相,即制得荧光标记的SFA-NEs。
(3)荧光标记SFA-NBGs的制备:在已制得荧光标记的SFA-NEs的基础上,按SFA-NBGs的制备方法加入凝胶基质,研磨均匀,即可制成荧光标记的SFA-NBGs。
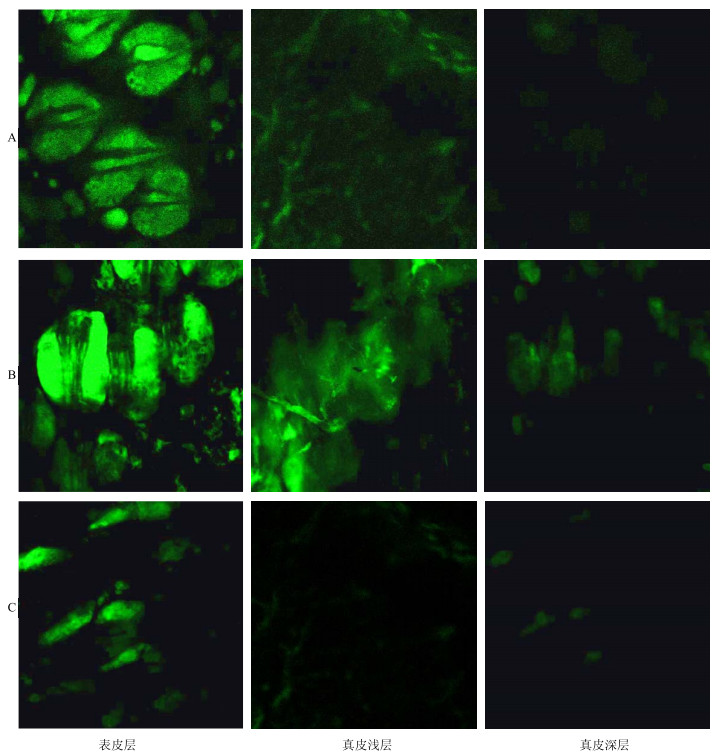
2.4.3 CLSM技术样品的制备及观察取昆明种小鼠18只,随机分为3组,每组6只,用0.25%的乌拉坦麻醉小鼠,用脱毛膏去掉其腹部体毛,将荧光标记的SFA-NEs、SFA-NBGs和香豆素6对照溶液分别给药于小鼠腹部皮肤,处理6 h后,处死小鼠,剥离给药部位的皮肤,生理盐水洗净,滤纸吸干多余水分,最后将皮肤平铺于载玻片上,用甘油封片。将载玻片置于CLSM下,光源Ar/He/Ne,激发波长488 nm,针孔大小100 μm固定不变,然后进行观察并采集图像。结果如图 3所示。
|
A-SFA-NEs B-SFA-NBGs C-0.5%香豆素6对照品溶液 A-SFA-NEs B-SFA-NBGs C-0.5% coumarin 6 reference solution 图 3 不同制剂在皮肤各层及附属器中的荧光分布图 Fig.3 Different preparations of fluorescence in each layer of skin and appendages in distribution |
实验结果发现,小鼠皮肤经不同制剂处理后,表皮层的荧光较强,其次是真皮浅层的荧光,真皮深层的荧光明显减弱,而且毛囊及其附属器周围的荧光强度明显比其他区域强。SFA-NEs组的皮肤各层荧光显著强于SFA-NBGs组和香豆素6溶液对照组,表明SFA-NEs能增加香豆素6在皮肤各层中的渗透。以上结果说明,SFA-NEs和SFA-NBGs透皮给药后,主要分布于皮肤表层和毛囊及其附属器等部位,这也提示,皮肤中的毛囊及其附属器对药物的透皮吸收也发挥了一定的作用。
3 讨论SEM法的放大倍数最高可达到50万倍,其分辨率在2~10 nm,可以清晰地观察到皮肤表层的微观立体结构。本实验通过SEM观察发现,正常小鼠皮肤角质层平滑光整,生理盐水处理6 h后角质层出现轻微褶皱,而经SFA-NEs和SFA-NBGs分别处理2 h和6 h后的皮肤角质层均发生不同程度的损伤,且SFA-NEs的作用强于SFA-NBGs。但值得注意的是,如果动物皮肤表面去体毛较多,则会严重影响观测,在SEM下很难找到皮肤的位置,但是若过分脱毛,又可能会影响皮肤角质层的性能或结构,因此对动物皮肤的脱毛程度要适宜,本实验采用了国外进口专用小鼠皮肤脱毛膏轻微、适度地脱掉部分毛发,结果良好。
HE染色法是皮肤病理组织染色最常用也是最重要的一种病理学染色技术。该法分别采用苏木精染液对细胞内的染色质与胞质内的核糖体进行染色,而用伊红染液对细胞质和细胞外基质中的成分染色,分别呈现出紫蓝色和红色,通过观察皮肤各结构的变化可揭示皮肤超微结构的改变。本实验通过HE染色法发现,生理盐水组皮肤结构基本完整,层次结构较清晰,SFA-NBGs组的皮肤分层结构不明显,基底层排列不清,角质层明显疏松;而SFA-NEs组皮肤分层结构紊乱,间隙增大,角质层疏松变薄,但在实验中要注意皮肤结构的完整性。
CLSM技术在透皮研究方面具有独特的优势,一方面CLSM技术能应用于药物对活体组织的透皮研究,从而更能真实地反映出药物对活体组织的作用效果和影响;另一方面,CLSM技术能使药物透皮过程可视化,能清楚地显示药物的透皮路径及药物在皮肤不同部位的具体分布。本实验通过CLSM实验结果发现,对照组、SFA-NEs组和SFA-NBGs组处理后的皮肤表面的荧光较强,深处荧光较弱,且在毛囊及其附属器附近的荧光较强,对照组的荧光均弱于SFA-NEs组和SFA-NBGs组。
4 结论以上3种方法的研究结果表明,SFA-NEs和SFA-NBGs的透皮作用机制主要是通过破坏皮肤角质层及皮肤超微结构,进而透过皮肤发挥治疗作用,同时皮肤中的毛囊及其附属器对药物的透皮吸收也发挥了一定的作用。SFA-NEs和SFA-NBGs经皮给药后的皮肤药动学和血液药动学研究,以及细胞水平和分子水平的透皮作用机制研究尚有待于探索。
| [1] | 李存玉, 马赟, 龚柔佳, 等. 响应面分析法耦合调节Donnan效应优化苦参提取液的纳滤浓缩工艺[J]. 中草药, 2016, 47(19):3395–3400. |
| [2] | 何雄, 韦星船, 田裕昌, 等. 苦参碱及其衍生物合成及生物活性研究进展[J]. 中国现代应用药学, 2011, 28(9):816–823. |
| [3] | 徐国红. 苦参治疗湿疹的药理作用研究[J]. 长春中医药大学学报, 2010, 26(5):781. |
| [4] | 王利胜, 张升, 刘丽萍, 等. 青藤碱微乳凝胶的制备及体外透皮特性研究[J]. 中药新药与临床药理, 2011, 22(1):21–24. |
| [5] | Xiao Y Y, Liu F, Cheng Z P, et al. Microemulsion based gel of fluorouracil for transdermal delivery[J]. Acta Pharm Sin, 2010, 45(1): 440–1446. |
| [6] | 刘继勇, 韩盈, 杨明, 等. 丹皮酚微乳凝胶剂的制备及体外透皮特性研究[J]. 中国中药杂志, 2009, 34(21):2730–2733. |
| [7] | 郭健新, 高凤艳, 平其能. 柔性纳米脂质体对皮肤角质层结构的改变[J]. 中国药科大学学报, 2004, 35(5):406–408. |
| [8] | 颉玉胜, 曾抗, 徐彦春, 等. 脂质体制剂影响大鼠皮肤超微结构的初步研究[J]. 西北国防医学杂志, 2004, 25(2):100–102. |
| [9] | 熊小英, 李娟. 酮洛芬微乳凝胶的制备及透皮机制[J]. 中国药科大学学报, 2012, 43(6):514–518. |
| [10] | 薛漫清, 梁庆, 黄钊, 等. 利用ATR-FTIR变化探讨薄荷醇对皮肤角质层结构的影响[J]. 中草药, 2012, 43(12):2474–2477. |
| [11] | 朱晓亮.纳米乳透皮作用机制及利多卡因纳米乳透皮局麻制剂的研究[D].广州:第一军医大学, 2007. |
| [12] | 贺葵邦, 王英姿, 冯艾灵, 等. 苦参地龙纳米乳凝胶的制备及其离体透皮吸收研究[J]. 中国中药杂志, 2013, 38(16):2623–2627. |
| [13] | 石德顺.醇质体促水溶性药物经皮渗透的机制研究[D].广州:南方医科大学, 2015. |
| [14] | 张鹏威.辣椒碱透皮微乳的研究[D].天津:天津大学, 2009. |
| [15] | 魏通达.共聚焦激光扫描光学显微成像关键技术研究[D].北京:中国科学院研究生院, 2014. |
 2017, Vol. 48
2017, Vol. 48


