人参Panax ginseng C. A. Mey. 是五加科多年生草本植物,具有抗氧化、抗衰老、增强免疫、抗肿瘤多种生物活性。根据人参生长环境与年限的不同分为野生人参(野山参)和种植人参(园参)[1]。野山参生长环境复杂,生长年限长达几十年,所遭受的氧化胁迫要强于园参。野山参为了响应和防御氧化胁迫,形成了一套调节及解毒机制,可有效清除氧化胁迫时产生的过多自由基[2]。
超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)和AsA-GSH循环酶类就是酶促清除系统[3]。在某些细胞器中,当无CAT存在时,AsA-GSH就会有效地清除细胞代谢产生的H2O2。AsA-GSH循环系统在植物抵抗氧化胁迫、延缓衰老、清除活性氧自由基方面具有重要作用[4]。为探究野山参与园参抗氧化能力差异,本实验比较了两者AsA-GSH循环中代谢物及相关酶活性的差异。
1 材料 1.1 样品30年生野山参采自于127°E,42°N,海拔500 m吉林省抚松县境内长白山山脉,5年生园参采购于吉林省抚松县,采样时间2014年8月20~23日。经露水河镇野山参基地总经理吴杰和长春中医药大学赵大庆教授共同鉴定为成熟野生和种植人参Panax ginseng C. A. Mey.。获得野山参5株及园参15株。新鲜野山参与园参样品用去离子水洗净晾干后,加入液氮研磨成粉末,放于-80 ℃冰箱冻存备用。
1.2 仪器与试剂德国Eppendorf离心机5804R,UV765紫外可见分光光度计,TECAN酶标仪,日立L-8900氨基酸自动分析仪,METTLER TOLEDO电子分析天平,电热恒温水浴锅(永光明医疗仪器有限公司)。试剂均为分析纯。
2 方法 2.1 酶液提取液的制备野山参和园参各取0.5 g用液氮研磨成粉末,加入2~4倍量0.2 mol/L pH 7.5的PBS缓冲溶液,4 ℃震荡2 h,12 000 r/min离心20 min,上清作为待测酶液。4 ℃保存备用。
2.2 抗氧化酶活性检测分别采用氮蓝四唑(NBT)法测定SOD活性,高锰酸钾滴定法测定CAT活性[5]。抗坏血酸过氧化物(APX)及谷胱甘肽还原酶(GR)活性测定参考Ma等方法[6]。单脱氢抗坏血酸还原酶(MDHAR)活性按照Nakano等[7]的方法测定。
2.3 抗氧化物检测谷胱甘肽(GSH)量参照Griffith等[8]方法测定。抗坏血酸(AsA)和脱氢抗坏血酸(DHA)量参照Hodges等[9]的方法测定。
2.4 氨基酸测定称取0.2 g的样品,放于水解管内。在水解管内加6.0 mol/L盐酸30 mL,再加入巯基乙酸l mL,盖上胶塞,用真空泵抽至真空并封口,将此水解管封口存放在(110±1)℃的恒温干燥箱内保温24 h后,取出冷却。打开水解管,将水解液过滤并冲洗定容至50 mL量瓶。吸取滤液1 mL于25 mL烧杯内,在水浴上蒸干,残留物用l mL 0.02 mol/L HCl溶解,立即使用氨基酸分析仪测定。
2.5 统计学分析实验数据均采用GraphPad软件进行数据处理和统计分析。
3 结果与分析 3.1 野山参与园参中SOD和CAT活性的比较SOD是植物体内清除自由基的重要酶之一,CAT作为一种酶类清除剂,可促使过氧化氢分解为分子氧和水,从而使细胞免于遭受H2O2的毒害,是生物防御体系的关键酶之一[10]。实验结果表明,野山参中SOD活性是园参的1.6倍,CAT活性是园参的1.79倍(图 1),提示野山参清除自由基能力优于园参。
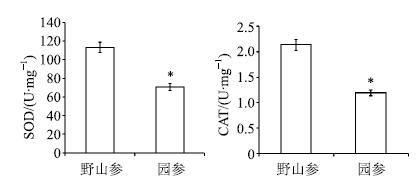
|
与野山参比较*P<0.05,下同 *P<0.05 vs wild ginseng,same as below 图 1 野山参与园参SOD和CAT活性比较 (x±s) Fig.1 Comparison of SOD and CAT activities in wild and cultivated ginseng (x±s) |
3.2 野山参与园参AsA-GSH循环中抗氧化酶活性的比较
APX、MDHAR、GR等抗氧化酶是AsA-GSH循环中的关键酶[11]。实验发现,野山参APX活性是园参的12倍,MDHAR活性是园参的3.16倍,GR活性是园参的2.75倍(图 2),在AsA-GSH循环体系中野山参抗氧化酶活性呈整体高于园参的趋势,证明野山参在维持体内氧化还原平衡能力上显著高于园参。
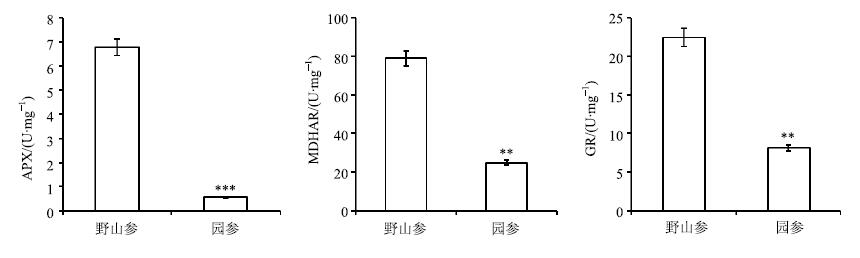
|
与野山参比较 **P<0.01 ***P<0.001,下同 **P<0.01 ***P<0.001 vs wild ginseng,same as below 图 2 野山参与园参抗氧化酶活性比较 (x±s) Fig.2 Comparison on anti-oxidant enzyme activity in wild and cultivated ginseng (x±s) |
3.3 野山参与园参AsA-GSH循环中抗氧化物量比较
在AsA-GSH循环体系中,酶的活力变化将会影响其抗氧化物的合成。图 3显示,野山参GSH量是园参的1.69倍,AsA量是园参的1.93倍,但野山参和园参的DHA无显著差异。AsA/DHA可反映抗氧化能力[12],野山参AsA/DHA是园参的1.9倍,表明野山参抗氧化、抗胁迫能力优于园参。
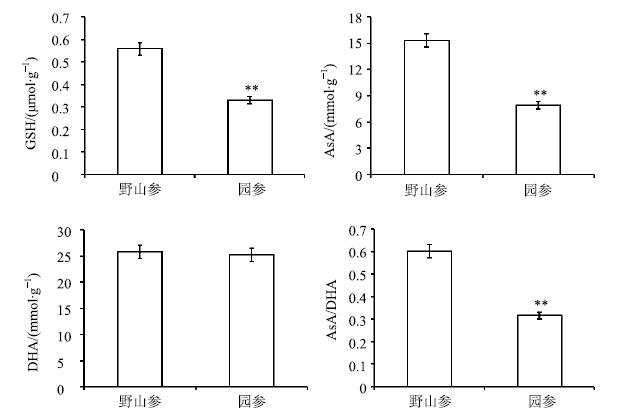
|
图 3 野山参与园参抗氧化物量比较 (x±s) Fig.3 Comparison on anti-oxidants contents in wild and cultivated ginseng (x±s) |
3.4 野山参与园参AsA-GSH循环中上游氨基酸量比较
谷胱甘肽是由谷氨酸、半胱氨酸和甘氨酸组成[13],研究发现这3种氨基酸在野山参中表达量高于园参。其中野山参谷氨酸量是园参的1.15倍,半胱氨酸量是园参的1.25倍,甘氨酸量是园参的1.38倍(图 4),为维持其下游GSH合成及AsA-GSH循环平衡提供了前体物质。
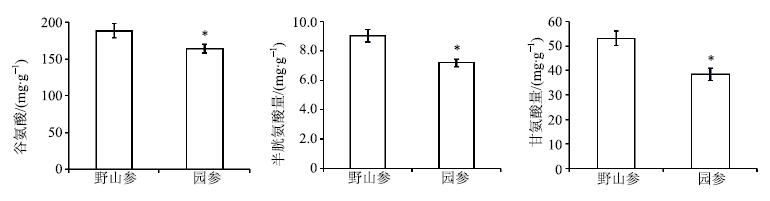
|
图 4 野山参与园参氨基酸量比较 (x±s) Fig.4 Comparison on amino acid contents in wild and cultivated ginseng (x±s) |
4 讨论
野山参作为“长寿”植物,在几十年甚至上百年的生长过程中,当光照、温度、金属离子等生长条件不适宜时会导致过量自由基的产生与积累,从而引起细胞膜脂过氧化、蛋白质变性及核苷酸损伤等氧化应激。为了能够健康生长,野山参要通过调控自身的防御体系,维持体内氧化还原平衡,保护细胞免受氧化损伤。为探其究竟,研究了野山参与园参AsA-GSH循环中下游的抗氧化酶、抗氧化物及上游3种关键氨基酸量差异分析。
当机体发生氧化应激时,SOD是植物防御体系中第一道防线,在野山参中活力较高,催化超氧阴离子歧化成O2和H2O2[14]。随后H2O2可通过CAT或AsA-GSH循环将H2O2还原成H2O。AsA-GSH循环中APX活性在野山参与园参的比率上显著高于CAT活性,CAT虽可以直接分解H2O2,但它与H2O2的亲和力相对于APX较弱[15]。因此AsA-GSH在野山参的抗氧化体系中占据重要地位。本实验发现AsA-GSH循环中野山参抗氧化酶(APX、MDHAR、GR)和抗氧化物(AsA、GSH)量均高于园参,确保野山参有效清除活性氧自由基,抵抗氧化胁迫。
本研究通过检测发现抗氧化物谷胱甘肽的量在野山参中显著表达,谷氨酸、半胱氨酸和甘氨酸作为GSH合成的前体物质,这3种氨基酸在野山参中量均高于园参。保障了AsA-GSH循环中GSH的高效再循环,从而形成一种氧化还原循环[16],不断清除细胞内过量的H2O2。
综上所述,研究结果表明,野山参在自然条件下常年经历着氧化胁迫,其自身可以通过同时上调SOD、CAT、AsA-GSH循环中的抗氧化酶和抗氧化物以及上游的氨基酸代谢,而提高其抗氧化能力,从而降低氧化胁迫对野山参所造成的氧化损伤,使其得以多年生存和生长,这也很可能是其药用价值高于园参的原因之一。
| [1] | 国家药典委员会. 中华人民共和国药典临床用药须知[M]. 北京: 人民卫生出版社, 2005. |
| [2] | 张维静, 陆海, 杜希华. 抗坏血酸过氧化物酶在植物抵抗氧化胁迫中的作用[J]. 山东师范大学学报:自然科学版, 2008, 23(4):113–115. |
| [3] | 吕品, 张岩, 李建华, 等. 植物细胞活性氧的产生和清除机制[J]. 生物学教学, 2010, 35(2):4–5. |
| [4] | 王聪, 朱月林, 杨立飞, 等. NaCl胁迫对菜用大豆种子抗坏血酸-谷胱甘肽循环的影响[J]. 植物营养与肥料学报, 2010, 16(5):1209–1216. |
| [5] | 邓茳明, 熊格生, 袁小玲, 等. 棉花不同耐高温品系的SOD、POD、CAT活性和MDA含量差异及其对盛花期高温胁迫的响应[J]. 棉花学报, 2010, 22(3):242–247. |
| [6] | Ma F C L. The sun-exposed peel of apple fruit has higher xanthophyll cycle-dependent thermal dissipation and antioxidants of the ascorbate-glutathione pathway than the shaded peel[J]. Plant Sci, 2003, 165(4): 819–827. DOI:10.1016/S0168-9452(03)00277-2 |
| [7] | Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant Cell Physiol, 1981, 22(5): 867–880. |
| [8] | Griffith O W. Determination of glutathione and glutathione disulfide using glutathione reductase and 2-vinylpyridine[J]. Anal Biochem, 1980, 106(1): 207–212. DOI:10.1016/0003-2697(80)90139-6 |
| [9] | Hodges D M, Lester G E, Munro K D, et al. Oxidative stress:Importance for postharvest quality:Oxidative stress:Postharvest fruits and vegetables[J]. Hortscience, 2004, 39: 924–929. |
| [10] | 王锦锦, 李重阳, 俞诗源, 等. 中药小复方(液)对麻黄素致损伤中肾SOD、CAT活性及Bax蛋白与TGF-β1表达的影响[J]. 中国细胞生物学学报, 2013, 35(7):943–949. |
| [11] | 杨宁, 丁芳霞, 李宜坤, 等. 低温胁迫对高山离子芥试管苗膜脂过氧化及AsA-GSH循环系统的影响[J]. 西北师范大学学报:自然科学版, 2014(5):79–84. |
| [12] | 王曼莹, 靳雯棋, 郭海洋, 等. 人参根组织形态及其生理生化活性成分相关性研究[J]. 华中师范大学学报:自然科学版, 2015, 49(3):428–433. |
| [13] | Zhang D Q, Xie B, Gao L X, et al. Intramolecular synergistic effect of glutamic acid, cysteine and glycine against copper corrosion in hydrochloric acid solution[J]. Thin Solid Films, 2011, 520(1): 356–361. DOI:10.1016/j.tsf.2011.07.009 |
| [14] | 王咏梅. 自由基与谷胱甘肽过氧化物酶[J]. 解放军药学学报, 2005, 21(5):369–371. |
| [15] | 苗雨晨, 白玲, 苗琛, 等. 植物谷胱甘肽过氧化物酶研究进展[J]. 植物学报, 2005, 22(3):350–356. |
| [16] | 段喜华, 唐中华, 郭晓瑞. 植物谷胱甘肽的生物合成及其生物学功能[J]. 植物研究, 2010, 30(1):98–105. |
 2017, Vol. 48
2017, Vol. 48


