2. 河北科技师范学院园艺科技学院, 河北 秦皇岛 066600
2. College of Horticulture Science and Technology, Hebei Normal University of Science & Technology, Qinhuangdao 066600, China
柽柳Tamarix chinensis Lour. 喜生于河流冲积平原、海滨、滩头、潮湿盐碱地和沙荒地。柽柳味甘、辛、性平,归肺、胃、心经,具有解热、镇痛[1]、抗肿瘤[2]和保肝[3]之功效。主治风湿痹痛、麻疹不透[4],柽柳为温带及亚热带树种,产于中国甘肃、河北、河南、山东、湖北、安徽、江苏、浙江、福建、广东、云南等省区,黄河流域及沿海盐碱地多有栽培。前人的研究主要集中在柽柳药用价值[5-6]、入侵能力和入侵特性[7-10]。例如通过比较欧亚本地柽柳和美国入侵柽柳的PepC基因,Gaskin等[11]发现柽柳的草本植物特性和种间杂交是柽柳作为入侵植物的原因之一。Cui等[12]发现柽柳的株高和直径与土壤含盐量呈负相关。蒋志敏等[13]和赵景奎等[14]分别采用ISSR和RAPD分子标记技术对黄河三角洲柽柳居群的遗传多样性进行了分析,认为该地区柽柳遗传多样性主要来自种群内。秦皇岛市位于河北省东北部,东经118°33′~119°51′,北纬39°24′~40°37′。东北接辽宁省绥中县,西北临河北省承德市,西靠唐山市的滦县、迁安,南临渤海。秦皇岛市浅水湾作为柽柳的自然基因宝库,在维持自身的生态平衡以及植物资源的种质保护上都具有极其重要的价值。秦皇岛沿海地区存在大量的天然柽柳林,本课题组在秦皇岛发现了高9.6 m,直径22.4 cm的柽柳,但未见关于本地区居群柽柳遗传多样性的相关报道。鉴于此,本研究利用ISSR分子标记,对秦皇岛柽柳的遗传多样性和居群内的分化水平进行研究,其成果为深入了解秦皇岛柽柳种质资源和制定合理有效的湿地生态系统保护策略提供必要的理论依据。
1 材料与方法 1.1 材料本研究的柽柳试材共32份,由河北科技师范学院杨俊明教授鉴定。其中28份采自秦皇岛浅水湾地区海滨(从浅水湾到金屋浴场),以白花柽柳、松柏柽柳和刚毛柽柳为对照,中华柽柳采自河北科技师范学院,具体样品信息见表 1。
|
|
表 1 供试32份柽柳品种 (系) 名称、编号和产地 Table 1 Names,codes,and places of 32 cultivars (strains) used in study |
1.2 方法 1.2.1 DNA提取及检测
采用高盐低pH值法提取DNA[15],用酶标仪检测A260/A280均在1.8左右,表明DNA提取纯度较高。
1.2.2 ISSR-PCR分析首先从加拿大British Columbia大学公布的100条引物中筛选出9条稳定性好、多态性丰富的引物(表 2),对32份柽柳材料进行扩增。引物、2xEs Taq MasterMix(含染料)以及2000DL DNA Marker均购自上海赛百盛基因技术有限公司。PCR反应体系为20 μL,2xEsTaq Master Mix 12.5 μL,100 μmol/L 引物1.0 μL,模板DNA 50 ng/mL 2 μL,RNase-Free Water 4.5 μL。扩增程序为94 ℃预变性5 min;94 ℃变性1 min,每个引物在合适的退火温度(表 2)下退火1 min,72 ℃延伸10 min,30个循环,4 ℃保存。PCR扩增反应在美国Bio-Rad公司生产的T100型PCR扩增仪上进行,用琼脂糖凝胶电泳检测PCR扩增产物。
|
|
表 2 用于分析柽柳遗传多样性的ISSR引物及扩增结果 Table 2 ISSR primers used in analysis of genetic diversity of T. chinensis and their amplification results |
1.2.3 数据分析
根据PCR扩增产物的电泳结果,人工读带,在凝胶的某个相同迁移率位置上有DNA条带的记为“1”,无DNA条带的记为“0”,从而生成由“1”和“0”组成的原始矩阵。用POPGEN32软件进行显性分析与聚类分析[16]。参照刘新龙等[17]的方法构建32份柽柳的DNA指纹图谱。
1.2.4 扩增产物相对分子质量估计根据Marker片段大小的对数值与电泳迁移距离绘制出DNA相对分子质量标准曲线图,然后用直尺量出每个扩增片段在胶板上的迁移距离,依据DNA相对分子质量标准曲线图计算出每个片段的相对分子质量。
2 结果与分析 2.1 ISSR引物扩增多态性分析9条引物共扩增出114个DNA位点,其中110个位点具有多态性,占总位点的96.49%,说明32份柽柳遗传多样性非常丰富。每条引物可以产生7~15个DNA扩增片段,平均每条引物可以产生12.67个扩增片段和12.22个多态性扩增片段。834引物在32份柽柳中的扩增图谱见图 1。
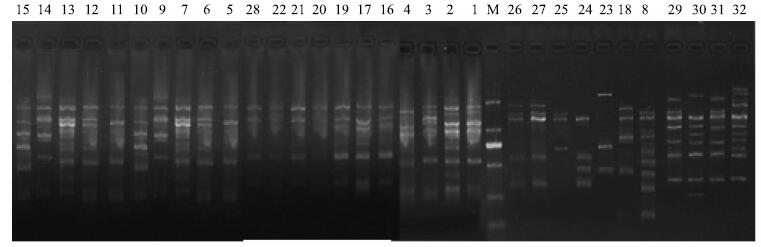
|
图 1 834引物在32份柽柳中的扩增图谱 Fig.1 ISSR amplification of 32 plant samples from T. chinensis using primer 834 |
2.2 遗传多样性分析
由POPGEN32分析显示,32份柽柳的平均观察等位基因数1.982 5,平均有效等位基因数1.543 7,平均Nei’s基因多样性指数(H)0.320 2,平均Shannon信息指数(I)0.484 2,其中有效等位基因最大值为2.000 0,最小值为0,H最大值为0.500 0,最小值为0,I最大值为0.693 1,最小值为0。说明秦皇岛柽柳居群内个体遗传多样性十分丰富。
2.3 聚类分析以32份柽柳和114个遗传位点的谱带数据为原始矩阵,基于遗传距离的聚类分析表明,在遗传距离28.79处将32份柽柳分成2大类(图 2),第1类包括的柽柳的编号分别是1~3、5~29、31~32,共30份柽柳。第2类是4和30号柽柳共2份柽柳。第1类在遗传距离26.47处再进一步分成2个亚类,第1个亚类的柽柳编号是1~3、5~29和32共29份柽柳;第2个亚类只有编号是31的刚毛柽柳。

|
图 2 32份柽柳的UPGMA聚类图 Fig.2 UPGMA dendrogram of 32 samples in T. chinensis |
2.4 特异标记与指纹图谱构建
通过对32份柽柳材料的ISSR 扩增图谱分析,引物810对22号柽柳扩增出2 953 bp左右的特异性条带。引物818对11号柽柳扩增出238 bp左右的特异性条带。引物824对10号柽柳扩增出385 bp左右的特异性条带。这些特异性条带可以作为柽柳品种鉴定的分子依据。
通过对32份柽柳ISSR扩增图谱分析,从筛选出的9条引物中又挑选出引物834,其扩增出14个多态位点,除26号柽柳滨海翠与27号柽柳短3的指纹图谱一致外,其他柽柳的谱带都不相同。由此可见,引物834可以将31份柽柳全部区分开。从而建立了32份柽柳的分子指纹图谱(图 3)。

|
图 3 ISSR标记构建32份柽柳分子指纹图谱 Fig.3 Molecular fingerprint of 32 samples in T. chinensis set up by ISSR marker |
3 讨论
在物种的进化中遗传多样性起着重要的作用。物种的适应性和新物种的出现依赖于丰富的遗传多样性。高水平的遗传多样性群体被认为是健康的适应性强的群体[18]。本研究中9条ISSR引物共在32份柽柳中扩增出114个DNA位点,其中112个位点具有多态性,占总位点的96.49%,平均Nei’s 基因多样性指数0.320 3。其中,本研究中的多态性位点数(P)和Nei’s基因多样性指数(H)均略低于蒋志敏等[13]用ISSR分析获得的P(98.2%)和H(0.406 1);同时本研究的H与赵景奎[14]用RPAD分析报道的柽柳种内H(0.313)基本一致。进一步说明柽柳的居群内遗传多样性非常丰富,同时也说明ISSR分子标记技术可以很好地用于柽柳居群内遗传多样性分析。
河北省秦皇岛市柽柳具有相对丰富的遗传多样性的原因:一方面与其多年生的习性有关。柽柳为两性花,既可同花授粉,又可异花授粉,极易发生居群内杂交,增大基因变异的概率,增大遗传多样性。另一方面与其复杂的交配体系有关。柽柳繁育系统为兼性异交[19],由于柽柳没有无融合生殖现象,虽然自交亲和,但缺乏自花传粉机制,必须通过传粉媒介(蝇类和蜜蜂等)为其授粉,这就大大增加了异交的机会,因此有可能提高柽柳遗传多样性的丰度。另外,近几年,秦皇岛沿海地区大量建筑的出现,也在一定程度上增加了柽柳居群内的异交机会。
目前,构建植物分子指纹图谱主要有特征谱带法[20]、引物组合法[21-23]和单引物方法[24-25] 3种方式。本研究采用单引物法,利用1条重复性好的ISSR引物构建了32份柽柳的分子指纹图谱,为今后观赏柽柳资源鉴定提供了参考。然而,随着柽柳不断的异交,本研究中的ISSR引物可能会无法鉴别,此时应采用更多的多态性引物组合或筛选新的分子标记将其区分开,以补充和扩展本研究初步建立的柽柳DNA指纹图谱。
该研究中柽柳居群内的遗传多样性非常丰富。鉴于此,本地区应该采取就地保护政策,建立柽柳资源保护区,即以秦皇岛浅水湾为中心保护区,重视大范围群体内不同类型个体的保存,要尽量防止人为因素造成遗传资源的流失。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | 王斌, 姜登钊, 李国强, 等. 柽柳抗肿瘤萜类成分研究[J]. 中草药, 2009, 40(5):697–701. |
| [3] | 赵润洲, 孙仕银, 陈发奎, 等. 西河柳药理作用的研究[J]. 中草药, 1995, 26(2):85. |
| [4] | Nasreen F, Navaid Z. Pharmacological and toxicological studies of Icterene, a herbal formulation of Tamarixpa kistanica, prepared by Hamdard Laboratories (Waqf) Paki stan, in rodents[J]. Proc Pakistan Congr Zool, 1993, 13(5): 185–193. |
| [5] | 陈柳生, 梁晓欣, 蔡自由, 等. 柽柳的化学成分研究[J]. 中草药, 2014, 45(13):1829–1833. |
| [6] | 李娟, 李玮琦, 郑萍, 等. 多枝柽柳中的酚酸类化学成分[J]. 中国中药杂志, 2014, 39(11):2047–2050. |
| [7] | Stromberg J C. Functional equivalency of saltcedar (Tamarix chinensis) and Fremont cottonwood (Populus fremontii) along a free-flowing river[J]. Wetlands, 1998, 18(4): 675–686. DOI:10.1007/BF03161682 |
| [8] | Wang Z, Liu L, Fang Y. Flowering characteristics and pollination ecology in Tamarix chinensis (Tamaricaceae) in the Yellow River Delta[J]. J Trop Subtrop Bot, 2005, 15(4): 353–357. |
| [9] | Whitcraft C R, Talley D M, Crooks J A, et al. Invasion of tamarisk (Tamarix spp.) in a southern California salt marsh[J]. Biol Invasions, 2007, 9(7): 875–879. DOI:10.1007/s10530-006-9081-x |
| [10] | 杨传平. 柽柳耐盐抗旱分子基础研究[M]. 北京: 科学出版社, 2015. |
| [11] | Gaskin J F, Schaal B A. Hybrid Tamarix widespread in US invasion and undetected in native Asian range[J]. Proc Natl Acad Sci USA, 2002, 99(17): 11256–11259. DOI:10.1073/pnas.132403299 |
| [12] | Cui B S, Yang Q C, Zhang K J, et al. Responses of saltcedar (Tamarix chinensis) to water table depth and soil salinity in the Yellow River Delta, China[J]. Plant Ecol, 2010, 209(2): 279–290. DOI:10.1007/s11258-010-9723-z |
| [13] | 蒋志敏, 陈玉霞, 包颖. 黄河三角洲柽柳居群的遗传结构和遗传分化[J]. 植物分类与资源学报, 2011, 33(4):403–408. |
| [14] | 赵景奎, 徐立安, 解荷峰, 等. 黄河三角洲柽柳群体遗传多样性RAPD分析[J]. 南京林业大学学报:自然科学版, 2008, 32(5):56–60. |
| [15] | 张娟, 张道远, 尹克林. 刚毛柽柳基因组DNA提取和RAPD反应条件探索[J]. 西北植物学报, 2003, 23(2):253–256. |
| [16] | Yeh F C, Yang R, Boyle T. Microsoft Window-based Freeware for Population Genetic Analysis Popgene, version 1.31[[M]. Canada: University of Alberta, 1999. |
| [17] | 刘新龙, 马丽, 陈学宽, 等. 云南甘蔗自育品种DNA指纹身份证构建[J]. 作物学报, 2010, 36(2):202–210. |
| [18] | Amos W, Harwood J. Factors affecting levels of genetic diversity in natural populations[J]. Phil Trans R Soc Lond B, 1998, 353: 177–186. DOI:10.1098/rstb.1998.0200 |
| [19] | 王仲礼, 刘林德, 方炎明. 黄河三角洲柽柳的开花特性及传粉生态学研究[J]. 亚热带植物学报, 2005, 13(4):353–357. |
| [20] | 童和林, 冯素萍, 贺军虎, 等. 菠萝微卫星指纹图谱的构建[J]. 果树学报, 2011, 28(2):240–245. |
| [21] | 匡猛, 杨伟华, 许红霞, 等. 中国棉花主栽品种DNA指纹图谱构建及SSR标记遗传多样性分析[J]. 中国农业科学, 2011, 44(1):20–27. |
| [22] | 段艳凤, 刘杰, 卞春松, 等. 中国88个马铃薯审定品种SSR指纹图谱构建与遗传多样性分析[J]. 作物学报, 2009, 35(8):1451–1457. |
| [23] | 郑海燕, 粟建光, 戴志刚, 等. 利用ISSR和RAPD标记构建红麻种质资源分子身份证[J]. 中国农业科学, 2010, 43(17):3499–3510. |
| [24] | 徐宗大, 赵兰勇, 张玲, 等. 玫瑰SRAP遗传多样性分析与品种指纹图谱构建[J]. 中国农业科学, 2011, 44(8):1662–1669. |
| [25] | 缪恒彬, 陈发棣, 赵宏波, 等. 应用ISSR对25个小菊品种进行遗传多样性分析及指纹图谱构建[J]. 中国农业科学, 2008, 41(11):3735–3740. |
 2017, Vol. 48
2017, Vol. 48


