橘核为常用中药材,来源于芸香科(Rutaceae)植物橘Citrus reticulata Blanco及其栽培变种的干燥成熟种子,栽培品种主要有大红袍C. reticulata ‘Dahongpao’[1]。其有效成分是柠檬苦素类化合物,主要分布于芸香科柑橘属[2-3],在柑橘属果实的不同部位中,又以种子中量最高[4]。角鲨烯合成酶基因(ss)、角鲨烯环氧酶基因(se)、葡萄糖基转移酶基因(lgt)在柠檬苦素类化合物生物合成路径的中、下游阶段发挥着重要作用,且ss、se、lgt基因分别已在灵芝[5]、竹节人参[6],人参[7]、绞股蓝[8]、刺五加[9]、大红袍[10]、柚[11]、椪柑[12]等药用植物中得到成功克隆。研究发现利用14C作基质在柑橘幼苗的茎(韧皮部)部进行示踪实验证明柠檬苦素的产生首先在茎部的筛管部位,经醋酸、甲羟戊酸等合成柠檬苦素类化合物的最初前体诺米林,并向叶、果实、种子等器官移动[13-15]。
灰色关联度分析(grey relational analysis,GRA)是依据两指标数据序列变化是否具有协同的趋势,以及通过对这种协同趋势的强弱来判定关联强度,是一种定量化比较分析方法,根据数列的可比性和相似性,分析系统内部主要因素之间的相关程度,确定相关程度最大的因素。故本实验采用超高效液相色谱(UPLC)法测定橘种子生长发育过程中茎、叶、果皮及种子中的柠檬苦素、诺米林、黄柏酮成分的量,与克隆获得的ss、se、lgt基因表达量进行灰色关联度分析,为柠檬苦素类化合物生物合成机制与转运规律的研究奠定基础。
1 材料 1.1 样品收集材料于2014年8~12月底每隔约15 d采自四川省蒲江县,分别是形态建成末期I(1)、形态建成末期II(2)、形态建成末期III(3)、成熟期I(4)、成熟期II(5)、成熟期III(6)、成熟期IV(7)、脱水期I(8)、脱水期II(9),见图 1。不同时期的样本均包含茎(J-1~J-9)、叶(Y-1~Y-9)、果皮(P-1~P-9)和种子(H-1~H-9)4部分。经成都中医药大学裴瑾教授鉴定为芸香科植物橘的栽培品种大红袍Citrus reticulata ‘Dahongpao’。茎、叶、果皮用无水乙醇清洁,果实用无水乙醇清洁后,摘取种子,剥去种皮,于-80 ℃冰箱保存,备用。

|
图 1 橘种子的生长发育过程 Fig.1 Growth process of tangerine seeds |
1.2 仪器
Agilent 1290 infinity高效液相色谱系统,Agilent MassHunter工作站,Agilent UPLC色谱分析柱;KQ5200E型超声波清洗器(昆山市超声仪器有限公司);电子天平(感量0.01 mg,德国Sartoius公司);DZKW-4型水浴锅(北京市中兴伟业仪器有限公司)。
1.3 试剂对照品柠檬苦素(批号MUST-14021606)、诺米林(批号MUST-14072101)、黄柏酮(批号MUST-14062801)购自成都曼思特生物科技有限公司,质量分数均大于98%。植物总RNA提取试剂盒(OMEGA公司),2×Taq PCR MasterMix(TIANGEN公司),东洋纺高效率逆转录试剂盒(TOYOBO公司),THUNDERBIRD SYBR qPCR Mix(TOYOBO公司),多功能DNA纯化回收试剂盒(BioTeke),ddH2O(TIANGEN公司)Agarose LE、Loadingbuffer(TIANGEN公司),Greenview(BioBRK公司),乙腈、甲醇(色谱级,美国Fisher公司)。
2 方法 2.1 柠檬苦素类化合物定量分析 2.1.1 色谱条件[16]色谱柱为ZORBAX SB-C18 USPL1柱(150 mm×3.0 mm,1.8 μm);流动相为甲醇-水(50∶50);检测波长210 nm;柱温30 ℃;体积流量0.2 mL/min;进样量2 μL。
2.1.2 对照品溶液的制备精密称取柠檬苦素对照品3.96 mg,超声溶解后加甲醇定容至10 mL,备用。精密称取诺米林对照品3.98 mg,超声溶解后加甲醇定容至10 mL,备用。精密称取黄柏酮对照品3.0 mg,超声溶解后加甲醇定容至10 mL,备用。色谱图见图 2。
|
图 2 混合对照品 (A) 和样品 (B) 色谱图 Fig.2 Chromatogram of mixed standard (A) and sample (B) |
2.1.3 供试品溶液的制备
将样本放置于研钵,加入液氮迅速研磨成粉末,精密称取500 mg置150 mL具塞锥形瓶中,加入甲醇25 mL,置70 ℃(甲醇沸点为64.5 ℃)水浴中加热回流40 min,滤过,吸取滤液15 mL置蒸发皿中,挥干,残渣加甲醇使溶解,转移至10 mL量瓶中,加甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。色谱图见图 2。
对橘生长发育过程中茎、叶、果皮、种子中柠檬苦素、诺米林、黄柏酮进行测定,结果见表 1。
|
|
表 1 有效成分测定结果 (n = 3) Table 1 Assay results of active ingredients (n = 3) |
2.2 功能基因的克隆与表达 2.2.1 总RNA提取和cDNA合成
RNA提取参照OMEGA生物公司植物总试剂盒说明书中方法一(适用于普通样品提取)操作步骤进行。琼脂糖凝胶电泳检测条带的总RNA进行反转录,反转录参照东洋纺TOYOBO逆转录反应试剂盒(批号FSK-100)中说明书操作步骤进行[10]。
使用软件Primer Primer 5.0、在线软件http://bioinfo.ut.ee/primer3-0.4.0、http://www.yeastgenome.org/cgi-bin/web-primer,见表 2。以cDNA为模板,使用2×Taq PCR MasterMix(带染料)进行PCR扩增,扩增体系20 μL:2×Taq PCR MasterMix,10 μL;正向引物1 μL;反向引物1 μL;cDNA模板,5 μL;ddH2O 3 μL。反应条件见表 3。PCR结果凝胶电泳检测,多功能DNA纯化回收试剂盒纯化回收PCR产物,由上海生工生物工程有限公司测序。ss、se、lgt基因测序结果分别为1 205、1 408、1 372 bp的序列。
|
|
表 2 功能基因的引物 Table 2 Primers of functional genes |
|
|
表 3 功能基因的反应条件 Table 3 Reaction conditions of functional genes |
2.2.2 功能基因在不同时期基因的表达分析
采用primer 5.0软件设计ss、se、lgt基因的 RT-PCR引物序列,见表 2。扩增体系均为25 μL:SYBRqPCR Mix 10 μL,正向引物1 μL,反向引物1 μL,cDNA 模板5 μL,ddH2O 8 μL。考察引物扩增曲线、熔解曲线及标准曲线,考察RT-PCR反应条件,见表 3;确定条件后按照TOYOBO逆转录反应试剂盒测定橘生长发育过程中茎、叶、果皮及种子的功能基因表达量[10],结果见表 4。
|
|
表 4 基因表达结果 Table 4 Gene expression results |
2.3 灰色关联度分析
采用DPS数据分析软件分析橘种子生长发育过程中柠檬苦素、诺米林、黄柏酮的量与ss、se、lgt基因表达量的灰色关联度。通过关联度的大小确定基因表达和有效成分之间的关系。关联度越大,表示该基因对有效成分的贡献值越大。灰色关联分析具体方法如下。
数据标准化公式如下:
| ${X_i}\left( k \right) = \frac{{{X_j}\left( k \right) - {X_i}}}{{{S_i}}}$ |
Xi(k)为标准化后的结果,Xi为同一性状平均值,Xj(k)为原始数据,Si为标准差
关联系数计算公式如下:
| ${L_{0i}}\left( k \right) = \frac{{\Delta \min + \rho \Delta \max }}{{\left| {{x_0}\left( k \right) - {x_i}\left( k \right)} \right| + \rho \Delta \max }}$ |
x0母序列与其他子序列xi的关联系数表示为L0i(k),最小差值为Δmin,最大差值为Δmax
关联度公式:
| ${\rm{roi}} = \frac{1}{N}\sum {_{k = 1}^N} {L_{0i}}\left( k \right)$ |
N为资源个数
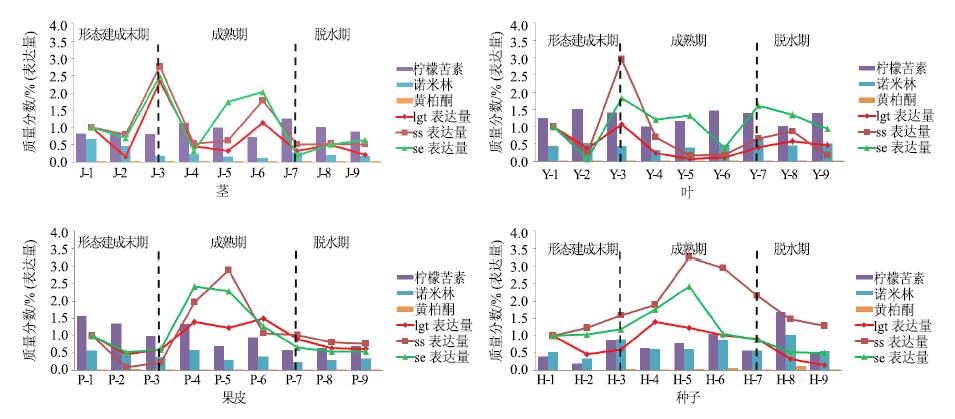
3 结果与分析将橘种子生长发育过程中茎、叶、果皮及种子中的柠檬苦素、诺米林、黄柏酮3种有效成分的量和ss、se、lgt基因表达量视为一个灰色系统,其中3种有效成分的量分别为母序列,ss、se、lgt基因相对表达量作为子序列,对原始数据作标准化变换。取0.5作为分辨系数,参数Δmin取值为各序列值得绝对差值。结果见图 3和表 5。分析结果可知:不同器官中柠檬苦素类化合物在种子中得到最大积累;不同器官中柠檬苦素类化合物的积累与ss、se、lgt基因表达均有较大的关联,但在种子中柠檬苦素的积累与ss、se、lgt基因表达最密切,其中ss基因表达对柠檬苦素、诺米林、黄柏酮的积累贡献最大。
|
图 3 不同器官发育不同时期功能基因表达与有效成分量关系 Fig.3 Relationship between functional genes and active ingredients in various organs |
|
|
表 5 灰色关联度分析 Table 5 Grey relational analysis |
4 讨论
通过实验研究发现,在橘种子生长发育过程中,柠檬苦素、诺米林、黄柏酮等柠檬苦素类化合物分别在茎、叶、果皮及种子中的积累变化趋势基本一致,且均表现为柠檬苦素>诺米林>黄柏酮。ss、se、lgt基因在同一器官中的表达变化趋势叶基本相同,茎、叶、果皮及种子中主要基因表达变化时期为种子成熟期,种子形态建成末期和脱水期基因表达变化程度较小。营养器官(茎、叶片)中有效成分总量变化不明显,繁殖器官(种子)中有效成分总量为升高趋势,且在脱水期量达到最大积累,主要因为在橘种子生长发育过程中,有效成分是从营养器官不断向繁殖器官转运,并在繁殖器官(种子)中积累,由此表明橘核为柠檬苦素类化合物的最终储存位置。
橘核作为柠檬苦素类化合物的主要贮存部位,其化学成分受基因影响程度与其他部位相比存在较大差异。
在柠檬苦素类化合物生物合成的中游主要是通过角鲨烯的环化作用实现的,首先2分子焦磷酸异戊烯酯(FPP)在ss基因的作用下经尾尾连接构成具有C30骨架的角鲨(squalene),然后角鲨烯在se基因的作用下催化角鲨烯转变为环氧化角鲨烯;接着通过系列环化和分子重排,生成柠檬苦素类化合物的前体诺米林;以诺米林为前提物质,黄柏酮、奥巴叩酸(obacunoate)为中间体向叶、果实、种子等器官移动,通过柠檬苦素类群、宜昌根辛类群、醋酸酯类群、卡拉敏群4条合成路径合成柠檬苦素等柠檬苦素类化合物,柠檬苦素在lgt基因的作用下在C-17连接1个葡糖糖分子而将其转化为柠檬苦素葡萄糖苷,表明不同器官中柠檬苦素类化合物的积累与ss、se、lgt基因表达均有关联,但在种子和叶片中柠檬苦素的积累与ss、se、lgt基因表达最密切,其中ss基因表达对柠檬苦素、诺米林、黄柏酮的积累贡献最大。
柠檬苦素在种子生长发育过程中不断积累,其在成熟期先降低后升高,脱水期得到最大积累,而ss基因在种子成熟期得到高表达,脱水期达到最低值;且诺米林作为柠檬苦素类生物合成的前提物质,黄柏酮作为中间产物,故ss基因表达与柠檬苦素、诺米林、黄柏酮的积累的关系密切。lgt基因在种子的成熟期得到高表达,使柠檬苦素又大量转化为柠檬苦素葡萄糖苷,导致柠檬苦素量降低。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | 李福兴, 王建江. 柠檬苦素类化合物的研究现状[J]. 国外医学中医中药分册, 2000, 22(3):131. |
| [3] | 徐玉娟, 施英, 肖更生, 等. 橘核中柠檬苦素类物质测定方法的研究[J]. 现代食品科技, 2006, 23(2):80–83. |
| [4] | 曾凡坤, 邹连生, 焦必林. 柑橘中类柠檬苦素含量及分布[J]. 中国食品学报, 2003, 3(4):79–81. |
| [5] | Zhou J S, Ji S L, Ren M F. Enhanced accumulation of individual ganoderic acids in a submerged culture of Ganoderma lucidum by the overexpression of squalene Synthase gene[J]. Biochem Engin J, 2014, 90: 174–183. |
| [6] | 黄志伟, 郑亚凤, 许明, 等. 竹节人参角鲨烯合成酶基因的克隆与生物信息学分析[J]. 江苏农业学报, 2013, 29(1):216–218. |
| [7] | Han J Y, In J G, Kwon Y S. Regulation of ginsenoside and phytosterol biosynthesis by RNA interferences of squalene epoxidase gene in Panaxginseng[J]. Phytochemistry, 2010, 71: 36–46. DOI:10.1016/j.phytochem.2009.09.031 |
| [8] | 蒋军富, 李雄英, 吴耀生, 等. 绞股蓝鲨烯环氧酶基因的克隆与序列分析[J]. 西北植物学报, 2010, 30(8):1520–1526. |
| [9] | 邢朝斌, 劳凤云, 龙月红, 等. 刺五加鲨烯合酶和鲨烯环氧酶基因单核苷酸多态性及其与总皂苷量的相关性研究[J]. 中草药, 2012, 43(10):2020–2024. |
| [10] | 王黎, 罗静, 裴瑾, 等. 橘核柠檬苦素葡萄糖基转移酶基因(lgt)的克隆与表达分析[J]. 中药材, 2015, 38(12):2493–2496. |
| [11] | 眭顺照, 张倩, 罗江会, 等. 柚苦味形成相关基因cmLGT的克隆与分析[J]. 果树学报, 2008, 25(4):607–610. |
| [12] | 罗静, 裴瑾, 康亚兰, 等. 椪柑柠檬苦素-UDP-葡萄糖基转移酶基因的克隆、分析及表达[J]. 中草药, 2014, 45(18):2691–2695. |
| [13] | Hashinaga F. Biosynthesis of nom ilin from 14C-acetate in the stema of yuzu and sudachi seedlings[J]. J Japan Soc Hort Sci, 1990, 59(3): 679–683. DOI:10.2503/jjshs.59.679 |
| [14] | Ou P, HasegawaS, Herman Z, et al. Limonoid biosynthesis is in the stem of Citrus limon[J]. Phytochemistry, 1988, 27(1): 115–118. DOI:10.1016/0031-9422(88)80600-9 |
| [15] | Herman Z, FongC H, Hasegawa S. Biosynthesisof limonoid glucosides in navelorange[J]. Phytochemistry, 1991, 30(5): 1487–1488. DOI:10.1016/0031-9422(91)84193-V |
| [16] | 罗静, 何中燕, 裴瑾, 等. 橘核的HPLC指纹图谱研究及聚类分析[J]. 中国药房, 2015, 26(3):419–421. |
 2017, Vol. 48
2017, Vol. 48


