2. 中国药科大学, 江苏 南京 211198
2. China Pharmaceutical University, Nanjing 211198, China
山楂为蔷薇科(Rosaceae)山楂属Crataegus L. 植物山里红Crataegus pinnatifida Bge. var. major N. E. Br或山楂Crataegus pinnatifida Bge. 的干燥成熟果实,味酸、甘,性微温,归脾、胃、肝经,具有消食健胃、行气散瘀之功效[1]。山楂临床常用于治疗高血脂、消化不良、冠心病及心绞痛等疾病[2-3]。本课题组前期研究表明,山楂能够显著降低高血脂症大鼠血清中的三酰甘油(TG)、总胆固醇(TC)及降低低密度脂蛋白(LDL)水平[4]。其中,TG是评价高血脂及心血管疾病的重要指标[5]。然而,山楂化学成分与降TG相关性研究尚未见报道。
中药谱效关系研究是通过数学统计分析方法,对中药指纹图谱中化学成分的变化与药效信息进行相关性分析,从而确定与药效相关的化学成分群。目前,构建谱效关系的数学统计分析方法主要有偏最小二乘法、多元线性回归分析、灰色关联度分析及人工神经网络分析等[6]。其中,偏最小二乘法在解决自变量之间多重相关性、样本点容量少于变量个数等问题方面具有独特的优势[7]。因此,本实验应用偏最小二乘法,对山楂降TG主要活性组分指纹图谱与药效进行相关性分析,以期初步揭示山楂降TG作用的物质基础。
1 材料 1.1 药品与试剂山楂(12批药材产地见表 1,采集时间2014年10~11月)经江西中医药大学刘荣华教授鉴定为山里红Crataegus pinnatifida Bge. var. major N. E. Br. 的干燥成熟果实,凭证标本(SZ20141001~SZ20141012)保存于江西中医药大学现代中药制剂教育部重点实验室B座501室。
|
|
表 1 山楂药材来源 Table 1 Sources of C. pinnatifida |
对照品表儿茶素(中国食品药品检定研究院,批号878-200102);芦丁、槲皮素、金丝桃苷(成都曼斯特生物科技有限公司,批号分别为MUST-15010707、MUST-12072505、MUST- 15050713),质量分数均大于98%;TG测试盒(批号20150810,南京建成生物工程研究所);胃蛋白酶(Sigma Aldrich有限公司);胰酶(上海阿拉丁生化科技股份有限公司);盐酸、氯化钠、氯化钾、氯化钙、碳酸氢钠(分析纯,西陇化工股份有限公司);奥利司他胶囊(山东新时代药业有限公司,批号085150303);猪胆盐(北京索莱宝科学技术有限公司);双蒸水自制。
1.2 仪器Triple TOF 5600四级杆飞行时间质谱(美国AB公司);Ultimate 3000型超高效液相色谱仪(3600RS型六元泵、3000TFC型自动进样器、3000RS型柱温箱、3000RS型DAD检测器,美国Thermo Scientific公司);LC-30A液相色谱仪与UV-2550型紫外-可见分光光度计(日本Shimadzu公司);BT25S型万分之一电子天平[德国Sartorius(北京)公司];HWS24型电热恒温水浴锅(上海一恒科学仪器有限公司);GL-16-II型高速冷冻离心机(上海安亭仪器厂);QYC-200型恒温摇床(上海福玛试验设备有限公司)。
2 方法与结果 2.1 山楂不同化学物质组制备称量山楂200 g,按1∶3的料液比加入70%乙醇,回流提取3次,每次2 h,合并提取液,减压回收乙醇,得到山楂70%乙醇提取物,即组分I。将山楂乙醇提取物总浸膏按1∶1加水混悬,用石油醚按1∶1萃取3次,得石油醚部位与水部位,将石油醚部位,减压回收溶剂,得组分II。将水部位用盐酸调pH值至2.0±0.5,再用水饱和正丁醇萃取,得水饱和正丁醇萃取部位与萃余水部位,萃余水部位加乙醇沉淀,得沉淀物,即组分III。将水饱和正丁醇部位用1% NaHCO3溶液按1∶1萃取3次,得碱水萃取部位和萃余后的水饱和正丁醇部位,将萃余后的水饱和正丁醇部位减压回收溶剂,得组分IV。在碱水萃取部位再次加入盐酸调pH值至2.0±0.5,再用水饱和正丁醇按1∶1萃取3次,得水饱和正丁醇萃取部位,减压回收溶剂,得组分V。
2.2 不同化学物质组总黄酮量比较依据文献报道[8],采用NaNO3-AlCl3-NaOH法,以芦丁为对照品,在500 nm波长处测定吸光度值,绘制标准曲线Y=1.132 0 X-0.021 6,r=0.999 3(Y为吸光度值,X为质量),以芦丁计在0.001~0.005 mg/mL内线性关系良好。在此基础上,对组分I~V中的总黄酮量进行比较,结果显示山楂组分IV中总黄酮的量明显高于其他组分,见表 2。
|
|
表 2 山楂不同化学物质组总黄酮量比较 (x±s±s,n = 3) Table 2 Comparison of total flavonoid content in different fractions of C. pinnatifida(x±s,n = 3) |
2.3 山楂降TG活性组分筛选[9-10] 2.3.1 葵花籽油乳剂配制
将20 mL乳化剂溶液(含0.2 mL 聚山梨酯80、11.70 mg NaCl及100 mg NaN3)与30 mL葵花籽油混合搅拌5 min,再经匀浆机进行乳化,制得葵花籽油乳剂,备用。
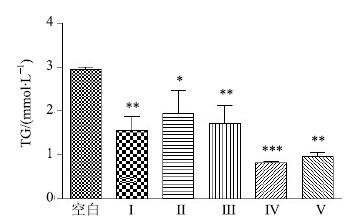
2.3.2 不同组分对体外TG水平的影响分别称取100 mg不同组分样品溶于8.5 mL盐溶液(含29.33 mg NaCl、22.18 mg KCl及3.30 mg CaCl2)于具塞锥形瓶中,加入6.5 mL胃蛋白酶溶液(含12.48 mg胃蛋白酶与250 mmol/L盐酸),加入200 μL葵花籽油乳剂,搅拌溶液30 min。然后,加入6.05% NaHCO3溶液5 mL并摇匀。加入10 mL胰酶胆盐溶液(含30 mg胰酶与375 mg猪胆盐),使得终体积为30 mL。盖紧瓶塞反应2 h,再打开瓶塞反应30 min,最后,盖紧瓶塞反应1.5 h。当pH值由6.2变为7.5时,加入24 mg奥利司他,反应10 min。取一定量反应液,离心,吸取上清液。经TG试剂盒测试,结果显示:与空白组(不加组分样品)相比,山楂各组分均可不同程度地降低TG水平(P<0.05),其中,组分IV降低TG能力最强(P<0.001),见图 1。
|
与空白组比较:*P<0.05 **P<0.01 ***P<0.001 *P<0.05 **P<0.01 ***P<0.001 vs blank group 图 1 山楂不同组分对体外TG水平的影响 (x±s±s,n = 6) Fig.1 Effect of different fractions of C. pinnatifida on TG level in vitro (x±s,n = 6) |
2.4 山楂组分IV的UPLC指纹图谱建立
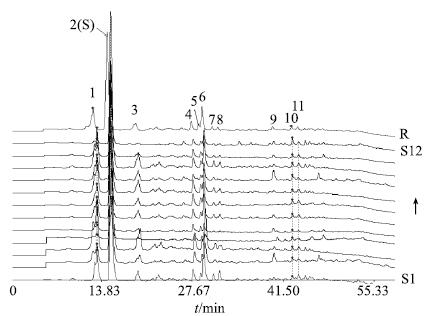
ACQUITY UPLC® HSS T3色谱柱(100 mm×2.1 mm,1.8 μm),流动相为乙腈(A)-0.1%甲酸水(B);梯度洗脱程序:0~33 min,7%→19% A;33~50 min,19%→28% A;50~60 min,28% A;体积流量0.3 mL/min;检测波长210 nm;柱温30 ℃;进样量10 μL。按照“2.1项”中组分IV的制备方法,从12批不同产地山楂药材中提取得到相应组分IV,按照上述色谱条件,得到相应的UPLC指纹图谱。利用《中药色谱指纹图谱相似度评价系统(2004A版)》软件,自动匹配12批次山楂组分IV样品,得到了11个共有指纹峰,2号峰为参比峰,见图 2。
|
图 2 12批山楂组分IV的UPLC指纹图谱 Fig.2 UPLC-DAD for 12 batches of fraction IV of C. pinnatifida from different habitats |
2.5 组分IV化学成分分析
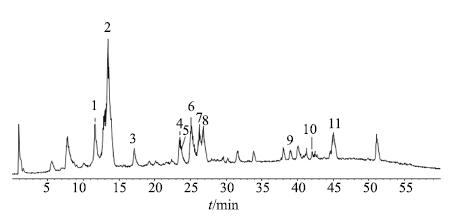
AB Triple TOF 5600四级杆飞行时间质谱仪采用电喷雾离子化(ESI)源,喷雾电压(IS):-4 500 V;离子化温度(TEM):600 ℃;雾化气(GS1)压力:344.74 kPa(50 psi);辅助加热气(GS2)压力:344.74 kPa(50 psi);气帘气(CUR)压力:172.37 kPa(25 psi);碰撞气(CAD):Medium;扫描模式:Negative。一级质谱采集范围为m/z 100~1 000,累积时间为200 ms;二级质谱采集范围为m/z 85~1000,累积时间为100 ms;碰撞能量(CE):40 eV;碰撞能量叠加(CES):15。组分IV总离子流图见图 3。
|
图 3 山楂组分IV负离子模式总离子流图 Fig.3 Total ion chromatogram (TIC) in negative ion mode of fraction IV of C. pinnatifida |
根据山楂组分IV总离子流图、准相对分子质量及碎片离子信息,归属山楂组分IV共有峰的成分,结果显示:峰2、3、5、6、7、10、11分别为表儿茶素、原花青素C1、芦丁、金丝桃苷、异槲皮苷、槲皮素、5-O-咖啡奎尼丁酯,峰1、4、8为B型原花青素二聚体,色谱峰9待定,见表 3。
|
|
表 3 山楂组分IV共有峰归属 Table 3 Common peaks determined by UPLC-Q-TOF-MS of fraction IV of C. pinnatifida |
2.6 偏最小二乘法相关性分析
应用SIMCA-P+ 12.0软件,以11个共有峰的峰面积作为自变量(X),以ΔTG(即TG空白与各批次TG实测之间差值)作为因变量(Y),运用偏最小二乘法进行相关性分析,见表 4,拟合得到回归方程为Y=0.103 X1-0.055 X2+0.084 X3+0.129 X4+0.258 X5+0.059 X6+0.043 X7+0.186 X8-0.194 X9-0.287 X10-0.023 X11,其中,1、3、4、5、6、7、8号色谱峰回归系数为正,即对ΔTG呈正相关,其余各峰则呈负相关,同时结果显示:以上各色谱峰所对应化合物对降TG作用贡献由大到小依次为芦丁(5)、B型原花青素二聚体(8)、B型原花青素二聚体(4)、B型原花青素二聚体(1)、原花青素C1(3)、金丝桃苷(6)、异槲皮苷(7)、5-O-咖啡奎尼丁酯(11)、表儿茶素(2)、槲皮素(10)。
|
|
表 4 山楂组分IV指纹图谱峰面积与TG药效数据 Table 4 Peak areas and TG content of Fr. IV of C.pinnatifida fruit |
3 讨论
高脂血症临床主要表现为血清中TG、TC及LDL水平升高,高密度脂蛋白(HDL)水平降低。山楂黄酮能够显著地降低高血脂大鼠血清中TG、TC及LDL水平和升高HDL水平[15]。本实验通过体外降TG研究发现,与其他组分相比,富含黄酮组分具有更强的降TG作用。这可能与过氧化物酶体增殖物激活受体γ(PPARγ)、CCAAT增强子结合蛋白α(C/EBPα)、固醇调节元件结合蛋白(SREBP-1c)及脂肪酸结合蛋白2(aP2)基因表达的下调有关[16]。对该组分指纹图谱中的11个共有峰进行定性分析,已推测得到9个黄酮类成分(槲皮素、表儿茶素、异槲皮苷、原花青素C1、金丝桃苷、芦丁和3个B型原花青素二聚体)和1个非黄酮类成分(5-O-咖啡奎尼丁酯)。相关文献报道,金丝桃苷[17]、原花青素[18]、槲皮素[19]及表儿茶素[20-21],等黄酮类成分能够显著降低高血脂大鼠血清中TG水平。而上述研究成果与本研究结果不尽相同。究其原因,本课题组认为作为一个多成分、多靶点综合作用的复杂整体,山楂降TG作用并非仅由个别成分的药效作用所决定。各成分在降TG过程中的相互作用,仍是不可忽视的关键问题。而本实验所采用的谱效关系研究优势在于可以阐明指纹图谱特征化学成分与药效的相互关系,确定相应的药效物质基础。通过体内药效验证实验,研究各成分在降TG主要活性组分中的贡献大小及1、4、8、9号色谱峰的结构鉴定将是本课题组下一阶段开展的研究工作。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | 杨志明. 浅议山楂临床作用[J]. 中医杂志, 2010, 51(S2):150–151. |
| [3] | 吴士杰, 李秋津, 肖学凤, 等. 山楂化学成分及药理作用的研究[J]. 药物评价研究, 2010, 33(4):316–319. |
| [4] | Shao F, Gu L F, Chen H J, et al. Comparation of hypolipidemic and antioxidant effects of aqueous and ethanol extracts of Crataegus pinnatifida fruit in high-fat emulsion-induced hyperlipidemia rats[J]. Pharmacognosy Magazine, 2016, 12(45): 64–69. DOI:10.4103/0973-1296.176049 |
| [5] | Nordestgaard B G, Varbo A. Triglycerides and cardiovascular disease[J]. Lancet, 2014, 384(9943): 626–635. DOI:10.1016/S0140-6736(14)61177-6 |
| [6] | 秦昆明, 郑礼娟, 沈保家, 等. 谱效关系在中药研究中的应用及相关思考[J]. 中国中药杂志, 2013, 38(1):26–31. |
| [7] | 唐启义, 唐洁. 偏最小二乘回归分析在均匀设计试验建模分析中的应用[J]. 数理统计与管理, 2005, 25(5):45–49. |
| [8] | 邵峰, 谷丽菲, 陈慧娟, 等. 不同产地山里红野山楂中总黄酮总有机酸含量比较[J]. 时珍国医国药, 2015, 26(1):11–13. |
| [9] | Vinarov Z, Petrova L, Tcholakova S, et al. In vitro study of triglyceride lipolysis and phase distribution of the reaction products and cholesterol:effects of calcium and bicarbonate[J]. Food Funct, 2012, 3(11): 1206–1220. DOI:10.1039/c2fo30085k |
| [10] | Vinarova L, Vinarov Z, Atanasov V, et al. Lowering of cholesterol bioaccessibility and serum concentrations by saponins:in vitro and in vivo studies[J]. Food Funct, 2015, 6(2): 501–512. DOI:10.1039/C4FO00785A |
| [11] | Prodanov M, Visitación V, Hernández T, et al. Chemical characterisation of Malvar grape seeds (Vitis vinifera L.) by ultrafiltration and RP-HPLC-PAD-MS[J]. J Food Compos Anal, 2013, 31(2): 284–292. DOI:10.1016/j.jfca.2013.06.003 |
| [12] | 许文, 傅志勤, 林婧, 等. HPLC-Q-TOF-MS和UPLC-QqQ-MS的三叶青主要成分定性与定量研究[J]. 中国中药杂志, 2014, 39(22):4365–4372. |
| [13] | Liu P, Yang B, Kallio H. Characterization of phenolic compounds in Chinese hawthorn (Crataegus pinnatifida Bge. var. major) fruit by high performance liquid chromatography-electrospray ionization mass spectrometry[J]. Food Chem, 2010, 121(4): 1188–1197. DOI:10.1016/j.foodchem.2010.02.002 |
| [14] | Clifford M N, Knight S, Kuhnert N. Discriminating between the six isomers of dicaffeoylquinic acid by LC-MSn[J]. J Agric Food Chem, 2005, 53(10): 3821–3832. DOI:10.1021/jf050046h |
| [15] | 刘北林, 董继生, 倪小虎, 等. 山楂黄酮提取及降血脂研究[J]. 食品科学, 2007, 28(5):324–327. |
| [16] | Wang T, An Y T, Zhao C F, et al. Regulation Effects of Crataegus pinnatifida leaf on glucose and lipids metabolism[J]. J Agric Food Chem, 2011, 59(9): 4987–4994. DOI:10.1021/jf1049062 |
| [17] | 李贵海, 孙敬勇, 张希林, 等. 山楂降血脂有效成分的实验研究[J]. 中草药, 2002, 33(1):52–54. |
| [18] | Bladé C, Arola L, Salvadó M J. Hypolipidemic effects of proanthocyanidins and their underlying biochemical and molecular mechanisms[J]. Mol Nutr Food Res, 2010, 54(1): 37–59. DOI:10.1002/(ISSN)1613-4133 |
| [19] | Juźwiak S, Wójcicki J, Mokrzycki K, et al. Effect of quercetin on experimental hyperlipidemia and atherosclerosis in rabbits[J]. Pharmacol Rep, 2005, 57(5): 604–609. |
| [20] | 林亲录, 施兆鹏, 刘湘新, 等. 儿茶素和表儿茶素对动物血脂的影响[J]. 中国食品学报, 2002, 2(3):16–20. |
| [21] | Ngamukote S, Mäkynen K, Thilawech T, et al. Cholesterol-lowering activity of the major polyphenols in grape seed[J]. Molecules, 2011, 16(6): 5054–5061. |
 2017, Vol. 48
2017, Vol. 48


