2. 山东省中医药管理局 中药化学重点学科, 山东 济南 250014;
3. 山东省中医药管理局中药药理重点学科, 山东 济南 250014;
4. 山东中医药大学, 山东 济南 250014
2. Key Discipline of Traditional Chinese Medicine Chemistry of Shandong Administration of Traditional Chinese Medicine, Jinan 250014, China;
3. Key Discipline of Traditional Chinese Medicine Pharmacology of Shandong Administration of Traditional Chinese Medicine, Jinan 250014, China;
4. Shandong University of Traditional Chinese Medicine, Jinan 250014, China
柴胡为伞形科植物柴胡Bupleurum chinense DC. 或狭叶柴胡Bupleurum scorzonerifolium Willd. 的干燥根,始载于《神农本草经》,列为上品;具有疏散退热、疏肝解郁、升举阳气之功效[1-2]。文献报道柴胡皂苷是柴胡主要化学指标和生物活性成分,现代药理研究表明,柴胡皂苷具有解热、镇静、抗炎、免疫调节、抗病毒、抗肝纤维化、抗肿瘤、止痛、抗炎、抗菌、保肝、抗肾炎等药理作用[3]。柴胡皂苷A是活性最强的柴胡皂苷类成分之一,但其结构不稳定,水煎即可使其结构发生变化[4];其口服生物利用度较低,在体内主要以代谢产物的形式存在[5-6],其转化成的次生苷及苷元同样具有生物活性,如柴胡皂苷b1抑制Na+,K+-ATP酶的活性明显高于柴胡皂苷A,但亦有活性减弱的情况存在[7-8]。本实验模拟药物口服后体内环境,研究柴胡皂苷A在人工胃液及肠道菌群作用下的生物转化,采用HPLC-DAD-MSn方法分析代谢产物,探讨其形成过程,为柴胡的物质基础及制剂研究提供依据。
1 仪器与材料1200系列高效液相色谱系统(美国安捷伦公司);6320离子阱质谱检测器(美国安捷伦公司);BP211D型电子天平(德国赛多利斯集团);Simplicity纯水仪(美国密理博公司);LDZX-40KBS立式压力蒸气灭菌器(上海申安医疗器械厂);THZ-82B气浴恒温振荡器(江苏金坛市医疗仪器厂);VS-1300-U型洁净工作台(苏州安泰空气技术有限公司)。
SD雄性大鼠,体质量200~250 g,购自山东大学实验动物中心,清洁级,许可证号SCXK(鲁)20130004。
柴胡皂苷A(中国食品药品检定研究院,质量分数≥98%,批号MUST-11052402);柴胡皂苷b1(成都曼斯特生物科技有限公司,质量分数≥98.5%,批号MUST-13091109)。
日本三菱MGC AnaeroPack系列厌氧培养袋、厌氧产气袋及氧气指示剂;乙腈(Fisher Scientific);厌氧培养液组成:37.5 mL A液(0.78% K2HPO4)和37.5 mL B液(0.47% KH2PO4、1.18% NaCl、1.2% (NH4)2SO4、0.12% CaCl2、0.25% MgSO4·H2O,混匀,再加入0.5 g L-半胱氨酸,2 mL 25% L-抗坏血酸,50 mL 8% Na2CO3,牛肉膏1 g,蛋白胨1 g,营养琼脂1 g,加蒸馏水至1 L,最后调pH 7.5~8.0 [9];人工胃液按《中国药典》2015年版配制。
2 方法与结果 2.1 柴胡皂苷的HPLC-DAD-MSn检测条件 2.1.1 色谱条件[1]色谱柱为Thermo ODS-2 hyperil(250 mm×4.6 mm,5 μm);流动相为乙腈(A)-水(B);梯度洗脱:0~50 min,25%~90% A;50~55 min,90% A;柱温25 ℃;体积流量1 mL/min;检测波长210 nm;进样量10 μL。
2.1.2 质谱条件[10-11]电喷雾离子源(ESI);正负离子交替扫描;扫描级数5级;扫描范围m/z 50~2 200;喷雾气压力241.325 kPa(35 psi);干燥气温度350 ℃;干燥气体积流量9 L/min;毛细管电压4 000 V,分流比4∶1。
2.1.3 对照品溶液的配制精密称取柴胡皂苷A和柴胡皂苷b1适量,以甲醇溶解并定容,经0.45 μm滤膜滤过,即得柴胡皂苷A和柴胡皂苷b1的混合对照品溶液。在上述条件下对照品谱图见图 1。
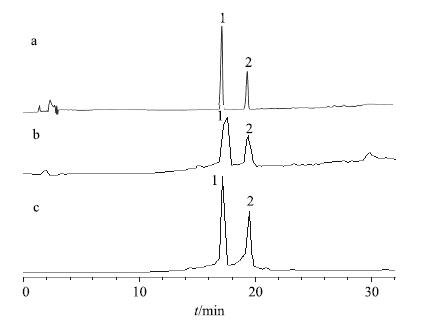
|
a-HPLC-UV图 (λ=210 nm) b-正离子模式质谱总离子流图 c-负离子模式质谱总离子流图 1-柴胡皂苷A 2-柴胡皂苷b1 a-HPLC-UV (λ = 210 nm) b-TIC of positive ion mode c-TIC of negative ion mode 1-saikosaponin A 2-saikosaponin b1 图 1 混合对照品HPLC-DAD-MSn谱图 Fig.1 HPLC-DAD-MSn of mixed reference substances |
2.2 柴胡皂苷A在人工胃液中的转化 2.2.1 转化反应及产物处理
精密称取柴胡皂苷A 1.0 mg,与10 mL人工胃液充分混合,用移液管分装于0、1、2、3、4、5号试管中,每管1.5 mL,置于37 ℃恒温振荡器中。分别在0、20、40、60、120、180 min时间点各取1只试管,用0.2 mol/L NaOH调节pH值至7.0终止反应。样品液减压蒸干,用甲醇定容于2 mL量瓶中,0.45 μm滤膜滤过,即得不同时间点的人工胃液转化产物样品液,同时做空白实验。
2.2.2 转化产物分析与鉴定采用“2.1”项下条件进行HPLC-DAD-MSn检测分析,柴胡皂苷A在人工胃液中的转化产物HPLC图及总离子流图见图 2。转化产物在正、负离子模式下的碎片离子见表 1。
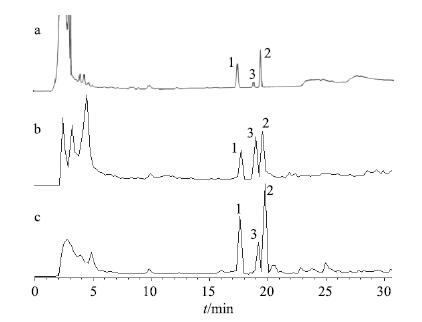
|
a-HPLC-UV图 (λ=210 nm) b-正离子模式质谱总离子流图 c-负离子模式质谱总离子流图 a-HPLC-UV (λ = 210 nm) b-TIC of positive ion mode c-TIC of negative ion mode 图 2 柴胡皂苷A在人工胃液中转化产物HPLC-DAD-MSn谱图 Fig.2 HPLC-DAD-MSn of transformation products of saikosaponin A in artificial gastric juice |
|
|
表 1 柴胡皂苷A及其在人工胃液中的转化产物的HPLC-DAD-MS数据 Table 1 HPLC-DAD-MS data of saikosaponin A and its degraded products in artificial gastric juice |
峰1:保留时间(tR)与柴胡皂苷A对照品一致,UV全波长扫描给出λmax 204 nm,MSn裂解碎片离子均与对照品柴胡皂苷A一致,确定为反应底物原型柴胡皂苷A。
峰2:tR为19.525 min,与对照品柴胡皂苷b1一致,UV全波长扫描给出λmax242、252、261 nm,提示为异环共轭双烯结构[12],MSn裂解碎片离子与对照品柴胡皂苷A相似,但负离子模式下MS4给出423.3 [M-glc-fuc-OH-CH2OH]-,提示其苷元结构中有-CH2OH,可能为柴胡皂苷A 13,28-环氧醚键开环所形成的28-CH2OH结构。因此,确定其为柴胡皂苷b1。
峰3:tR为18.925 min,UV全波长扫描给出λmax 281 nm,提示为同环共轭双烯结构[12],MSn裂解碎片离子与对照品柴胡皂苷A相似,而其在负离子模式下MS5亦给出423.3 [M-glc-fuc-OH-CH2OH]-,提示其苷元结构中有-CH2OH,可能为柴胡皂苷A 13,28-环氧醚键开环所形成的28-CH2OH结构。通过与文献中数据[13]比对,推测其为柴胡皂苷g。
由此可见,柴胡皂苷A在人工胃液的酸性条件下,13,28-环氧醚键开环形成28-CH2OH结构,得柴胡皂苷b1,再经双键重排得同环共轭双烯结构,即柴胡皂苷g(图 3)。HPLC外标法计算各时间点柴胡皂苷A和b1的量及转化率,发现柴胡皂苷A经与人工胃液共温孵,转化率随时间推移越来越高,见图 4,3h之后,柴胡皂苷A转化率达70%;其中,59.2%转化为柴胡皂苷b1。
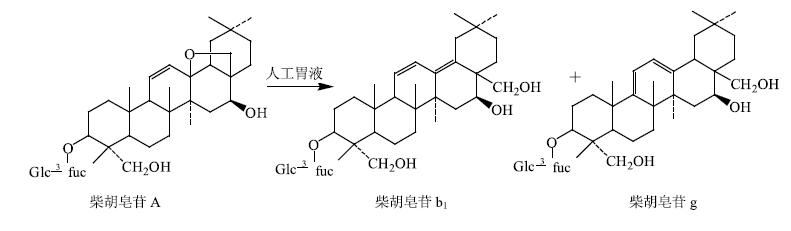
|
图 3 柴胡皂苷A在人工胃液中的转化产物 Fig.3 Degraded products of saikosaponin A in artificial gastric juice |
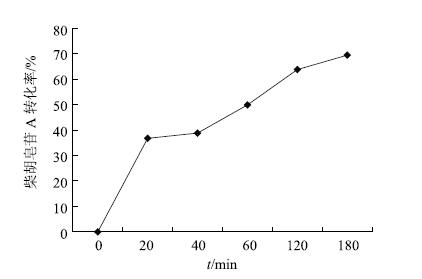
|
图 4 柴胡皂苷A在人工胃液中的转化率随时间变化曲线 Fig.4 Transformation rate-time curve of saikosaponin A in artificial gastric juice |
2.3 大鼠肠道菌群对柴胡皂苷A的转化影响 2.3.1 转化反应与产物处理
解剖大鼠,两端结扎后取下盲肠,取盲肠内容物约5 g,加入200 mL厌氧培养液中(含10 mg柴胡皂苷A),期间通入氮气,玻璃棒搅匀后得肠菌转化液,用移液管分装(每瓶25 mL),分别置于厌氧培养袋中,加入厌氧产气袋及氧气指示剂,封口,37 ℃厌氧状态下恒温振荡。分别于0、4、8、16、24 h取出,用10 mL乙醚萃取2次,10 mL正丁醇萃取2次,萃取液合并浓缩,用甲醇定容于2 mL量瓶中,0.45 μm滤膜滤过,即为肠菌转化产物样品。同时做空白实验。
2.3.2 转化产物分析与鉴定采用“2.1”项下条件对肠菌转化产物样品进行HPLC-DAD-MSn检测分析,HPLC图谱如图 5所示,总离子流图见图 6。转化产物在正、负离子模式下的碎片离子见表 2。将峰4和5的HPLC-DAD-MSn数据与文献报道[14-16]比对,确定峰4为柴胡次皂苷F,峰5为柴胡皂苷元F。
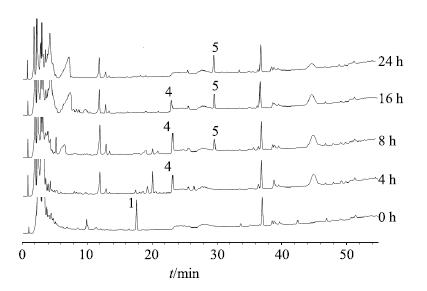
|
图 5 柴胡皂苷A肠道菌转化后反应液的HPLC-UV (λ210 nm) Fig.5 HPLC-UV (λ210 nm) of transformation products of saikosaponin A in intestinal flora |
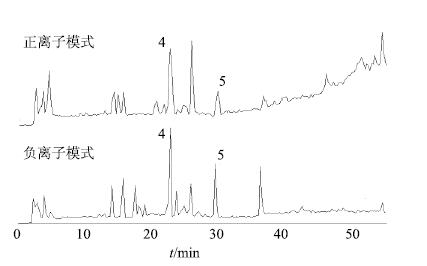
|
图 6 柴胡皂苷A在肠道菌群中的转化产物质谱总离子流图(温孵8 h) Fig.6 Total ion chromatogram of transformation products of saikosaponin A in intestinal flora (following incubation 8h) |
|
|
表 2 柴胡皂苷A在肠道菌群中的转化产物的HPLC-DAD-MS 数据 Table 2 HPLC-DAD-MS data of saikosaponin A and its degraded products in intestinal flora |
通过计算不同时间点肠菌液中柴胡皂苷A的量,与0时肠菌液中柴胡皂苷A的量比较,得其转化率。可见柴胡皂苷A与大鼠肠道内容物在厌氧状态下共温孵,4 h后其转化率达90%,16 h后转化液中已检测不到柴胡皂苷A。温孵4 h后反应液中检测到柴胡次皂苷F,其量先增后减,最终消失。温孵8 h后反应液中检测到柴胡皂苷元F,其量随时间推移越来越高。具体见图 7和8。由此可见,在厌氧状态下,柴胡皂苷A在肠菌液中发生水解反应,先脱去一分子葡萄糖,转化为柴胡次皂苷F,继续脱去一分子岩藻糖,最终转化为柴胡皂苷元F。
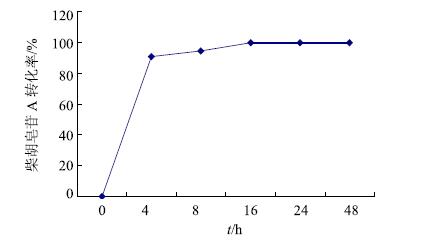
|
图 7 柴胡皂苷A在肠菌液中的转化率随时间变化曲线 Fig.7 Transformation rate-time curve of saikosaponin A in intestinal flora |
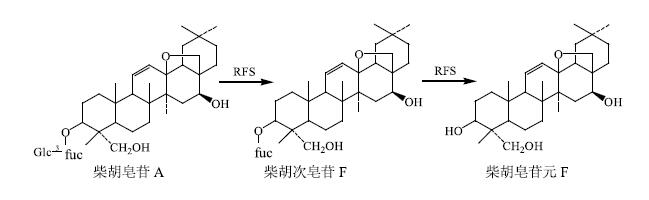
|
图 8 柴胡皂苷A在肠菌液中的转化产物 Fig.8 Degraded products of saikosaponin A in intestinal flora |
3 讨论
柴胡是一味常用中药。柴胡皂苷A为柴胡药材中主要的皂苷类成分,本研究模拟体内环境对柴胡皂苷A的转化过程进行研究,采用HPLC-DAD-MSn方法对不同时间点反应产物进行分析,结合文献报道推测反应产物结构。发现在胃酸环境下,柴胡皂苷A可迅速转化为柴胡皂苷b1和柴胡皂苷g,在肠道菌群环境下,柴胡皂苷A可先转化为柴胡次皂苷F,进一步转化为柴胡皂苷元F。因此,体内柴胡皂苷A的药物分布与浓度不能全面地反映其体内过程,应同时考察其转化产物。
柴胡皂苷A为五环三萜类皂苷。其苷元结构中13、28位之间的氧醚环不稳定,尤其在胃内酸性环境下易发生开裂。在肠道菌的作用下,糖苷键发生水解反应,生成去掉一个或几个糖基的次生苷或苷元。这是三萜皂苷肠道菌代谢的特征性反应,如甘草酸水解成3-葡萄糖醛酸甘草次酸和甘草次酸[17],毛冬青皂苷ilexsaponin A1转化为ilexgenin A[8],七叶树皂苷Ia水解为21β-O-巴豆酰基原七叶树皂苷元和原七叶树皂苷元[18]等,为肠道菌群所含苷键水解酶系所起的作用。
转化生成的次生苷和苷元同样具有一定的生物活性,构效关系表明,柴胡皂苷的功效与柴胡皂苷元配基单糖个数的多少以及苷元的结构有关[6-7]。柴胡皂苷结构极易转化,其生物利用度较低,在体内主要以代谢产物的形式存在。因此,其在体内代谢情况直接影响药效,结合柴胡皂苷体内发挥药效及毒性的物质基础研究,可以通过制剂或给药方式的改变而起到增效减毒的作用。
传统中药以口服给药为主,用药后体内除了中药中所含原型成分以外,还有大量代谢产物的存在,这些吸收入血并随血液循环分布于各组织的化学成分才是中药发挥药效的直接物质基础,因此,要揭示中药体内物质基础,代谢及代谢产物研究是不可缺少的一环。通过体外转化与体内药物代谢动力学研究相结合,明确药物的代谢过程,才能阐明柴胡皂苷发挥药效的真正物质基础,从而得到更加科学有效地应用。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | Gao K, Xu J S, Sun J, et al. Molecular cloning and expression of squalene epoxidase from a medicinal plant, Bupleurum chinense[J]. Chin Herb Med, 2016, 8(1): 67–74. DOI:10.1016/S1674-6384(16)60010-2 |
| [3] | 黄伟, 孙蓉. 柴胡皂苷类成分化学与药理和毒理作用研究进展[J]. 中药药理与临床, 2010, 26(3):71–74. |
| [4] | 李军, 姜华, 张延萍, 等. 柴胡水煎液中柴胡皂苷A和D的溶出与转化差异[J]. 中国药学杂志, 2014, 49(19):1692–1696. |
| [5] | Dobashi I, Tozawa F, Horiba N, et al. Central administration of saikosaponin-D increases corticotropin-releasing factor mRNA levels in the rat hypothalamus[J]. Neurosci Lett, 1995, 197(3): 235–238. DOI:10.1016/0304-3940(95)11933-N |
| [6] | 王一飞, 郝琨, 王广基, 等. 柴胡皂苷类物质体内代谢研究进展[J]. 医学综述, 2012, 18(16):2621–2623. |
| [7] | Hiai S, Yakoyama H. The effect of saikosaponin upon corticosterone secretion and affectation by hexadecadrol[J]. Chem Pharm Bull, 1984, 32: 1224–1227. DOI:10.1248/cpb.32.1224 |
| [8] | 周秋丽, 张志强. 柴胡皂甙和甘草甜素抑制Na+, K+-ATP酶活性的构效关系[J]. 药学学报, 1996, 31(7):496–501. |
| [9] | 赵钟祥, 李美芬, 林朝展, 等. 大鼠肠内菌对毛冬青皂苷ilexsaponin A1的代谢转化[J]. 中国药科大学学报, 2011, 42(4):329–332. |
| [10] | 许磊, 田稷馨, 宋瑞, 等. 柴胡醋制前后柴胡皂苷A、b2、c、d的LC-MS/MS法测定及比较[J]. 中国药科大学学报, 2012, 43(4):334–340. |
| [11] | 王嘉林, 王斯坦. HPLC-MS/MS测定小柴胡颗粒中柴胡皂苷A与柴胡皂苷d[J]. 安徽医药, 2015, 19(3):453–456. |
| [12] | 陈喜奎, 张如意, 张志亮, 等. 黑柴胡中皂苷成分的研究[J]. 北京医科大学学报, 1992, 24(3):222–224. |
| [13] | Bao Y, Li C, Shen H, et al. Determination of saikosaponin derivatives in Radix bupleuriand in pharmaceuticals of the Chinese Multiherb Remedy Xiaochaihu-tang using liquid chromatographic tandem mass spectrometry[J]. Anal Chem, 2004, 76(14): 4208–4216. DOI:10.1021/ac0499423 |
| [14] | 王英华, 邢世瑞. 小叶黑柴胡中皂甙成分的研究[J]. 中国中药杂志, 1998, 23(2):96–98. |
| [15] | Shimizu K, Amagaya S, Ogihara Y. New derivatives of saikosaponins[J]. Chem Pharm Bull, 1985, 33(8): 3349–3355. DOI:10.1248/cpb.33.3349 |
| [16] | Meselhy M R. Human intestinal bacteria responsible for the metabolism of saikosaponins[J]. J Tradit Med, 2000, 17(1): 1–11. |
| [17] | Kim D H, Lee S W, Han M J. Biotransformation of glycurrhizin to 18β-glycyrrhetinic acid-3-O-β-D-glucuronide by streptococcus J-22, a human intestinal bacterium[J]. Biol Pharm Bull, 1999, 22(3): 320–322. DOI:10.1248/bpb.22.320 |
| [18] | 杨秀伟, 赵静, 崔景荣, 等. 七叶树皂苷-Ia的人肠内菌生物转化产物及其抗肿瘤活性的研究[J]. 北京大学学报:医学版, 2004, 36(1):31–35. |
 2017, Vol. 48
2017, Vol. 48


