正电子发射型计算机断层扫描显像(positron emission tomography,PET)可以无创、定量、动态测定药物在活体内的分布、变化及生物利用度,并且具有很高的灵敏度及定量分析性能,是一个理想的药物研发平台[1-3]。我国有丰富的中药资源,目前拥有12 807种天然药物,其中药用植物11 146种,药用动物1 581种,药用矿物80种[4],是世界上的天然药物资源大国,中药有效成分的研究已取得很大进展,这些有效成分种类繁多,具有化学结构多样性、新颖性的特点,而且许多具有特殊的生物活性,已成为创制新药的源泉,也是得天独厚的开发新药的宝库,具有很高的二次开发价值[4]。如何立足我国丰富的中药资源,将PET活体显像技术引入中药有效成分的研发,具有探索意义。
左旋千金藤啶碱(L-stepholidine,L-SPD)是中药延胡索的有效成分,目前从延胡索中分离出了四氢原小檗碱同类物(tetrohydroprotoberberines,THPBs)生物碱17种,L-SPD是THPBs的先导物[5],是进行延胡索有效成分PET研究的理想模型药。另外,它具有多巴胺D1受体激动-D2受体抑制的双重作用特点[6],是迄今为止国际上发现的唯一的具有这种双重作用特征的药物,在多巴胺(DA)受体药理学中独具特色。有研究表明,L-SPD的双重药理作用机制为新型安定剂开辟了研究方向,并且在帕金森病、精神疾病、阿片类毒品成瘾的治疗方面有一定的潜在前景,因此具有广阔的二次开发价值[7-8]。本研究拟在研究合成11C-左旋千金藤啶碱(11C-L-SPD)的基础上,通过PET/CT显像,对11C-L-SPD在活体动物体内的生物学特性进行评价,为L-SPD的二次开发研究提供技术平台。
1 材料 1.1 药品与试剂L-SPD(中国科学院药物研究所);碘甲烷、碳酸钾(国药集团化学试剂有限公司);三氟甲基磺酰甲烷、氢化锂铝四氢呋喃溶液(德国ABX公司);含1%氧气的氮气(上海有机所优化特种气体供应公司);液氮(上海有机所优化特种气体供应公司);二甲基亚砜(江苏南新助剂厂);甲醇(上海吴泾化工有限公司)。
1.2 仪器及设备Siemens Inveon MicroPET/CT(Siemens CTI公司);RDS-111型回旋加速器(美国CTI公司);PET-CS11型碘代甲烷(CH3I)合成器及11C-CH3I合成模块(北京派特生物技术有限公司);2487紫外检测仪(美国Waters公司);NaVa-PaK C18柱(美国Waters公司);SN-684型γ计数仪(上海原子核研究所日环仪器厂);分析型反相HPLC系统(美国Waters公司);Millex-GS无菌滤膜(0.22 μm,美国Millipore公司)。
1.3 实验动物清洁级SD大鼠,雄性,体质量(200±20)g,由复旦大学实验动物中心提供,动物许可证号SCXK(沪)2013-0016。
2 方法 2.1 11C-L-SPD的制备利用RDS-111回旋加速器轰击氮氧混合气,束流20 μA,轰击时15 min,14N(p,α)11C反应产生11C,在靶内与氧气反应生成11C-CO2,经减压传到液氮冷却的Loop环内,11C-CO2由气态变为固态而被完全捕获,用升降马达将液氮容器移走;Loop环内捕获11C-CO2因空气的加热而缓慢升华,放射性气体经低压、缓慢传到内装入0.20 mL氢化锂铝四氢呋喃溶液反应管内,待放射性11C-CO2升华传输完毕,反应管150 ℃加热90 s。冷空气冷却反应管,通过气动方式自动加入0.4 mL 57%的氢碘酸,再次加热至150 ℃,用压缩空气冷却反应上部,产生的11C-CH3I由氮气载出。11CH3-I转化为11C-三氟甲基磺酰甲烷(11C-Triflate-CH3)后传入到溶有L-SPD前体的二甲基亚砜溶液中,在常温下反应得到产物。合成示意图见图 1。
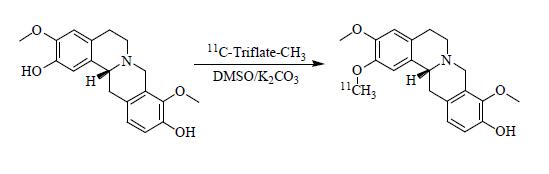
|
图 1 11C-L-SPD 的合成示意图 Fig.1 Chemical synthesis of 11C-L-SPD |
2.2 11C-L-SPD的质量控制 2.2.1 11C-L-SPD定性及放射化学纯度(RCP)鉴定
11C-L-SPD注射液与对照品12C-L-SPD溶液在同一个HPLC系统中分离,其保留时间应一致。
放射化学纯度测定采用HPLC法色谱条件:流动相为甲醇-乙腈-三乙胺(60∶20∶20,三乙胺0.05 mol/L,用磷酸调节至pH值3.0),体积流量为1 mL/min。
2.2.2 稳定性检测分别于11C-L-SPD标记后5、15、30、60、90、120 min行放射化学纯度测定。
2.3 11C-L-SPD在SD大鼠体内的PET/CT显像从大鼠下腹部外1/3处注入40 mg/kg的戊巴比妥钠,将大鼠固定于木板上,待大鼠停止颤动,尾iv 37 MBq 11C-L-SPD。分别于注射后5、15、30、45、60、90 min行全身PET/CT显像。先采集CT图像,在同一范围用三维模式采集PET图像。机器自动利用CT数据对PET图像进行衰减校正,进行图像重建和融合。采集结束后计算机自动进行迭代法重建,进行PET和CT的图像融合,分别获得PET、CT及PET/CT图像。
采集结束后把资料转入工作站进行数据分析,应用APM5自动化解剖标记模板对预处理后的11C-L-SPD扫描图像行感兴趣区勾画,包括全身、脑、心、肺、肝、肾、肠道、膀胱,可分别测得全身、脑、心、肺、肝、肾、肠道、膀胱的放射性计数(cpm)及体积(mL),进而获得全身及上述脏器的具体放射性计数,用各脏器每毫升体积的放射性计数除以全身的放射性计数,获得容积分布比值(distribution volume ratios,DVR),以DVR判断各脏器的药物分布状况。
3 结果 3.1 11C-L-SPD定性及放射化学纯度结果11C-L-SPD注射液与12C-L-SPD对照品溶液在同一个HPLC系统中分离,其保留时间一致,均为2.9 min(图 2)。11C-L-SPD放化合成时间为10~20 min,行HPLC分析放化纯度达99.1%。
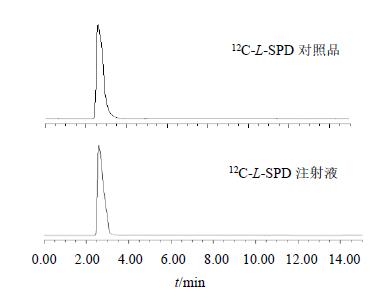
|
图 2 12C-L-SPD 对照品溶液和注射液HPLC Fig.2 HPLC of 12C-L-SPD reference substance and injection |
3.2 11C-L-SPD稳定性结果
11C-L-SPD注射液在室温条件下放置120 min,注射液在120 min内基本稳定,RCP缓慢下降,120 min RCP共下降3.6%,仍达95.5%(图 3)。
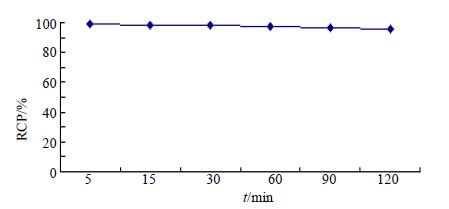
|
图 3 11C-L-SPD 稳定性检测结果 Fig.3 Stability test of 11C-L-SPD |
3.3 11C-L-SPD在大鼠体内的分布情况
PET/CT可以清晰地显示11C-L-SPD在大鼠体内的分布情况,PET图像可以直观地观察到11C-L-SPD在体内的分布特点,CT图像可以提供脏器的精确定位(图 4)。
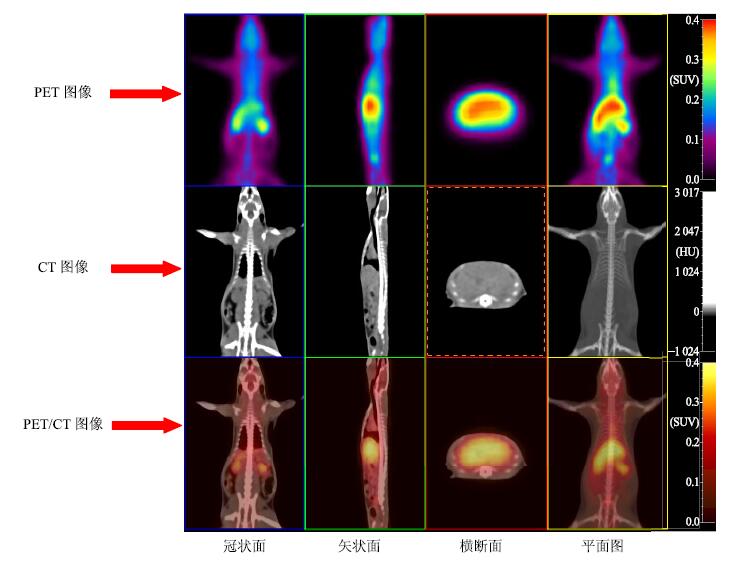
|
图 4 11C-L-SPD在大鼠体内分布的PET/CT活体显像 Fig.4 PET/CT images of 11C-L-SPD biodistribution in living rats |
PET/CT显像可以动态观察11C-L-SPD在体内的分布情况,并且可以定量计算。11C-L-SPD在正常大鼠体内放射性分布特点见图 5和6,定量结果见表 1。11C-L-SPD在体内吸收迅速,在5 min时在肝脏、肾脏、心脏、脑分布较多,膀胱及肠道可见放射性聚集;15 min时放射性主要分布在肝脏、肾脏,肠腔及膀胱出现较多放射性;30 min后肝影、肾影开始变淡,肠腔及膀胱放射性聚集越来越多;60 min后肝脏及肾脏基本不显影,放射性主要集中在肠腔及膀胱。肝、肾是11C-L-SPD的主要代谢及排泄器官,肝、肾、肠腔、膀胱在5 min放射性分布分别为(1.37±0.42)%、(1.10±0.19)%、(0.89±0.18)%、(0.97±0.11)%,90 min分别为(0.65±0.11)%、(0.54±0.05)%、(5.49±1.44)%、(9.86±1.88)%。显示在体内有快速清除的特点。
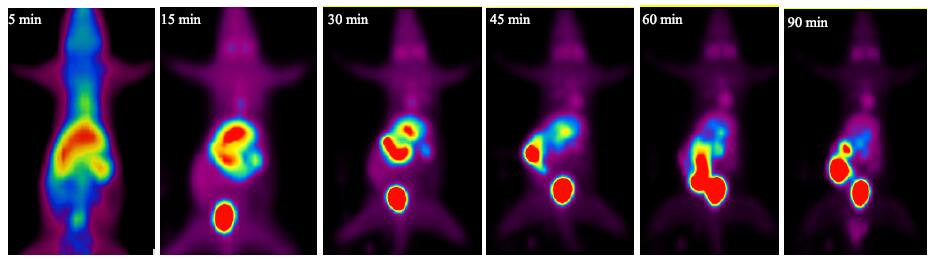
|
图 5 11C-L-SPD体内分布的PET动态显像 Fig.5 PET dynamic imaging of 11C-L-SPD distribution in vivo |
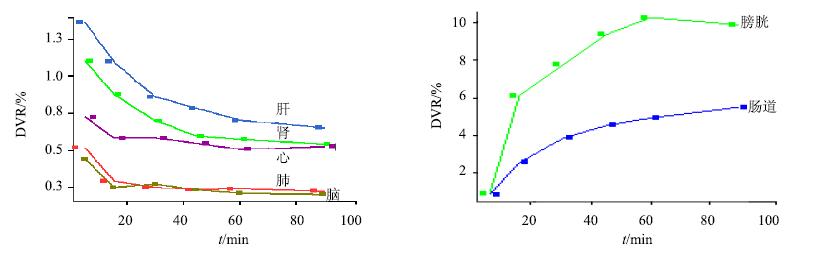
|
图 6 大鼠脑、肺、心脏、肝、肾、膀胱、肠道的11C-L-SPD时间-放射性曲线 (n = 5) Fig.6 Time-radioactivitycurves of 11C-L-SPD in brain,lung,heart,liver,kidney,bladder,and intestine (n = 5) |
|
|
表 1 PET/CT显像测定11C-L-SPD在正常大鼠体内DVR (x±s±s,n = 5) Table 1 DVR of 11C-L-SPD in rats measured by PET/CT (x±s,n = 5) |
4 讨论
PET用于药物研究的先决条件就是用正电子放射性核素标记各种药物,制备的正电子标记的药物必须能够表达所研究药物的药动学和药效学特性,这就要求正电子核素标记的药物不能改变母体药物的理化和生物学性质。由于绝大部分中药分子中含有碳原子(12C),因此,本研究使用12C的同位素11C标记中药单体化合物分子可满足上述要求。本研究选用正电子核素为11C半衰期较短,为20.4 min,仅适合有加速器配置的单位,但11C标记药物具有以下优点:①11C为组成生命最基本元素12C的放射性同位素,11C的甲基化不会改变目标化合物的结构,改变的仅是化合物中碳同位素的丰度,可以保持标记物与目标化合物的化学和生物学性质
一致,便于研究化合物的生物学分布;②11C的衰变方式为正电子放射性衰变,产生2个方向相反、能量均为511 keV光子,可用于PET显像,进而对目标化合物的代谢过程进行示踪;③因其半衰期短,故可在短期内重复实验。另外,国际上许多药物研究中心也多采用11C标记进行药物的研究[9-11]。
本实验显示11C-L-SPD放化纯度99.1%,稳定性试验在室温下放置,2 h内仍大于95%,稳定性较好,符合正电子放射性药物质量控制指标,满足作为探针的要求,因此制备的11C-L-SPD注射液可用于进一步的动物体内实验研究。
本研究表明,将11C-L-SPD静脉注入大鼠体内后,PET/CT显像不仅可动态、直观地观察到11C-L-SPD在体内的分布情况,同时还可使用相关软件对11C-L-SPD在体内的分布及代谢进行定量分析。
本研究表明11C-L-SPD主要从肝脏及肾脏进行代谢及排泄,在体内有快速清除的特点。因此对于肝肾功能不全的患者,要防止药物在体内的潴留,对于长期服用该药的患者要注意定期检查肝、肾功能。有研究表明长期大量使用L-SPD可造成大鼠血清肌酐和尿素氮的量增加;大鼠病理切片观察到肾小管管型,肾小管上皮细胞变性坏死和肾盂肾炎[12]。
11C-L-SPD在脑5 min即可达到高峰,为(0.44±0.15)%,15 min为(0.25±0.08)%,30 min为(0.27±0.12)%,显示L-SPD在脑中有快速摄取、快速清除的特点,这与Zhang等[13]以往的研究结果相一致。
本研究提示,PET用于药物研究的优势主要有以下几个方面:(1)能获得动态的数据资料。通过对活体实验动物的PET显像,不仅可以定量测定药物在各脏器的分布量,并且可以动态观察不同时间各脏器药物分布量的变化。(2)可以在同一动物身上进行无损伤的反复实验。以往的研究方法在动物实验阶段,多数数据的获得都是在处死并解剖动物后离体测量,降低了测得数据所反映的时值效应。而对实验动物在活体状态下进行PET显像,可消除传统研究方法中由于实验连续性中断或动物个体差异造成的误差,并且可以减少实验动物的使用,不仅节约了实验费用,也符合动物伦理学的要求。(3)PET显像可对整个动物进行有效的测量和在体外快速的扫描,从而可对整个实验过程进行纵向研究。这将有利于观察动物体内疾病的发展状况以及药物对疾病的治疗效果,从而快速得出更加明确的结论。
需要说明的是PET显像虽然可以直观观察11C-L-SPD 体内的代谢过程,但PET观察到的是体内11C标记的L-SPD,以及含有11C的L-SPD代谢产物,也即该方法无法区分原型药物和代谢产物。
总之,本研究初步表明使用正电子核素标记中药有效成分、并对之在活体动物体内的生物学分布进行PET显像研究在方法上是可行的。
| [1] | Gupta A, Wang S, Marko A, et al. Polyacrylamide-based biocompatible Nanoplatform enhances the tumor uptake, PET/fluorescence imaging and anticancer activity of a chlorophyll analog[J]. Theranostics, 2014, 4(6): 614–628. DOI:10.7150/thno.8478 |
| [2] | Vanhove C, Bankstahl J P, Krämer S D, et al. Accurate molecular imaging of small animals taking into account animal models, handling, anaesthesia, quality control and imaging system performance[J]. EJNMMI Phys, 2015, 2(1): 31. DOI:10.1186/s40658-015-0135-y |
| [3] | Yao R, Lecomte R, Crawford E S. Small-animal PET:what is it, and why do we need it?[J]. J Nucl Med Technol, 2012, 40(3): 157–165. DOI:10.2967/jnmt.111.098632 |
| [4] | 孙曼霁, 周廷冲. 中国药物的研究与发展[M]. 北京: 科学出版社, 1996. |
| [5] | 金国章, 孙宝存. 左旋千金藤啶碱(l-stepholidine)及其同类物作用于脑内多巴胺受体的研究进展[J]. 自然科学进展-国家重点实验室通讯, 1995, 5(1):55–63. |
| [6] | 王世真, 周前. 核医学正迈进PET时代[J]. 国外医学:放射医学核医学分册, 1997, 21(5/6):244–248. |
| [7] | 金国章. 回顾:开拓THPBs作用DA受体的研究领域及意义[J]. 生命科学, 2008, 20(1):58–63. |
| [8] | 于洋, 金国章. SPD对多巴胺D3受体(D3R)和腺苷受体(A2aR)的作用关系[J]. 中国药理通讯, 2005, 22(3):19–20. |
| [9] | One H, Suzuki K. Ketamine increases the striatal N-[11[C] methylspiperone binding in vivo:positron emission tomography study using conscious rhesus monkey[J]. Brain Res, 1994, 663(2): 191–198. DOI:10.1016/0006-8993(94)91263-7 |
| [10] | Ojeda-Flores R, Ortega-López N, ávila-Rodríguez M A, et al. Cardiac metabolism and perfusion evaluation in a rat model using 18F-FDG, 11Cacetate, 13NH3 and micro-positron emission tomography (microPET)[J]. Arch Cardiol Mex, 2010, 80(4): 215–228. |
| [11] | Coliva A, Monterisi C, Apollaro A, et al. Synthesis optimization of 2-(4-N-[11C]methylaminophenyl)-6- hydroxybenzothiazole ([11C]PIB), β-amyloid PET imaging tracer for Alzheimer's disease diagnosis[J]. Appl Radiat Isot, 2015, 105(11): 66–71. |
| [12] | 沈德莉, 陈丽娟, 谭云山, 等. 左旋千金藤碇碱对大鼠的慢性毒性和致突变试验[J]. 中国药理学与毒理学杂志, 2000, 14(5):397. |
| [13] | Zhang Z D, Zou C M, Jin G Z, et al. Pharmacokinetics and autoradiography of[3H] or[14C] stepholidine[J]. Acta Pharmacol Sin, 1990, 11(4): 289–292. |
 2017, Vol. 48
2017, Vol. 48

