2. 浙江中医药大学附属第三医院, 浙江 杭州 310053
2. Clinical Laboratory, The Third Affiliated Hospital, Zhejiang Chinese Medical University, Hangzhou 310053, China
动脉粥样硬化(atherosclerosis,As)是心血管疾病的病理基础,其发病机制复杂。巨噬细胞源性泡沫细胞是巨噬细胞表面的多种受体大量摄取氧化低密度脂蛋白(ox-LDL)颗粒后,在胞内蓄积大量的胆固醇酯和三酰甘油而形成,它是早期动脉粥样硬化斑块的主要成分[1]。抑制巨噬细胞源泡沫细胞的形成是预防和治疗AS的一个重要方向。
漆黄素(fisetin),又名非瑟酮,为3,3′,4′,7-四羟基黄酮,广泛分布于蔬菜和水果中,质量分数高达2~160 μg/g,具有抗氧化、抗炎、抗肿瘤、抗血管生成、调血脂及免疫调节的药理作用[2-3]。有研究发现漆黄素能通过防止低密度脂蛋白氧化,阻止巨噬细胞吸收ox-LDL,从而起到缓解AS的作用[4],但其机制尚未明确。本研究采用小鼠巨噬细胞RAW 264.7作为研究对象,分析漆黄素对ox-LDL诱导产生的泡沫细胞蛋白质组的影响,从蛋白质组水平阐明漆黄素抑制泡沫细胞形成的分子机制,为AS的早期预防和治疗提供新的药物靶点。
1 材料和方法 1.1 实验材料及仪器小鼠巨噬细胞RAW264.7购于中国科学院上海细胞库;血浆购于浙江省血液中心;漆黄素(质量分数99%,批号MKBX6653V)购自华东医药有限公司;RPMI 1640培养基、胰酶、新生小牛血清等购自杭州昊天生物技术有限公司;油红O染料购自Sigma公司;总胆固醇(TC)提取试剂盒;游离胆固醇(FC)提取试剂盒购自Sinopcr公司;细胞色素b5(Cyt b5)抗体购自Santa Cruz公司;Tris、DTT、甘氨酸、CHAPS购自Bio Rad公司;IPG胶条(24 cm,pH 4~7)购自GE healthcare公司。P80MX超速离心机(日本Hitachi公司);SpectraMax M3酶标仪(美国MD公司);细胞培养箱(德国Heraeus公司);DMIL型倒置荧光显微镜(德国Leica公司)。
1.2 ox-LDL的制备健康人血清经序列超速离心法及Sepharose 6B凝胶过滤法分离获取纯化的低密度脂蛋白(LDL)。Lowry法测蛋白浓度后加入适量1 mol/L CuSO4,使之终浓度为5 mmol/L,37 ℃水浴孵育24 h,使LDL氧化,并按丙二醛(MDA)测定试剂盒说明书方法测定LDL氧化程度。将氧化后的LDL(ox-LDL)转入透析袋中,于含0.1% EDTA-2Na的PBS缓冲液中室温透析24 h,浓缩后用0.22 μm微孔滤膜过滤除菌,测定浓度后于4 ℃保存,并在分离后2周内用完。
1.3 细胞培养RAW264.7细胞培养于含5%小牛血清、100 U/mL青霉素、100 U/mL链霉素的RPMI 1640培养基中,于37 ℃、5% CO2下培养,待细胞长至瓶底面积80%~90%进行传代,备用。
1.4 细胞活力检测取对数生长期RAW264.7细胞,计数后调整细胞密度为1×106个/mL,接种于96孔板中,每孔加200 μL(约2×104个)细胞。分为调零组、对照组、ox-LDL(10、20、30、40 μg/mL)组,每组6个复孔,37 ℃、5% CO2培养24 h。加入MTT孵育4 h后,加入DMSO 200 μL轻微震荡10 min,在波长490 nm处检测吸光度(A490)值。
取对数生长期RAW264.7细胞,按以上密度接种,用20 μg/mL ox-LDL作用24 h诱导成泡沫细胞后,分为调零组、对照组、漆黄素(60、80、100、120、140 μg/mL)组进行实验,作用24 h后,同以上步骤测定A490值。
1.5 细胞内TC及FC的测定取对数生长期RAW264.7细胞,计数后,按 1×106个/mL,接种于6孔板中,每孔加2 mL细胞。分为对照组、ox-LDL(10、20、30 μg/mL)组进行实验,细胞处理24 h后,1 200 r/min离心5 min,弃上清收集细胞,加入80 μL无水乙醇,超声10 s,工作10次,功率160 W,离心取上清,用TC和FC试剂盒分别测定TC和FC的量。并计算胆固醇酯(CE)比例[CE=(TC-FC)/TC]。细胞内CE比例大于60%提示泡沫细胞诱导成功[5]。
取对数生长期RAW264.7细胞,计数后,以上密度接种,用20 μg/mL ox-LDL作用24 h诱导成泡沫细胞后,分为对照组、漆黄素(60、80、100、120 μg/mL)组进行实验,作用24 h后,测定TC和FC的量,步骤同前,并计算细胞内CE比例。
1.6 油红O染色取对数生长期RAW264.7细胞,计数后,按1×106个/mL,接种于6孔板中,每孔加2 mL细胞。分为对照组(正常培养48 h)、ox-LDL(20 μg/mL ox-LDL作用24 h后,正常培养24 h)组和漆黄素(20 μg/mL ox-LDL作用24 h后,100 μg/mL漆黄素培养24 h)组进行实验。细胞处理后用PBS清洗3遍后加入4%多聚甲醛固定10 min,PBS轻轻洗1次,再用60%异丙醇固定5 min,用油红O染色15 min,立即用PBS清洗3遍,显微镜下观察泡沫细胞的形态特征并记录。
1.7 蛋白质组测定 1.7.1 细胞总蛋白质的提取将RAW264.7细胞接种于6个75 cm2培养瓶中,每瓶10 mL,细胞密度为5.0×105个/mL。培养8 h后,分为3组:对照组只加培养基培养,ox-LDL组加入20 μg/mL ox-LDL诱导24 h生成泡沫细胞,漆黄素组加入20 μg/mL ox-LDL诱导24 h后加入100 μg/mL漆黄素,培养24 h。用无菌生理盐水洗涤细胞3次。将细胞刮下来,加入1 mL细胞裂解液(30 mmol/L Tris,8 mol/L 尿素,4% CHAPS,pH 8.5),充分震荡,冰上裂解45 min。4 ℃ 12 000 r/min,离心20 min,收集上清。BCA试剂盒测定蛋白浓度后分装,置于-80 ℃保存。
1.7.2 双向电泳取约400 μg蛋白质,加入水化液至终体积450 μL,进行等电聚焦。电泳参数设置:30 V、12 h;200 V、1 h;500 V、1 h;1 000 V、1 h;8 000 V、8 h。聚焦完毕后胶条置于平衡液1(1% DTT,50 mmol/L Tris-HCL,6 mol/L尿素,30%甘油,2% SDS,0.002%溴酚蓝)、平衡液2(4%碘乙酰氨,50 mmol/L Tris-HCL,6 mol/L 尿素,30%甘油,2% SDS,0.002%溴酚蓝)中各平衡15 min。然后转移至12.5% SDS胶上,0.5%琼脂糖封顶,进行SDS-PAGE电泳,电泳参数设置:30 W、45 min和90 W、6 h。电泳完成后使用扫描仪扫描胶后,用Image Master6.0软件扫描并分析差异表达蛋白点,筛选出差异水平相差2倍以上的蛋白质。
1.7.3 质谱鉴定差异蛋白质切取差异蛋白质点,脱色、还原、酶解、萃取,冷冻干燥获得多肽片段。用1.2 μL含0.1% TFA洗脱液溶解多肽片段,靶点鉴定。采用MALDI-TOF-MS检测,得到肽质量指纹图谱,通过Mascot数据搜索,结合2-D图谱鉴定蛋白质。
1.8 免疫印迹法检测泡沫细胞内Cyt b5蛋白表达取对数生长期RAW264.7细胞,计数后,按 1×106个/mL,接种于6孔板中,每孔加2 mL细胞。分为对照组(正常培养48 h)、ox-LDL(20 μg/mL ox-LDL作用24 h后,正常培养24 h)组和漆黄素(20 μg/mL ox-LDL作用24 h后,100 μg/mL漆黄素培养24 h)组进行实验。作用48 h后,各组细胞用预冷的PBS缓冲液清洗3次,收集细胞后,加入预冷的细胞裂解液裂解细胞,混匀,超声破碎细胞;细胞液于4 ℃以12 000 r/min离心20 min,转移上清液于新的EP管中,并用BCA蛋白试剂盒测定蛋白浓度。取一定量的蛋白样品与上样缓冲液按比例混合后煮沸5 min,SDS-PAGE电泳80 V、1 h,100 V、2 h,半干转15 min,5%脱脂奶粉室温封闭2 h,弃奶粉,分别加入相应一抗,4 ℃孵育过夜,TBST漂洗3次,于室温和二抗反应2 h,TBST漂洗3次后进行ECL显色,Image J读取灰度值,以β-actin作内参,比较各组Cyt b5蛋白的表达情况。
1.9 统计学方法数据分析采用SPSS 13.0统计软件,以x±s表示,显著性检验用Students-t检验。
2 结果 2.1 ox-LDL对RAW264.7细胞活力的影响用0、10、20、30、40 μg/mL ox-LDL作用RAW264.7细胞后,细胞活力测定结果见表 1。当ox-LDL质量浓度≥30 μg/mL时,细胞活力受到显著抑制(P<0.05、0.01)。
|
|
表 1 ox-LDL对RAW264.7细胞活力的影响 (x±s±s,n = 6) Table 1 Effect of ox-LDL on viability of RAW264.7 cells (x±s,n = 6) |
2.2 ox-LDL对RAW264.7细胞内TC、FC和CE的影响
用0、10、20、30 μg/mL ox-LDL作用RAW264.7细胞后,细胞内TC、FC和CE量变化见表 2。当ox-LDL质量浓度为10 μg/mL时,细胞内CE量显著增加,而20 μg/mL时,RAW264.7细胞内CE达到62.80%,说明细胞已转化成泡沫细胞,同时该质量浓度对细胞无显著抑制作用,故本实验采用20 μg/mL ox-LDL诱导RAW264.7形成泡沫细胞。
|
|
表 2 ox-LDL对RAW264.7细胞内TC、FC和CE水平的影响 (x±s±s,n = 6) Table 2 Effect of ox-LDL on levels of TC,FC,and CE in RAW264.7 cells (x±s,n = 6) |
2.3 漆黄素对RAW264.7细胞活力的影响
当漆黄素质量浓度小于100 μg/mL时,泡沫细胞活力未受到显著抑制,当漆黄素质量浓度达到120 μg/mL时,对细胞的抑制作用显著增加,见表 3。
|
|
表 3 漆黄素对泡沫细胞增殖活力的影响 (x±s±s,n = 6) Table 3 Effect of fisetin on cell proliferation viability of foam cells (x±s,n = 6) |
2.4 漆黄素对泡沫细胞内CE的影响
不同质量浓度漆黄素作用于泡沫细胞后CE的量变化见表 4,当漆黄素质量浓度达到100 μg/mL时,细胞内CE的量明显降低,CE占TC比例为39.71%。因此,本实验选用100 μg/mL漆黄素进行后续实验。
|
|
表 4 漆黄素对泡沫细胞CE水平的影响 (x±s±s,n = 6) Table 4 Effect of fisetin on cholesterol ester content in foam cells (x±s,n = 6) |
2.5 漆黄素对泡沫细胞内脂质累积的影响
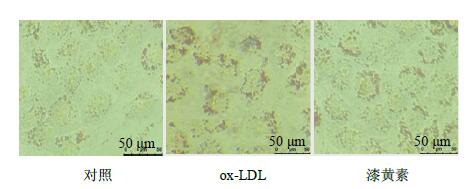
油红O染色后检测漆黄素对泡沫细胞内脂质累积的影响,结果(图 1)显示:ox-LDL处理后细胞内存在大量的脂滴,且分布于细胞膜内表面,成环状结构,符合泡沫细胞的形态特征,而漆黄素组细胞内红色的油滴状颗粒明显减少。
|
图 1 漆黄素对泡沫细胞内脂质累积的影响 Fig.1 Effect of fisetin on lipid accumulation in foam cells |
2.6 双向电泳图谱
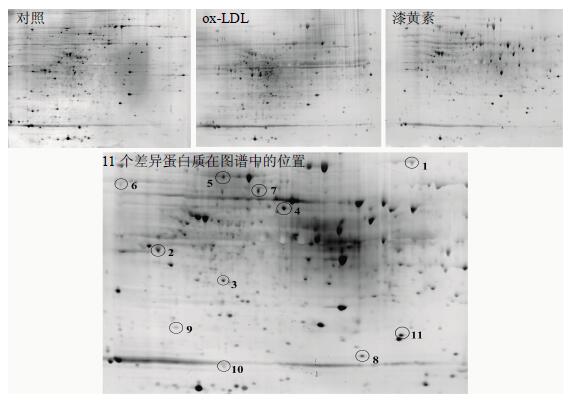
双向电泳法建立对照组、ox-LDL组、漆黄素组蛋白质组图谱(图 2),采用Image Master 6.0软件进行分析。每组胶平均检测到735个蛋白质点,其中共有的点631个,经差异蛋白质组分析,共筛选出11个差异蛋白质,其在图谱中的位置见图 2,蛋白质表达差异变化见表 5。
|
图 2 漆黄素对泡沫细胞蛋白质组的影响 Fig.2 Effect of fisetin on proteome of foam cells |
|
|
表 5 差异蛋白质的质谱鉴定结果 Table 5 MS identification of proteins |
2.7 质谱鉴定结果分析
对11个差异蛋白进行质谱鉴定,其鉴定相关信息见表 5,其结果表明,漆黄素处理后,泡沫细胞中Cyt b5、GST、NADH脱氢酶(泛醌)黄素蛋白2、Prelamin A/C、葡萄糖调节蛋白78、热休克蛋白 60、Supervillin、胆固醇酰基转移酶表达量增加,钙网蛋白、转录延伸因子B、蛋白核受体表达量下降。
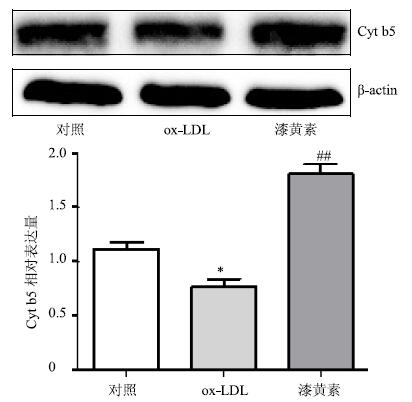
2.8 漆黄素对泡沫细胞内Cyt b5蛋白表达的影响如图 3所示,ox-LDL诱导后,泡沫细胞内Cyt b5蛋白表达下降,而漆黄素作用后Cyt b5蛋白表达明显升高。
|
与对照组比较:*P<0.05;与ox-LDL组比较:##P<0.01 *P < 0.05 vs control group; ##P < 0.01 vs ox-LDL group 图 3 漆黄素对泡沫细胞内Cyt b5表达的影响 (x±s±s,n = 3) Fig.3 Effect of fisetin on Cyt b5 expression in foam cells (x±s,n = 3) |
3 讨论
漆黄素是天然的强抗氧化剂,大量前期研究表明漆黄素具有抗炎、调血脂、抗肿瘤、调节免疫等作用,但漆黄素对于治疗动脉粥样硬化的作用和机制尚不清楚,为了明确漆黄素抗动脉粥样硬化的机制,进一步阐明下游信号通路。本实验以ox-LDL诱导RAW264.7巨噬细胞从而建立泡沫细胞模型,用漆黄素干预后,分析漆黄素对泡沫细胞蛋白质组的影响,结果共发现11个差异表达蛋白质,具体进行如下分析。
3.1 漆黄素可能通过调控氧化应激的蛋白,调节巨噬细胞源泡沫细胞内的氧化还原状态Cyt b5是一种常见的电子转移(氧化还原)蛋白质,Cyt b5还原酶/ Cyt b5信号通路是甾醇合成所必需的电子转移途径之一,在胆固醇和脂类代谢过程中发挥了重要的作用[6]。Cyt b5基因敲除的小鼠会出现高铁血红蛋白症、药物代谢改变、类固醇体内失衡和皮肤缺陷[7]。
GST是谷胱甘肽(GSH)结合反应的关键酶,具有广泛的生物学功能,包括清除机体内活性氧(ROS)和S-硫醇化蛋白的再生。在动脉粥样硬化中,GST起着抗氧化应激和血管保护作用[8]。Li等[9]研究发现GSTP1具有很强的抗氧化能力,能保护细胞免受氧化物的损害,其表达量下降会增加氧化物对细胞DNA的损伤并加剧炎症反应,影响细胞增殖、凋亡和运动。研究表明,在α-生育酚缺陷的肝微粒体自由基还原酶系统中,漆黄素可以恢复GSH抗脂质过氧化发挥抗氧化作用[10]。
NDUFV2包含一个铁硫簇([2Fe-2S] 双核集群N1a),是人类线粒体复合物I内部核编码的亚单位之一。Liu等[11]认为损害NDUFV2的线粒体定位是早发性肥厚型心肌病和脑病的机械基础。有研究认为NDUFV2的N1a集群可以作为抗氧化剂起作用接受过多的电子,以防止ROS的产生[12]。
Prelamin A/C是核纤层蛋白A和C的前体,这是重要的核包膜蛋白。核膜在核功能中发挥关键作用,例如调节细胞分裂、转录和翻译。正常情况下,Prelamin A/C位于细胞核并能在核膜处形成适当的核包膜,而高氧可以抑制Prelamin在核膜处形成包膜[13],最近的证据指出,a类核纤层蛋白参与调解细胞氧化还原体内平衡,lamin A/C缺乏可以提高ROS的水平,导致线粒体功能紊乱[14]。
本实验结果发现,漆黄素可以上调Cyt b5、GST、NDUFV2及Prelamin A/C蛋白质的表达,有助于泡沫细胞内ROS的清除,降低脂质过氧化,以维持细胞内的稳态。
3.2 漆黄素对内质网应激具有调节作用当ox-LDL作用于巨噬细胞时,内质网(ER)处于应激状态,内质网应激反应的标志性蛋白78 kDa的葡萄糖调节蛋白(GRP78)立即参与反应。GRP78是ER驻留分子伴侣。在ER,它可以指导蛋白质折叠和装配,有助于ER钙稳态,并激活哺乳动物未折叠蛋白反应。此外,它能保护细胞免于凋亡。内质网应激与各种心血管疾病有关,GRP78在动脉粥样硬化中的作用也逐渐受到关注。GRP78先前认定为是A类清道夫受体(SR-A)的新的结合蛋白质,结合SR-A抑制乙酰化LDL的内化和减少巨噬细胞内脂肪积累,同时可以抑制SR-A介导的配体内化到巨噬细胞从而抑制巨噬细胞的黏附[15]。实验结果显示漆黄素组GRP78表达量增加,提示漆黄素可能通过GRP78与SR-A结合,从而影响泡沫细胞对LDL的吸收,减少脂质积累,降低其黏附作用,延缓动脉粥样硬化的进程。
钙网蛋白(CRT)作为主要的钙结合分子伴侣,集中分布在内质网腔,在ER中调节蛋白质折叠和维持Ca2+内稳态,是唯一一个能从内质网转移出来而不被降解的哺乳动物蛋白。而非ER CRT位于胞质、细胞膜、细胞外基质,参与调节多种细胞反应,如黏附、迁移、凋亡、吞噬作用和直接免疫调节活动,在转录调控过程中发挥重要作用[16]。研究发现,内质网应激时,在肾脏内皮细胞中过表达的CRT可抑制内质网Ca2+释放,减轻胞浆Ca2+超载,增强细胞对H2O2诱导损伤的抵抗力[17]。而Xu等[18]发现不同程度的缺氧可诱导不同水平CRT的表达升高,轻度增加的CRT可能发挥代偿作用,通过增加ER Ca2+结合能力,从而调动内源性保护机制,增强对氧化损伤的抵抗力,同时明确过表达的CRT可以通过上调核转录因子并激活ER凋亡信号,促进心肌细胞凋亡和LDH的增加。而本实验ox-LDL诱导CRT过表达,可能是因为细胞内Ca2+调节失衡,激活了内质网的凋亡信号途径,进一步诱导细胞损伤。漆黄素可能通过下调CRT的表达,维持Ca2+内稳态,减轻泡沫细胞在动脉粥样硬化进展中的作用。
3.3 漆黄素可能调节蛋白核受体(NR)和卵磷脂胆固醇酰基转移酶(LCAT)降低泡沫细胞中CE的量NR调节配体激活转录因子的网络,通过在信号分子与转录应答间建立联系,不仅消除胆汁淤积并解毒,还有几个保护区的激活也能调节纤维化、炎症、癌变[19]。NR在脂质调控中扮演着重要的角色,参与调节胆固醇、载脂蛋白、脂肪酸等物质的代谢过程,调控胆固醇逆向转运,在动脉粥样硬化和脂代谢异常疾病中发挥重要作用。LXR、FXR、PPAR、RXR为4大类参与脂代谢的核受体,部分受体已经成为降脂药的作用靶点。本实验泡沫细胞组中NR表达显著增加,NR及相关靶基因表达紊乱,提示ox-LDL可能激活了LXRα进而诱导SREBP-1c表达,促进生脂靶基因的表达[20],核受体可能为漆黄素调脂的一个作用位点,而具体机制需要进一步研究。
LCAT是唯一一个能够在血浆中酯化胆固醇的酶,并负责大多数酯化胆固醇的循环,能促进高密度脂蛋白的成熟。因为它保持外周细胞和细胞外受体之间的未酯化胆固醇的梯度,LCAT一直被视为胆固醇逆转运的关键酶,然而,不同动物模型中进行的大量研究得出了相互矛盾的结果,LCAT在动脉粥样硬化中的作用仍然存在争议[21]。Seohyun等[22]发现用降脂药物治疗喂饲高脂饲料的小鼠后,LCAT的基因表达量显著增加,HDL的水平显著升高,LDL和TC的量均明显下降,血液中脂质的水平降低。本实验中ox-LDL组的LCAT表达量下降,而漆黄素作用后,泡沫细胞中表达量升高,说明漆黄素可能通过上调LCAT加速胆固醇的清除、维持脂代谢稳态,从而减缓动脉粥样硬化的发生发展。
3.4 漆黄素具有免疫调节功能[23]热休克蛋白(HSPs)家庭是一类进化保守的蛋白质,作为分子伴侣,确保蛋白质进行适当的折叠或重叠,避免蛋白质聚合。除了参与细胞应激,HSPs还扮演了一个重要的管理角色,调控细胞信号、蛋白质降解和易位。最新研究表明HSPs已成为抗动脉粥样硬化的新靶点,而在应激状态下(如感染、内膜损伤等),细胞自身释放HSP60,作为一种自身抗原被免疫系统识别,诱发机体的保护性免疫应答,与内皮细胞功能损伤、血管平滑肌细胞增生密切相关[24]。在ox-LDL应激状态下,HSP60表达下降,可能提示细胞自身免疫能力下降,无法作为一种自身抗原被免疫系统识别,细胞处于易感状态,而漆黄素组HSP60的表达量与泡沫细胞组相比上升,提示漆黄素可能通过增加HSP60表达从而诱发机体的保护性免疫应答,进而起到抗炎、调节免疫的作用。
除此之外,漆黄素还可以通过Supervillin和P-TEFb来调控细胞转录,影响细胞的炎症和周期。Supervillin是紧密结合的膜蛋白,为细胞骨架、膜和信号蛋白的调节中心。Supervillin的生化特性在基于膜的信号和运动功能的协调中发挥作用,通过结合肌球蛋白II和EPLIN调控癌变和细胞迁移、基质的侵袭、细胞骨架和转录。Supervillin强化负调节焦点黏附功能这一过程。过表达的Supervillin可以减少细胞黏附纤连蛋白,而核糖核酸干扰(RNAi)介导的SV下调增加细胞的黏附作用[25]。本课题组推测漆黄素可能上调Supervillin来调节泡沫细胞的骨架和黏附,从而起到抗炎作用并减弱动脉粥样硬化斑块的稳定性。
转录延伸因子B(TEFb)是由CDK9和cyclin T1组成的复合物,正性调节真核生物RNA-polyII所介导的转录延伸。近年来发现TEFb与HIV-1感染、心肌肥大、糖尿病等疾病密切相关。Moiola等[26]研究发现TEFb能调节淋巴细胞的激活和分化,在恶性肿瘤中发现过表达的cyclin T1破坏细胞周期,促进增殖,加速肿瘤的进展。CDK9可能成为下调动脉粥样硬化炎症的新目标,Han等[27]推测抑制CDK9可以降低单核细胞的转录,从而影响分化及炎性因子的释放,阻止单核细胞浸润及内皮的激活。TEFb能和某些特定基因的启动子结合并促进这些基因的表达如NF-κB、c-myc、c-fos和过氧化物酶体增殖激活受体γ等,影响细胞的增殖、凋亡、炎症和脂代谢。本实验泡沫细胞中TEFb的表达升高,推测巨噬细胞受损后过表达的cyclin T1和CDK9参与破坏细胞周期、促进炎症,而漆黄素降低了TEFb的表达,恢复转录延伸功能,提高泡沫细胞的抗氧化、抗炎、调脂能力。
综上所述,漆黄素抗动脉粥样硬化的机制十分复杂,涉及增强细胞抗氧化、抗炎能力、减弱细胞应激反应、降低细胞内胆固醇堆积及提高免疫能力等因素共同作用的结果。另外,本实验结果还显示漆黄素可能通过调节细胞的转录及凋亡起到抗肿瘤的作用。
| [1] | 沈驰斌, 卢德赵, 沃兴德, 等. RAW 264. 7细胞泡沫化前后差异蛋白质组分析[J]. 中国动脉硬化杂志, 2009, 17(3):197–201. |
| [2] | Touil Y S, Fellous A, Scherman D, et al. Flavonoid-induced mor-phological modifications of endothelial cells through microtubule stabilization[J]. Nutr Cancer, 2009, 61(3): 310–321. DOI:10.1080/01635580802521346 |
| [3] | Wang L, Tu Y C, Lian T W, et al. Distinctive antioxidant and anti-inflammatory effects of flavonols[J]. J Agric Food Chem, 2006, 54(26): 9798–9804. DOI:10.1021/jf0620719 |
| [4] | Lian T W, Wang L, Lo Y H, et al. Fisetin, morin and myricetin attenuate CD36 expression and ox LDL uptake in U937-derived macrophages[J]. Biochim Biophys Acta, 2008, 1781(19): 601–609. |
| [5] | Fan J, Shimokama T, Tokunaga O, et al. Activation and cholesterol accumulation of macrophages induced by hypercholesterolemia. A study using a rat peritoneal macrophage model for extravascular in vivo generation of foam cells[J]. Pathobiology, 1994, 62(1): 1–7. DOI:10.1159/000163871 |
| [6] | Porter T D. Electron transfer pathways in cholesterol synthesis[J]. Lipids, 2015, 50(10): 927–936. DOI:10.1007/s11745-015-4065-1 |
| [7] | Finn R D, McLaughlin L A, Hughes C, et al. Cytochrome b5 null mouse:a new model for studying inherited skin disorders and the role of unsaturated fatty acids in normal homeostasis[J]. Transgenic Res, 2010, 20(3): 491–502. |
| [8] | Zivkovic M, Stankovic A, Djuric T, et al. Effects of glutathione S-transferase T1 and M1 deletions on advanced carotid atherosclerosis, oxidative, lipid and inflammatory parameters[J]. Mol Biol Rep, 2014, 41(2): 1157–1164. DOI:10.1007/s11033-013-2962-z |
| [9] | Li T, Zhao X P, Wang L Y, et al. Glutathione s-transferase p1 correlated with oxidative stress in hepatocellular carcinoma[J]. Int J Med Sci, 2013, 10(6): 683–690. DOI:10.7150/ijms.5947 |
| [10] | van Acker F A, Schouten O, Haenen G R, et al. Flavonoids can replace α-tocopherol as an antioxidant[J]. FEBS Lett, 2000, 473(2): 145–148. DOI:10.1016/S0014-5793(00)01517-9 |
| [11] | Liu H Y, Liao P C, Chuang K T, et al. Mitochondrial targeting of human NADH dehydrogenase (ubiquinone) flavoprotein 2(NDUFV2) and its association with early-onset hypertrophic cardiomyopathy and encephalopathy[J]. J Biomed Sci, 2011, 18(1): 29. DOI:10.1186/1423-0127-18-29 |
| [12] | Sazanov L A, Hinchliffe P. Structure of the hydrophilic domain of respiratory complex I from Thermus thermophilus[J]. Science, 2006, 311(5766): 1430–1436. DOI:10.1126/science.1123809 |
| [13] | Kim A, Davis R, Higuchi M. Intracellular oxygen determined by respiration regulates localization of Ras and prenylated proteins[J]. Cell Death Disease, 2015, 6: e1825. DOI:10.1038/cddis.2015.64 |
| [14] | Sieprath T, Corne T D, Nooteboom M, et al. Sustained accumulation of prelamin A and depletion of lamin A/C both cause oxidative stress and mitochondrial dysfunction but induce different cell fates[J]. Nucleus, 2015, 6(3): 236–246. DOI:10.1080/19491034.2015.1050568 |
| [15] | Bai H, Li N, Zhou X D, et al. GRP78 inhibits macrophage adhesion via SR-A[J]. J Biomed Res, 2014, 28(4): 269–274. DOI:10.7555/JBR.28.20130054 |
| [16] | Gold L I, Eggleton P, Sweetwyne M T, et al. Calreticulin:Non-endoplasmic reticulum functions in physiology and disease[J]. FASEB J, 2010, 24(3): 665–683. DOI:10.1096/fj.09-145482 |
| [17] | Hung C C, Ichimura T, Stevens J L, et al. Protection of renal epithelial cells against oxidative injury by endoplasmic reticulum stress preconditioning is mediated by ERK1/2 activation[J]. J Biol Chem, 2003, 278(31): 29317–29326. DOI:10.1074/jbc.M302368200 |
| [18] | Xu F F, Liu X H. Calreticulin translocation aggravates endoplasmic reticulum stress-associated apoptosis during cardiomyocyte hypoxia/reoxygenation[J]. Chin Med J, 2015, 128(3): 353–360. DOI:10.4103/0366-6999.150103 |
| [19] | Halilbasic E, Baghdasaryan A, Trauner M. Nuclear receptors as drug targets in cholestatic liver diseases[J]. Clin Liver Dis, 2013, 17(2): 161–189. DOI:10.1016/j.cld.2012.12.001 |
| [20] | Qin Y, Dalen K T, Gustafsson J A, et al. Regulation of hepatic fatty acid elongase 5 by LXRα-SREBP-1c[J]. Biochim Biophys Acta, 2009, 1791(2): 140–147. DOI:10.1016/j.bbalip.2008.12.003 |
| [21] | Ossoli A, Simonelli S, Vitali C, et al. Role of LCAT in atherosclerosis[J]. J Atheroscler Thromb, 2016, 23(2): 119–127. DOI:10.5551/jat.32854 |
| [22] | Lee S Y, Joo H J, Kim C T, et al. High hydrostatic pressure extract of garlic increases the HDL cholesterol level via up-regulation of apolipoprotein A-I gene expression in rats fed a high-fat diet[J]. Lipids Health Disease, 2012, 11: 77. DOI:10.1186/1476-511X-11-77 |
| [23] | 陈真, 曾耀英, 叶燕霞. 漆黄素对巨噬细胞和T淋巴细胞的免疫调节作用[J]. 免疫学杂志, 2010, 26(8):653–656. |
| [24] | Deniset J F, Pierce G N. Heat shock proteins:Mediators of atherosclerotic development[J]. Current Drug Targets, 2015, 16(8): 816–826. DOI:10.2174/1389450116666150416115423 |
| [25] | Takizawa N, Smith T C, Nebl T, et al. Supervillin modulation of focal adhesions involving TRIP6/ZRP-1[J]. J Cell Biol, 2006, 174(3): 447–458. DOI:10.1083/jcb.200512051 |
| [26] | Moiola C, De Luca P, Gardner K, et al. Cyclin T1 overexpression induces malignant transformation and tumor growth[J]. Cell Cycle, 2010, 9(15): 3119–3126. |
| [27] | Han Y, Zhan Y, Hou G, et al. Cyclin-dependent kinase 9 may as a novel target in downregulating the atherosclerosis inflammation[J]. Biomed Rep, 2014, 2(6): 775–779. |
 2017, Vol. 48
2017, Vol. 48


