2. 重庆医科大学 干细胞与组织工程研究室, 重庆 400016;
3. 重庆医药高等专科学校 生理学教研室, 重庆 401331
2. Laboratory of Stem Cell and Tissue Engineering, Chongqing Medical University, Chongqing 400016, China;
3. Department of Physiology, Chongqing Medical and Pharmaceutical College, Chongqing 401331, China
人参Panax ginseng C. A. Mey. 作为中国传统医学中的“补气”良药已运用千年之久[1]。人参皂苷Rh2(Rh2)是人参天然活性成分之一,是1种从红参中分离得到的原人参二醇型单糖链皂苷单体化合物,其毒性低、相对分子质量小、脂溶性好,具有很强的抗肿瘤活性[2]。近年来对其在抗肿瘤作用方面的研究表明,Rh2的抗肿瘤作用较为广泛,既可阻滞细胞周期、诱导肿瘤细胞凋亡和抑制肿瘤的生长、诱导肿瘤细胞分化使其逆转、抑制肿瘤的转移,又可通过影响和调节机体免疫功能,增强机体对疾病的抵抗能力,从而抑制肿瘤生长,还可增强抗癌药的药效[3]。
在真核生物中,自噬是一种高度保守的生物学过程,能维持细胞的代谢平衡[4-5]。目前认为,细胞死亡包括3种类型,即坏死、凋亡和自噬性细胞死亡。细胞程序性死亡中,自噬可能比凋亡扮演更为主动和重要的角色[6]。自噬对肿瘤细胞起到双刃剑作用,可以保护肿瘤细胞,也可以杀伤肿瘤细胞[7]。因此,本实验研究Rh2对人白血病细胞KG1α增殖的影响,并从自噬凋亡角度来探讨其作用机制,为Rh2应用于临床治疗白血病奠定实验和理论基础。
1 材料 1.1 细胞株人白血病KG1α细胞株购自上海ATCC细胞库。每次取对数生长期的KG1α细胞以5×108/L接种于含10%胎牛血清的RPMI 1640培养基中,在37 ℃、5% CO2饱和湿度下培养,每2~3 d传代或换液。
1.2 药品Rh2购自成都曼斯特科技有限公司(批号78214-33-2,质量分数98%),取200 μL DMSO加入20 mg Rh2使之充分溶解,配制成100 mg/L原液,−20 ℃冷冻保存。实验前用含10%胎牛血清的RPMI 1640完全培养液稀释成所需浓度。
1.3 试剂胎牛血清、RPMI 1640培养基(美国Hyclone公司);CCK-8试剂盒(日本同仁化学研究所);Annexin V-PI双标凋亡检测试剂盒(南京凯基生物公司);TAKARA反转录酶试剂盒、SYBR II试剂(Takara公司);吖啶橙、MDC染液、3-甲基腺嘌呤(3-MA)自噬抑制剂(美国Sigma公司);MAPK通路抗体试剂盒、Beclin-1、LC3A/B多克隆抗体、Bcl-2、Bax多克隆抗体(美国Epitomics公司)。Caspase-3、Atg3、Atg5、Atg7、Atg12抗体(美国Cell Signaling Technology公司)。
1.4 仪器超净工作台(Sanyo公司);倒置显微镜、倒置荧光显微镜(Olympus公司);低温离心机(Sigma公司);酶标仪、垂直电泳仪、电转仪、ChemiDocXRS化学发光成像系统、PCR仪(Bio-Rad公司);二氧化碳培养箱(Thermo公司)。
2 方法 2.1 CCK-8 法测定细胞增殖培养对数生长期的KG1α细胞,以1×104/孔接种于96孔板中,每孔加入的细胞液体积10 μL。分为空白对照组、Rh2药物组和本底对照组,每组设6个复孔,每孔加入200 μL药物,空白对照组加入细胞及等量培养液,Rh2药物组加入相应浓度(20、40、60、80、100 μmol/L)的Rh2;本底对照组只加RPMI 1640培养液。各组培养24、48、72 h后,每孔加入10 μL CCK-8检测液,轻轻摇匀,孵育2.5 h后,用酶标仪(波长450 nm)检测每孔吸光度(A)值,并计算细胞增殖抑制率和半数抑制浓度(IC50)。
增殖抑制率=1-(A空白对照-A本底对照)/(A药物组-A本底对照)
2.2 流式细胞仪检测细胞早期凋亡培养对数生长期的KG1α细胞,调整细胞浓度为5×108/L,接种于6孔细胞培养板中,每孔加入200 μL。实验分为空白对照组、Rh2(60 μmol/L)组。每孔3 mL培养液,在37 ℃,5% CO2饱和湿度下培养24 h后,分别收集各组细胞,用预冷0.01 mol/L PBS(pH 7.2)洗涤2次,4 ℃、1 200×g,离心5 min。加入RNA酶、碘化丙啶(PI)和膜联蛋白V(Annexin V),置于冰上染色处理30 min,每组细胞2×104个,上流式细胞仪检测,重复实验3次。
2.3 Hoechst 染色取对数生长期的KG1α细胞,调整细胞密度为5×108/L,接种于6孔培养板,每孔加入200 μL。实验分为空白对照组(含0.1% DMSO的RPMI 1640完全培养液)、药物组(加入60 μmol/L的Rh2 6 mL),培养48 h后,收集空白对照组和药物组细胞,用预冷PBS洗涤2次,加甲醇-乙醇(3∶1)固定液室温固定15 min;离心去除固定液加Hoechst染色液避光、室温染色30 min,PBS洗涤1次,调整细胞浓度,滴片,荧光显微镜下观察。
2.4 吖啶橙染色KG1α细胞用Rh2(60 μmol/L,3 mL)处理24 h后,收集细胞,选新配制的吖啶橙(2 μmol/mL),37 ℃避光孵育15 min,在EP管中,用PBS漂洗3次后,调整细胞浓度,取1滴细胞悬液滴到玻片上,待细胞沉积到玻片上时,吸去上层液体,封片置于荧光显微镜下观察酸性的自噬小泡。50%甘油封片,置于倒置荧光显微镜下观察、采图,实验重复3次。
2.5 Western blotting 法检测凋亡及自噬相关蛋白表达取对数生长期的KG1α细胞,调整细胞浓度到5×108/L,接种到细胞培养瓶中。实验分组为对照组和药物组(分别加入Rh2 10、20、40、60 μmol/L),置培养箱中常规培养。提取蛋白并将各组蛋白质量浓度调成4 μg/μL,使蛋白完全变性后,冷却,每个样品取10 μL加入泳道中,保证每孔中有40 μg待测蛋白样品,SDS-PAGE电泳后电转移至PVDF膜。5%脱脂奶粉室温封闭2 h后,分别加入MAPK信号通路抗体(1∶500)、Bcl-2(1∶1 000)、Bax(1∶1 000)、Caspase-3(激活型,1∶1 000)、LC3A(1∶1 000)和LC3B(1∶1 000)、Beclin-1(1∶2 000)、β-actin(1∶2 000),4 ℃孵育过夜;置于脱色摇床上,用TBST漂洗3次,每次10 min。分别加入以1∶2 000稀释的辣根过氧化物酶标记二抗,再用TBST漂洗3次,每次10 min;最后在保鲜膜上滴入ECL化学发光液,在暗室进行X胶片曝光,洗片。胶片晾干后扫描胶片,用Quantity One软件定量分析。重复3次。
2.6 RT-PCR 法检测自噬重要基因表达参照试剂盒说明书进行,Trizol提取细胞总RNA。采用TAKARA反转录酶试剂盒逆转录cDNA。应用TAKARA的SYBR II试剂检测自噬重要基因的mRNA水平,PCR反应体系为10 μL。引物由上海生工生物公司提供,引物序列见表 1。以GAPDH为内参基因,用目的基因与GAPDH的起始拷贝数比值表示目的基因的相对表达量,实验重复3次。
|
|
表 1 实时荧光定量 PCR 相关基因引物序列 Table 1 Related gene sequence primers of RT-PCR reaction |
2.7 3-MA 和 Rh2 联用对细胞增殖和凋亡的影响
实验分为4组,空白对照组、Rh2(60 μmol/L)组、3-MA(5 mmol/L)组及Rh2(60 μmol/L)+3-MA(5 mmol/L)组,分别以CCK-8法、流式细胞仪、Western blotting法检测细胞增殖、凋亡及蛋白表达。
2.8 统计学方法所有数据用SPSS 22.0软件进行统计分析,数据均用x±s表示,多组均数间比较用双因素和单因素方差分析,组间两两比较用LSD法。
3 结果 3.1 Rh2 对 KG1α 细胞增殖的抑制作用CCK-8检测结果(图 1)显示,药物组与空白对照组比较,Rh2能有效抑制白血病KG1α细胞增殖,并呈浓度和时间依赖性。且Rh2作用KG1α细胞48 h的IC50为60 μmol/L。因此,选择Rh2 60 μmol/L作为后续实验最高浓度。
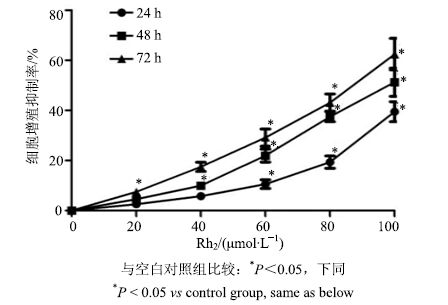
|
图 1 Rh2对 KG1α细胞增殖的抑制作用 (x±s ±s ,n = 6) Fig.1 Inhibitory effect of Rh2 on KG1α cells (x±s,n = 6) |
3.2 Rh2 对 KG1α 细胞凋亡的影响
Rh2(60 μmol/L)处理KG1α细胞24 h后,流式细胞仪检测结果显示加药组早期和晚期凋亡细胞数量明显增多,其早期凋亡率为(12.00±2.60)%,与空白对照组[(3.18±0.52)%]相比,差异有统计学意义(P<0.05);晚期凋亡率为(16.32±3.45)%,与空白对照组[(3.19±0.73)%]相比,差异均有统计学意义(P<0.05),见图 2。
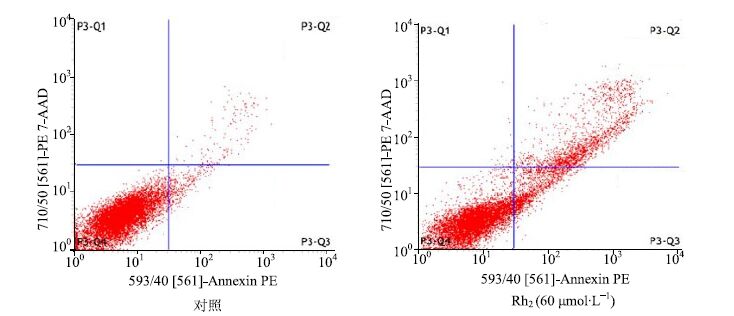
|
图 2 Rh2对 KG1α细胞凋亡的影响 Fig.2 Effect of Rh2 on cell apoptosis of KG1α cells |
3.3 Rh2 对 KG1α 细胞核形态的影响
Rh2(60 μmol/L)诱导KG1α细胞48 h后,用 Hoechst染色显示,细胞核出现染色质浓缩、核碎裂、核边集的细胞凋亡现象,并且细胞发出的蓝色荧光较空白对照组细胞强,说明Rh2能诱导KG1α细胞凋亡(图 3)。
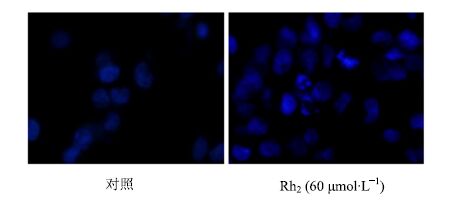
|
图 3 Hoechst 染色检测细胞凋亡 Fig.3 Apoptosis of KG1α cells detected by Hoechst staining |
3.4 吖啶橙染色观察细胞自噬
Rh2(60 μmol/L)处理KG1α细胞24 h后,用吖啶橙染色,观察细胞内的自噬体(图 4),细胞内绿色代表酸性自噬小泡,红色代表核仁,经Rh2诱导后KG1α细胞中的酸性自噬小泡均明显增加,对照组绿色的自噬小泡基本看不见。
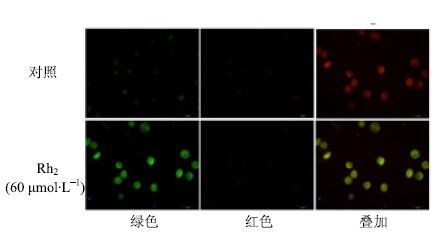
|
图 4 吖啶橙染色检测细胞自噬 Fig.4 Cell autophagy detected by acridine orange staining |
3.5 Rh2 对 KG1α细胞凋亡相关蛋白表达的影响
Western blotting检测结果显示,KG1α细胞经不同浓度的Rh2(20、40、60 μmol/L)作用48 h后,与对照组比较,药物组中Bcl-2蛋白随Rh2浓度升高表达水平反而降低;Bax、Caspase-3(激活型)蛋白随Rh2浓度升高表达水平明显升高(图 5)。

|
图 5 Rh2 对 KG1α 细胞 Bcl-2 、 Bax 、 Caspase-3 蛋白表达的影响 Fig.5 Effect of Rh2on expression of Bcl-2,Bax,Caspase-3 in KG1α cells |
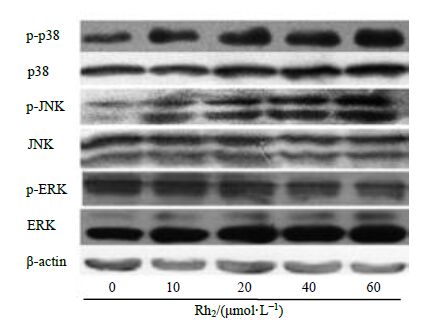
3.6 Rh2 调控 MAPK 、AKT 、ERK 信号通路
10、20、40、60 μmol/L Rh2作用于KG1α细胞24 h后,Western blotting结果显示,p38、JNK和ERK蛋白的表达几乎没变化,p-p38和p-JNK的表达增加,p-ERK的表达下降,提示Rh2能影响MAPK、AKT、ERK信号通路,见图 6。
|
图 6 Rh2 影响 KG1α 细胞中 MAPK 信号通路 Fig.6 Effect of MAPK signaling way in KG1α cells induced by Rh2 |
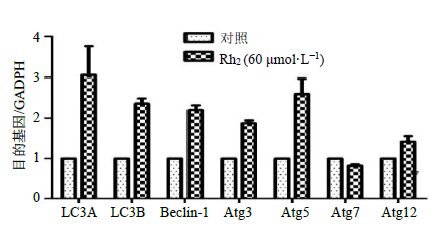
3.7 Rh2 对 KG1α细胞自噬重要基因表达的影响
RT-PCR检测结果如图 7所示,与对照组比较,KG1α细胞经60 μmol/L的Rh2作用24 h后,自噬相关基因(Atg3、Atg5、Atg7、Atg12)在2组细胞中变化不明显,而自噬重要调控基因Beclin-1、LC3A、LC3B的表达却明显上调,差异有统计学意义(P<0.05)。
|
图 7 Rh2 对自噬重要基因表达的影响 (x±s ±s ,n = 3) Fig.7 Expression of autophagy important gene (x±s,n = 3) |
3.8 Rh2 对 KG1α 细胞自噬重要蛋白表达的影响
Western blotting检测结果显示,与对照组比较,KG1α细胞经不同浓度的Rh2作用后,Beclin-1、LC3A、LC3B蛋白的表达水平明显增高(图 8)。实验结果说明,Rh2能在分子水平上增加自噬重要的蛋白和基因的表达,进一步确定了Rh2能诱导白血病KG1α细胞发生自噬。

|
图 8 Rh2 对 KG1α 细胞自噬相关蛋白表达的影响 Fig.8 Effect of Rh2 on expression of protein related to autophagy in KG1α cells |
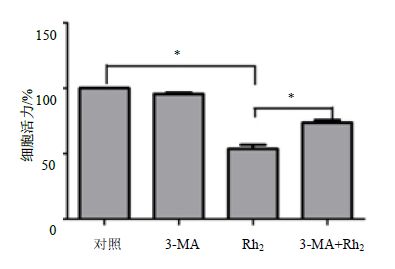
3.9 3-MA 和 Rh2 联用对细胞增殖和凋亡的影响 3.9.1 3-MA和Rh2联用对细胞增殖的影响
CCK-8检测细胞的增殖能力,发现单独用自噬抑制剂3-MA能轻微降低细胞活力,但是无统计学意义(P>0.05);单独使用Rh2能明显降低细胞活力,差异有统计学意义(P<0.05);然而在联合加入3-MA和Rh2后,与单独加入Rh2组比较,细胞活力有明显的回升,差异有统计学意义(P<0.05),说明细胞自噬能增强Rh2对白血病KG1α的增殖抑制(图 9)。
|
图 9 Rh2 通过自噬抑制细胞增殖作用 (x±s ±s ,n = 3) Fig.9 Inhibition of Rh2 on cell proliferation by autophagy (x±s,n = 3) |
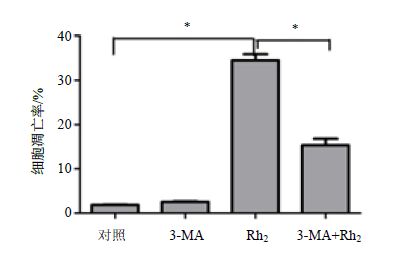
3.9.2 3-MA和Rh2联用对细胞凋亡的影响
用流式细胞术检测细胞凋亡发现,细胞加入自噬抑制剂3-MA时,与对照组比较无明显改变(图 10);单独使用Rh2时,细胞凋亡明显增加,差异有统计学意(P<0.05);然而在联合加入3-MA和Rh2后,与单独加入Rh2组比较,细胞凋亡有明显下降,差异有统计学意义(P<0.05),说明细胞自噬能增强Rh2对白血病KG1α细胞的促凋亡作用。
|
图 10 Rh2 通过自噬诱导细胞凋亡作用 (x±s ±s ,n = 3) Fig.10 Induction of apoptosis by Rh2 through autophagy (x±s,n = 3) |
3.9.3 3-MA和Rh2联用对细胞凋亡作用相关蛋白的影响
Western blotting结果如图 11所示,单独运用自噬抑制剂3-MA后,细胞自噬关键蛋白LC3A/B表达有下降的趋势,单独运用Rh2后,细胞自噬关键蛋白LC3A/B和激活型的Caspase-3表达明显上升,当同时加入自噬抑制剂3-MA和Rh2后,细胞的自噬关键蛋白LC3A/B和激活型Caspase-3的表达比单独运用Rh2时明显下降,说明抑制自噬后细胞凋亡现象减少,自噬可促进人参皂苷Rh2诱导KG1α的凋亡作用。
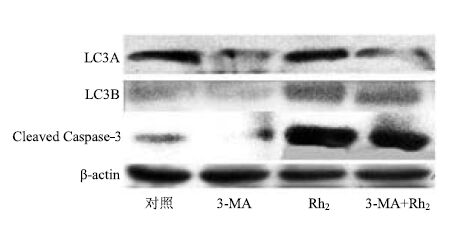
|
图 11 Western blotting 检测 Rh2 通过自噬诱导凋亡 Fig.11 Induction of apoptosis by Rh2 through autophagy detected by Western blotting |
4 讨论
自然界中有丰富的抗肿瘤天然药物,本课题组前期实验表明人参提取物中人参总皂苷和单体能在体外抑制白血病和肝癌细胞增殖、阻滞周期、促进凋亡。国内外研究证实,人参皂苷单体能抑制各种肿瘤细胞的增殖,促进肿瘤细胞发生凋亡[8-9]。Rh2含有单糖,研究发现,化学结构中含有的糖结构越少时,抗肿瘤的活性越强[10]。因此本实验采用CCK-8法研究Rh2对白血病细胞KG1α增殖抑制作用,发现Rh2能有效抑制白血病细胞的增长。通过FCM检测和Hoechst染色发现Rh2能促进细胞发生凋亡。Western blotting检测发现Rh2能够增加Bax/Bcl-2的比例,同时激活Caspase-3,说明了Rh2能通过线粒体途径诱导细胞发生凋亡。
细胞自噬和凋亡密切相关,凋亡的早期,细胞出现应激反应,会出现自噬。为了探讨Rh2对白血病细胞自噬的影响,运用吖啶橙和Hoechst染色,发现加药组早期细胞出现酸性的自噬小泡。PCR和Western blotting结果显示自噬相关基因和蛋白分子(Beclin-1、LC3A和LC3B)的表达均升高,证明了Rh2能诱导白血病细胞发生自噬。
自噬异常与肿瘤的发生发展关系密切,可以从不同生物学行为影响肿瘤的进程,其中有细胞周期、增殖、凋亡、耐药、血管生成及肿瘤的治疗等方面的调控[11]。自噬和细胞凋亡的关系存在两面性,维持细胞生存和促进细胞死亡[12]。本课题组前期实验证明了Rh2既能诱导白血病KG1α细胞凋亡又能诱导其发生自噬,那么细胞自噬和凋亡关系是怎样的呢?实验表明,当同时加入自噬抑制剂3-MA和Rh2时,与单独加入Rh2相比,KG1α的细胞凋亡减少和细胞活力增强。说明抑制细胞自噬,可削弱Rh2对白血病细胞增殖抑制和诱导凋亡的作用,提示Rh2可以通过诱导白血病细胞发生自噬而促进细胞凋亡。
目前,MAPK、AKT和ERK信号通路能调控自噬和细胞凋亡[13-14]。前期研究证实Rh2诱导细胞自噬,3-MA通过抑制Class III PI3K的活性抑制自噬,抑制细胞自噬可以削弱Rh2对KG1α的抑制增殖和促凋亡作用。为了研究Rh2诱导细胞自噬凋亡的可能机制,本实验运用Western blotting检测MAPK、AKT和ERK信号通路的关键蛋白,发现Rh2能够激活p38、JNK、ERK,使其磷酸化,证明了Rh2诱导细胞自噬凋亡可能是通过激活MAPK、AKT和ERK信号通路实现。
| [1] | 徐哲, 赵余庆, 贾力. 人参的词源学、生药学、产品及市场的现代评价[J]. 现代药物与临床, 2011, 26(2):96–101. |
| [2] | Singh P, Singh H, Ahn S, et al. Pharmacological importance, characterization and applications of gold and silver nanoparticles synthesized by Panax ginseng fresh leaves[J]. Artif Cell Blood Sub, 2016, 11(18): 1–10. |
| [3] | 高瑞兰, 金锦梅, 牛泱平, 等. 人参总皂甙增加白血病细胞对化疗药物的敏感性[J]. 中国中西医结合杂志, 1999, 19(1):17–19. |
| [4] | Shintani T, Klionsky D J. Autophagy in health and disease:a double-edged sword[J]. Science, 2004, 306(5698): 990–995. DOI:10.1126/science.1099993 |
| [5] | Klionsky D J. Autophagy[J]. Current Biol, 2005, 15(8): 282–293. |
| [6] | Galluzzi L, Kroemer G. Necroptosis:a specialized pathway of programmed necrosis[J]. Cell, 2008, 135(7): 1161–1173. DOI:10.1016/j.cell.2008.12.004 |
| [7] | Meredith A M, Dass C R. Increasing role of the cancer chemotherapeutic doxorubicin in cellular metabolism[J]. J Pharm Pharmacol, 2016, 35(10): 111–115. |
| [8] | Xia T, Wang J C, Xu W, et al. 20S-Ginsenoside Rh2 induces apoptosis in human Leukaemia Reh cells through mitochondrial signaling pathways[J]. Biol Pharm Bull, 2014, 37(2): 248–254. DOI:10.1248/bpb.b13-00667 |
| [9] | Xu H, Zhao X, Liu X, et al. Antitumor effects of traditional Chinese medicine targeting the cellular apoptotic pathway[J]. Drug Des Dev Ther, 2015, 9(2): 735–744. |
| [10] | Wang W, Wang H, Rayburn E R, et al. 20(S)-25-methoxyl-dammarane-3beta, 12beta, 20-triol, a novel natural product for prostate cancer therapy:activity in vitro and in vivo and mechanisms of action[J]. Brit J cancer, 2008, 98(4): 792–802. DOI:10.1038/sj.bjc.6604227 |
| [11] | Ma Q, Chang Z, Wang W, et al. Rapamycin-mediated mTOR inhibition reverses drug resistance to adriamycin in colon cancer cells[J]. Hepato-Gastroenterol, 2015, 62(140): 880–886. |
| [12] | El-Khattouti A, Selimovic D, Haikel Y, et al. Crosstalk between apoptosis and autophagy:molecular mechanisms and therapeutic strategies in cancer[J]. J Cell Death, 2013, 18(6): 637–655. |
| [13] | Lisiak N, Toton E, Rubis B, et al. The synthetic oleanane triterpenoid HIMOXOL induces autophagy in breast cancer cells via ERK1/2 MAPK pathway and Beclin-1 up-regulation[J]. Anticancer Agents Med Chem, 2016, 16(8): 1066–1076. DOI:10.2174/1871520616666160223114104 |
| [14] | Hsieha M J, Chend M K, Chen C J, et al. Glabridin induces apoptosis and autophagy through JNK1/2 pathway in human hepatoma cells[J]. Phytomedicine, 2016, 23(4): 359–366. DOI:10.1016/j.phymed.2016.01.005 |
 2017, Vol. 48
2017, Vol. 48


