2. 沈阳药科大学中药学院, 辽宁 沈阳 110016
2. School of Traditional Chinese Materia Medica, Shenyang Pharmaceutical University, Shenyang 110016, China
参麦地黄丸(SDP)是由熟地黄、山药、山茱萸(蒸)、泽泻、北沙参、麦冬、茯苓和牡丹皮8味中药组成的复方制剂,具有润肺养阴之功效,用于治疗咽干舌燥、肾肺两虚、气喘咳嗽、潮热咳血等[1-3]。SDP的现行标准收载于卫生部药品标准《中药成方制剂》第二册,仅有常规制剂检查项。为进一步完善SDP的质量标准,本研究根据中成药的质量标准相关要求,新增了牡丹皮、北沙参、山茱萸和泽泻的TLC法[4]鉴别,增加了补骨脂素、异补骨脂素和丹皮酚的HPLC同时定量测定的分析方法。
1 仪器与试药LC-20AT高效液相输液泵、SPD-20A紫外检测、AT-330柱温箱、LC solution色谱工作站,日本岛津公司;JF-1004电子天平,余姚市金诺天平仪器有限公司;KQ5200B超声波清洗器,昆山市超声仪器有限公司;TG333A分析天平,湘仪天平仪器厂。
对照品补骨脂素(批号20150628,质量分数98%)、异补骨脂素(批号20150825,质量分数98%)和丹皮酚(批号20151219,质量分数98%),均由宝鸡市辰光生物科技有限公司提供;泽泻对照药材(批号121081-201406),由中国食品药品检定研究院提供。硅胶G薄层板,批号20130601,规格100 mm×200 mm,烟台江友硅胶开发有限公司;硅胶G薄层板,批号20141012,规格100 mm×200 mm,青岛海洋化工厂分厂;SDP制剂购自太极集团浙江东方制药有限公司,批号140917、140705、140924、140730、1601001;SDP组方各味药材均购自北京同仁堂有限公司,由沈阳药科大学中药学院路金才教授鉴定,熟地黄Rehmanniae Radix Praeparata为玄参科地黄属植物地黄Rehmannia glutinosa Libosch. 的炮制加工品;牡丹皮Moutan Cortex为毛茛科芍药属植物牡丹Paeonia suffruticosa Andr. 的干燥根皮;山茱萸(蒸)Corni Fructus (steam) 为山茱萸科山茱萸属植物山茱萸Cornus officinalis Sieb. et Zucc. 的干燥成熟果肉蒸制品;泽泻Alismatis Rhizoma为泽泻科泽泻属植物泽泻Alisma orientale (Sam.) Juzep. 的干燥块茎;北沙参Glehniae Radix为伞形科沙参属植物珊瑚菜Glehnia littoralis Fr. Schmidt ex Miq. 的干燥根;麦冬Ophiopogonis Radix为百合科沿阶草属植物麦冬Ophiopogon japonicus (Linn. f.) Ker-Gawl. 的干燥块根;茯苓Poria为多孔菌科茯苓属真菌茯苓Poria cocos (Schw.) Wolf的干燥菌核;山药Dioscoreae Rhizoma为薯蓣科薯蓣属植物薯蓣Dioscorea opposita Thunb. 的干燥根茎。四氢呋喃、甲醇、乙腈均为色谱纯,德国默克公司;水为纯化水,杭州娃哈哈集团有限公司;其他试剂均为分析纯。
2 方法与结果 2.1 TLC 鉴别 2.1.1 牡丹皮的TLC鉴别分别取3个批号的SDP适量,研细,取本品粉末6 g,加乙醚40 mL,回流提取1 h,滤过,滤液挥干,残渣加丙酮1 mL使溶解,作为供试品溶液。另取丹皮酚对照品适量,加丙酮制成含丹皮酚1 mg/mL的溶液,作为对照品溶液。按处方取除牡丹皮之外的其他7味药材,照SDP制备工艺,按供试品溶液制备方法制备牡丹皮阴性对照溶液[5-6]。照《中国药典》2015年版四部通则0502 TLC法[4]实验,吸取上述5种溶液各10 μL,分别点于同一硅胶G薄层板上,以环己烷-醋酸乙酯(3∶1)为展开剂,展开,取出,晾干,喷以盐酸酸化的5%三氯化铁乙醇溶液,在105 ℃加热至斑点显色清晰,见图 1。供试品色谱中,在与对照品色谱图相应的位置上(Rf=0.59),显相同颜色的斑点,牡丹皮阴性对照溶液无干扰。
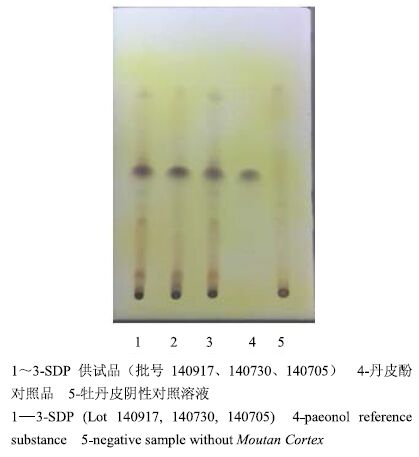
|
图 1 SDP 中牡丹皮的 TLC 图 Fig.1 TLC of Moutan Cortex in SDP |
2.1.2 山茱萸的TLC鉴别
分别取3个批号的SDP适量,研细,取本品粉末6 g,加无水乙醇40 mL,超声处理30 min,滤过,滤液浓缩至1 mL,作为供试品溶液。另取马钱苷对照品,加无水乙醇制成含马钱苷1 mg/mL的溶液,作为对照品溶液,按处方取除山茱萸(蒸)之外的其他7味药材,照SDP制备工艺,按供试品溶液制备方法制备山茱萸阴性对照溶液[7]。照TLC法[4]实验,吸取上述5种溶液各10 μL,分别点于同一硅胶G薄层板上,以醋酸乙酯-乙醇-冰醋酸(50∶10∶1)为展开剂,展开,取出,晾干,喷以10%的硫酸乙醇溶液,在105 ℃加热至斑点显色清晰,见图 2。结果表明,供试品色谱中,在与对照品色谱图相应的位置上(Rf=0.44),显相同的紫红色斑点,山茱萸阴性对照溶液无干扰。
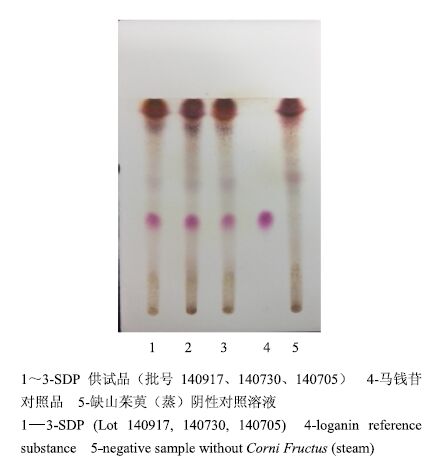
|
图 2 SDP 中山茱萸 (蒸) 的 TLC 色谱图 Fig.2 TLC of Corni Fructus (steam) in SDP |
2.1.3 北沙参的TLC鉴别
分别取3个批号的SDP适量,研细,取本品粉末9 g,加醋酸乙酯40 mL,超声处理30 min,滤过,滤液浓缩至1 mL,作为供试品溶液。另取补骨脂素对照品,加醋酸乙酯制成含补骨脂素1 mg/mL的溶液,作为对照品溶液,按处方取除北沙参之外的7味药材,照SDP制备工艺,按供试品溶液制备方法制备北沙参阴性对照溶液[8-9]。照TLC法[4]实验,吸取上述溶液各10 μL,分别点于同一硅胶G薄层板上,以环己烷-醋酸乙酯(4∶1)为展开剂,展开,取出,晾干,喷以10%氢氧化钾甲醇溶液,置紫外光灯(365 nm)下检视,见图 3。结果表明,供试品色谱中,在与对照品色谱图相应的位置上(Rf=0.35),显相同颜色的荧光斑点,北沙参的阴性对照溶液无干扰。
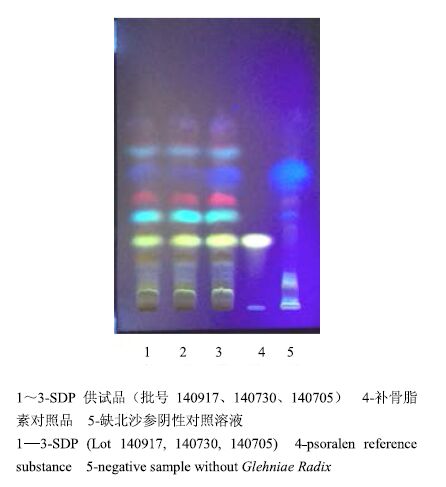
|
图 3 SDP 中北沙参的 TLC色谱图 (365 nm ) Fig.3 TLC of Glehniae Radix in SDP (365 nm) |
2.1.4 泽泻的TLC鉴别
分别取3个批号的SDP适量,研细,取本品粉末9 g,加醋酸乙酯40 mL,回流处理30 min,滤过,滤液浓缩至1 mL,作为供试品溶液。另取泽泻对照药材1 g,加醋酸乙酯20 mL,同法制成泽泻对照药材溶液。按处方取除泽泻以外的其他7味药材,照SDP制备工艺,按供试品溶液制备方法制备泽泻阴性对照溶液[10]。照TLC法[4]实验,吸取上述溶液各10 μL,分别点于同一硅胶G薄层板上,以氯仿-醋酸乙酯-甲酸(6∶3.5∶0.5)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105 ℃加热至斑点显色清晰,见图 4。结果表明,供试品色谱中,在与对照药材色谱图相应的位置上(Rf=0.62),显相同颜色的斑点,泽泻阴性对照溶液无干扰。
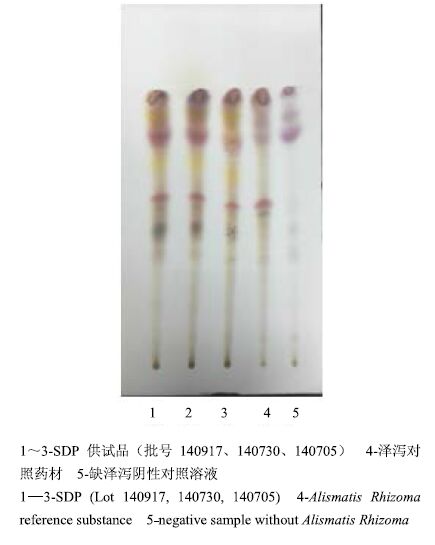
|
图 4 SDP中泽泻的 TLC色谱图 Fig.4 TLC of Alismatis Rhizoma in SDP |
2.2 定量测定 2.2.1 色谱条件和系统适用性试验
采用色谱柱Diamonsil C18(250 mm×4.6 mm,5 μm);流动相为0.1%甲酸水溶液-乙腈,梯度洗脱程序为0~36 min,30%乙腈;36~44 min,30%~90%乙腈;44~55 min,90%乙腈;检测波长254 nm;体积流量1.0 mL/min;柱温30 ℃;进样量为20 μL。
在上述色谱条件下分析,理论板数按补骨脂素、异补骨脂素[11]、丹皮酚[12]计算均不低于5 000,与相邻组分峰的分离度均大于1.5,色谱峰对称因子均在0.95~1.05。
2.2.2 对照品溶液的制备分别取补骨脂素、异补骨脂素、丹皮酚对照品适量,精密称定,置50 mL量瓶中,用体积分数为75%甲醇溶解并稀释至刻度,摇匀,配制成质量浓度分别为65.31、61.15、204.0 μg/mL的混合对照品储备液,4 ℃保存,备用。
2.2.3 供试品溶液制备取SDP适量,研细,取粉末约1.0 g,精密称定,置于具塞锥形瓶中,精密加入体积分数为75%的甲醇溶液10 mL,密塞,称定质量,超声处理(功率250 W,频率33 kHz)30 min,放冷,用体积分数为75%的甲醇补足减失的质量,摇匀,用0.45 μm微孔滤膜滤过,取续滤液作为供试品溶液[13]。
2.2.4 阴性供试品溶液按“2.2.3”项下方法,分别按制剂处方配比,制备缺北沙参或缺牡丹皮的阴性供试品溶液。
2.2.5 方法专属性考察精密吸取上述混合对照品、供试品以及阴性供试品溶液适量,按“2.2.1”项下的色谱条件分别进样20 μL,记录色谱图,见图 5。结果表明,供试品色谱峰与对照品色谱峰的保留时间一致,且补骨脂素、异补骨脂素和丹皮酚在各自对应的位置无干扰,表明该方法专属性良好。
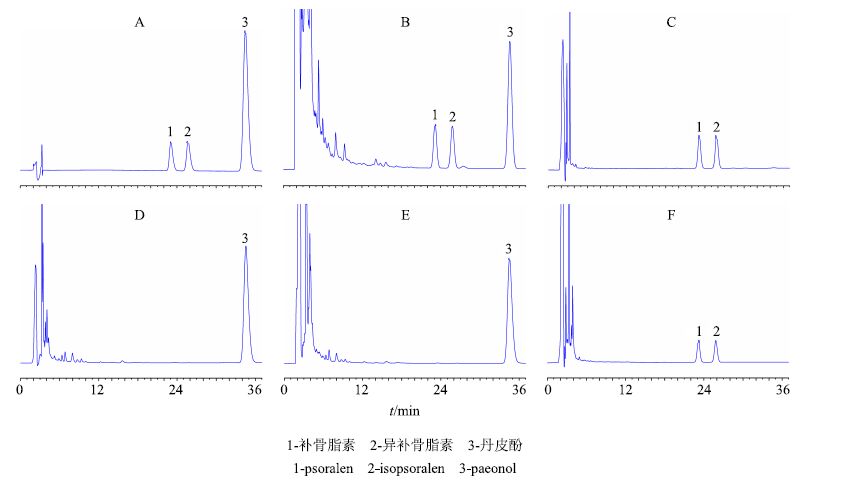
|
图 5 混合对照品 (A) 、SDP供试品 (B) 、北沙参药材 (C) 、牡丹皮药材 (D) 、缺北沙参阴性对照 (E) 、缺牡丹皮阴性对照 (F) 的典型 HPLC图 Fig.5 TypicalHPLCof mixed reference substances (A),SDP sample (B),Glehniae Radix (C),Moutan Cortex (D),negative sample without Glehniae Radix (E),and negative sample without Moutan Cortex (F) |
2.2.6 定量限和检测限
分别配制质量浓度由高到低的一系列混合对照品溶液,按“2.2.1”项下色谱条件进样分析,按信噪比(S/N)为10∶1确定待测成分的定量限;按信噪比(S/N)为3∶1,确定待测成分的检测限。3种待测成分补骨脂素、异补骨脂素、丹皮酚的定量限分别为652.7、611.5、522.9 μg/L,检测限分别为145.0、135.9、103.5 μg/L。
2.2.7 线性关系考察分别精密量取混合对照品储备液1.0、3.0、5.0、7.0、9.0 mL,置10 mL量瓶中,加75%甲醇稀释至刻度,摇匀,得系列混合对照品溶液。按照“2.2.1”项下的色谱条件分别进样20 μL,记录色谱图。分别以对照品溶液质量浓度为横坐标(X),以峰面积为纵坐标(Y),进行线性回归,得补骨脂素、异补骨脂素和丹皮酚峰的回归方程、相关系数(r)和线性范围,结果分别为补骨脂素Y=1.523×104 X-1.209×104,r=0.999 9,线性范围6.531~58.780 μg/mL;异补骨脂素Y=1.809×104 X-1.523×104,r=0.999 9,线性范围6.115~55.040 μg/mL;丹皮酚Y=2.760×104 X-1.683×104,r=0.9 99 9,线性范围20.40~183.60 μg/mL。
2.2.8 精密度试验取混合对照品溶液,按“2.2.1”项下色谱条件重复进样6次,计算补骨脂素、异补骨脂素和丹皮酚峰面积的RSD分别为0.81%、0.87%、0.95%,结果表明仪器精密度良好。
2.2.9 稳定性试验取同一供试品(批号140705)溶液,室温下放置,分别于0、3、6、12、24 h按“2.2.1”项下色谱条件进样分析,计算补骨脂素、异补骨脂素和丹皮酚峰面积的RSD分别为1.3%、0.76%、1.0%。结果表明供试品溶液室温下放置24 h稳定。
2.2.10 重复性试验取SDP样品(批号140730)粉末约1.0 g,精密称定,按“2.2.3”项下方法平行制备供试品溶液6份,并按“2.2.1”项下色谱条件进样分析,计算补骨脂素、异补骨脂素和丹皮酚质量分数的平均值分别为326.7、331.2、933.3 μg/g,RSD值分别为0.40%、1.1%、2.2%,结果表明方法的重复性良好。
2.2.11 加样回收率试验称取已测定的SDP(批号140730)粉末约0.5 g(补骨脂素、异补骨脂素、丹皮酚质量分数分别为328.8、336.4、934.8 μg/g),共6份,精密称定,分别加入一定质量浓度的混合对照品溶液0.5 mL(相当于SDP中原有质量的100%),按“2.2.3”项下方法制备供试品溶液,并按“2.2.1”项下条件进行分析,记录色谱图,计算回收率,结果补骨脂素、异补骨脂素、丹皮酚的平均回收率分别为100.4%、101.5%、101.5%,RSD分别为1.1%、1.3%、0.79%。结果表明,补骨脂素、异补骨脂素和丹皮酚回收率良好。
2.2.12 样品定量测定取5批SDP样品(批号140917、140705、140924、140730、1601001),分别按“2.2.3”项下平行制备3份供试品溶液,并按“2.2.1”项下色谱条件进行分析,计算补骨脂素、异补骨脂素和丹皮酚的质量分数,结果见表 1。
|
|
表 1 样品中 3种成分的定量测定结果 ( x± s ,n = 3 ) Table 1 Quantitative determination of three analysts in samples (x±s,n = 3) |
3 讨论 3.1 TLC 鉴别
本研究对SDP中牡丹皮、山茱萸(蒸)、泽泻、北沙参4味药材的TLC鉴别条件进行了考察和优化。对牡丹皮提取工艺考察时,比较了超声提取和加热回流提取2种方式,实验结果显示加热回流提取法制得的供试品斑点与超声提取法制得的供试品斑点相比更清晰。其原因可能是加热回流法对丹皮酚的提取更完全,并且提取溶剂乙醚具有易挥发的物理特性,超声提取过程中会使溶液温度升高,造成提取溶剂损失而影响提取效果。对山茱萸的展开系统考察结果显示,采用醋酸乙酯-乙醇系统展开时供试品和对照品在TLC相应位置均呈现相同的紫红色斑点,但供试品斑点严重拖尾,故在展开剂中加入冰醋酸改善斑点形状,取得了较为理想的展开效果,最终确定以醋酸乙酯-乙醇-冰醋酸(50∶10∶1)作为展开剂。
参照《中国药典》2015年版[14],在薄层鉴别中,牡丹皮测定的是丹皮酚,山茱萸测定的是马钱苷,北沙参测定的是补骨脂素,上述3味药材有明确的测定成分,因此直接选用对应的对照品溶液,未选用对照药材。而泽泻中并没用明确的哪种成分测定,因此对照溶液选用泽泻对照药材配制。
3.2 定量测定 3.2.1 色谱条件的选择由于参麦地黄丸为中药复方制剂,所含化学成分比较复杂,在对流动相系统(水-甲醇系统和水-乙腈系统)进行考察时发现,选用水-乙腈系统得到的峰分离度更好、基线更稳定;在比较添加剂的种类(甲酸、乙酸、磷酸)和用量时发现,选用0.1%甲酸水得到的峰对称性更好;同时比较不同柱温(30、35、40 ℃)、体积流量(0.8、1.0、1.2 mL/min)和梯度条件[15-16],最终建立的色谱条件如“2.2.1”项中所述。
3.2.2 提取方式的考察在对供试品提取方式的考察中,本研究分别比较了超声及加热回流2种提取方式。结果显示,加热提取时,3种成分测得量均减少,补骨脂素和异补骨脂素减少可能是由于两异构体中均含有内酯环加热不稳定,丹皮酚可能与其加热易挥发等因素有关,因此选用超声提取方法;在比较了不同体积分数(25%、50%、75%、100%)的甲醇溶液时发现,3种成分提取值随着甲醇浓度的增加而增加,但是当甲醇浓度达到75%后,提取效率得不到更大改善,因此选用75%甲醇溶液作为提取溶液;在考察不同提取时间(15、30、45、60 min)对3种成分提取率的影响时发现,在超声提取达到30 min后,各成分的提取不能得到更大改善。综上所述,最终选用的提取方法如“2.2.3”项中所述。
3.2.3 指标成分的选取参麦地黄丸是在六味地黄丸的基础上增加了北沙参和麦冬2味药材。丹皮酚为《中国药典》2015年版一部中六味地黄丸定量测定的主要成分;补骨脂素和异补骨脂素为北沙参中的主要活性成分;经多次实验发现麦冬中的成分在HPLC中响应较小。因此,本课题选取上述3种成分作为参麦地黄丸质量控制的指标成分。
| [1] | 卫生部颁药品标准(中药成方制剂第二册)[S]. 1990. |
| [2] | 陈卫明. 参麦地黄丸联合西药治疗慢性肾小球肾炎临床观察[J]. 新中医, 2015, 47(9):87–88. |
| [3] | 王谦信, 陈兆俊, 严宇仙, 等. 参麦地黄丸联合抗结核药物治疗肺结核合并糖尿病46例[J]. 中国中医药科技, 2016, 23(2):220–221. |
| [4] | 中国药典[S]. 四部. 2015. |
| [5] | 钱智磊, 须明玉, 朱华旭, 等. 复方黄栀颗粒的质量标准研究[J]. 中药新药与临床药理, 2010, 21(3):287–291. |
| [6] | 李春雪, 张晨, 王长生, 等. 菊黄口服液质量控制方法研究[J]. 中草药, 2015, 46(12):1779–1784. |
| [7] | 刘亚华, 武一曼. 知柏地黄丸质量标准研究[J]. 时珍国医国药, 2009, 20(11):2686. |
| [8] | 李宝国, 石俊英. HPLC法同时测定北沙参不同部位中3种香豆素的含量[J]. 山东中医药大学学报, 2006, 29(5):383–384. |
| [9] | 徐以亮. 补骨脂配方颗粒质量标准研究[J]. 中国药业, 2008, 17(9):20–21. |
| [10] | 叶小强. 中国药典地黄丸系列品种泽泻的薄层鉴别[J]. 中国药品标准, 2003, 4(2):62–63. |
| [11] | 杨晓旭, 高家荣, 韩燕全, 等. 正交试验结合指纹图谱优选补骨脂-肉豆蔻药对醇提工艺[J]. 中草药, 2014, 45(15):2178–2183. |
| [12] | 陈雪梅, 周慧. 变波长RP-HPLC法同时测定调经丸中12种成分[J]. 中草药, 2016, 47(8):1332–1336. |
| [13] | 贾瑞艳, 刘影. HPLC法测定六味地黄丸(浓缩丸)中丹皮酚的含量[J]. 黑龙江医药, 2009, 22(2):120–122. |
| [14] | 中国药典[S]. 一部. 2015. |
| [15] | 李吉锋, 祝保林. 高效液相色谱法测定地黄丸类中成药中中丹皮酚含量[J]. 分析仪器, 2010(1):59–61. |
| [16] | 常增荣, 李姣. 六味地黄丸质量控制方法提高[J]. 中国药学杂志, 2015, 50(16):1441–1445. |
 2017, Vol. 48
2017, Vol. 48


