2. Jealott's Hill International Research Centre, Syngenta, Berkshire, RG426EY, UK
2. Jealott's Hill International Research Centre, Syngenta, Berkshire, RG426 EY, UK
结构测定是对天然产物研究时必须完成的困难工作之一。构型(configuration)指分子的立体构型,即分子在三维空间的结构或分子中的原子、基团在三维空间的相对位置或排列方式。有机化合物的数量巨大、结构类型繁多,原因就在于其结构上的加合性(同系性)和异构性,而立体异构即构型的不同又是其中最主要的原因之一[1]。
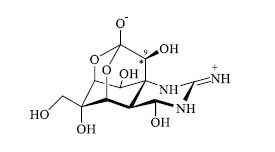
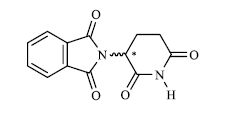
无论在有机合成、药物开发、天然产物研究还是涉及与生命有关的化学问题,如天然产物立体构型与生物活性的关系、生化反应过程的分子立体构型与立体选择性之间的关系、药物分子立体构型与受体之间相互关系等,都必须在三维空间明确分子的结构和性能[2]。例如,从河豚鱼肝脏中分离出来的河豚毒素[3](tertodotoxin,TTX,图 1),其毒性与分子中C*-9的构型有关,C*-9为S-构型的天然产物分子毒性极强,而人工合成的C*-9为R-构型的分子则毒性很小;又如曾引发惨剧的反应停(thalidomide,沙利度胺,图 2),化学名称为N-(2,6-二氧-3-哌啶基)-邻苯二甲酰亚胺沙利度胺,是一个人工合成化学分子,在20世纪50~60年代作为抗妊娠反应药物在欧洲、南美洲和日本等地广泛销售,但是上市后不久即发现很多孕妇服用后生产出畸形胎儿,后经研究发现其R-构型分子有镇静作用,而S-构型分子则对胚胎有很强的致畸作用。
|
图 1 河豚毒素的化学结构 Fig.1 Chemical structure of tertodotoxin |
|
图 2 反应停的化学结构 Fig.2 Chemical structure of thalidomide |
正确地确定一个有机化合物的立体构型,是有机化学工作者尤其是药物研究工作者不可或缺的工作。关于复杂天然产物绝对构型的测定已经有文献总结报道[4-7]。天然产物构型的测定方法主要有化学相关法(chemical method)、旋光度法(optical rotation)、紫外光谱法(UV)、红外光谱法(IR)、核磁共振波谱法(NMR)、旋光色散光谱法(optical rotatory dispersion,ORD)、圆二色散光谱法(circular dichroism,CD)、X-射线衍射法(X-ray)等,其中只有CD法、ORD法和X-ray法是手性方法。Mosher法(Mosher’s method)就是在利用核磁共振波谱技术来确定复杂天然产物绝对构型时所发明的一种巧妙方法。本文通过介绍Mosher法及其测定天然产物绝对构型的实例,回顾老一辈科学家高超的化学结构鉴定技巧和严谨的思路。
1 Mosher法的提出及鉴定思路美国斯坦佛大学(Stanford University)教授Harry Stone Mosher(1915—2001,图 3)于1973年提出1H-NMR和19F-NMR测定手性仲醇(chiral secondary alcohols)绝对构型的应用方法[8]。

|
图 3 Harry Stone Mosher教授 Fig.3 Prof. Harry Stone Mosher |
Mosher教授最初的思路:由于NMR是非手性谱,所以对于一对对映异构体在绝大多数情况(非手性条件)下,其NMR谱信号是相同的,或者说应用1H-NMR谱无法直接区别其绝对构型。但是如果将一对手性分子转化成适当的非对映体衍生物,就很可能有不同的1H-NMR信号,或者说是否可能用于区别其绝对构型的不同?如果将一个手性分子与一对手性试剂反应转化成适当的衍生物,是否可以通过衍生物的1H-NMR来推测手性分子的构型(图 4)。

|
图 4 通过衍生物的1H-NMR来推测手性分子的构型 Fig.4 Estimate of chiral molecules configuration through 1H-NMR of derivatives |
在图 4中,(R)-M*、(S)-M*为一对手性分子,A*为一个手性分子,(R)-M*-A*、(S)-M*-A*为 (R)-M*、(S)-M*与A*分别反应生成的分子,但是为非对映异构体。X*为一个具有手性的未知构型的分子,(R)-M*-X*、(S)-M*-X*为 (R)-M*、(S)-M*与X*分别反应生成的分子,同样也为非对映异构体。如果已知一对手性分子(R)-M*、(S)-M*的构型,那么对于未知构型的手性分子X*来说,其衍生物 (R)-M*-X*、(S)-M*-X*就会有不同的1H-NMR信号,通过分析衍生物1H-NMR信号的不同,就能推测出X*的构型。
因为羟基(hydroxyl)是最活泼的基团之一,非常容易与其他分子进行加成或取代反应,所以Mosher教授选择了手性碳上连有羟基的仲醇进行研究。如果将一个未知构型的手性仲丁醇样品X*与另一对已知构型的手性分子(R*、S*)分别发生“加成”反应,如酯化反应,会得到2个产物分子(图 5),这2个产物分子是非对映异构体,它们应该具有不同的1H-NMR信号。

|
图 5 未知构型的手性仲丁醇样品 (X*) 与已知构型的手性分子 (R*、S*) 发生的加成反应 Fig.5 Addition reaction of chiral sec-butyl alcohol samples with unknown configuration (X*) and chiral molecules with known configuration (R*,S*) |
2 经典1H-NMR Mosher法解析
Mosher教授选择了一对手性试剂:α-甲氧基-α-三氟甲基-苯基乙酸,(α-methyloxyl-α- trifluoromethyl-phenyl-acetic acid,MTPA),亦称为Mosher酸(Mosher acids),其立体结构优势构象见图 6。将一个手性仲醇分别与手性试剂 (R)-M*TPA和 (S)-M*TPA反应,得到2个酯类衍生产物(MTPA derivatives),称为Mosher酯(Mosher esters),Mosher酯的立体结构优势构象见图 7。

|
图 6 (R)-M*TPA和 (S)-M*TPA的优势构象 Fig.6 Preferred conformations of (R)-M*TPA and (S)-M*TPA |

|
图 7 手性仲醇和其 (R)-M*TPA酯、(S)-M*TPA酯的优势构象 Fig.7 Preferred conformations of chiral secondary alcohol and its (R)-,(S)-M*TPA derivatives |
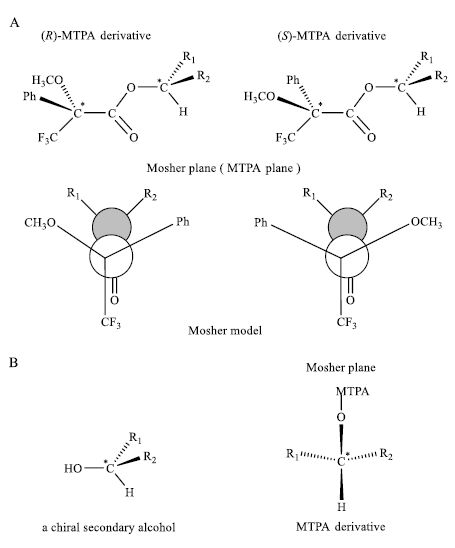
Mosher教授发现,在Mosher酯的优势构象中,醇基即“手性仲醇分子”上的α-H、手性碳原子、氧原子以及MTPA上的羰基、羰基上的碳原子、α-C、α-三氟甲基上的碳原子共处同一平面,Mosher教授将此平面称为MTPA平面(MTPA plane)或Mosher平面(Mosher plane),并设计了Mosher酯构型关系模式图(Mosher model,configurational correlation model,图 8-A)。
|
图 8 Mosher酯构型关系模式图 Fig.8 Mosher model or configurational correlation model |
从Mosher酯构型关系模式图可以看出,在 (R)- MTPA酯分子中,醇基中取代基R1处于酸基中的苯基(Ph)的面上,但是R1与Ph又相处于MTPA平面的异侧,R1受苯环的抗(逆)磁屏蔽效应(shielding effect)较小;而在 (S)-M*TPA酯分子中,R1处于Ph的面上,但是R1与Ph又处于MTPA平面的同侧,R1受苯环的抗磁屏蔽效应较大。因此,(R)-M*TPA酯与 (S)-M*TPA酯相对比,(R)-M*TPA酯中R1基团上的β-H处于较低场,而 (S)-M*TP A酯中R1基团上的β-H处于较高场。同理,对于醇基中取代基R2,(R)-M*TPA酯与 (S)-M*TPA酯相对比,(R)-M*TPA酯中R2基团上的β-H处于较高场,而 (S)-M*TPA酯中R2基团上的β-H处于较低场。再从1H-NMR谱中得出的数据分析。比较产物(R)-M*TPA酯、(S)-M*TPA酯中醇基上取代基R1上β-H的1H-NMR信号,其位移值差值Δδ=δS-δR<0;比较产物 (R)-M*TPA酯、(S)-M*TPA酯中仲醇基上取代基R2上β-H的1H-NMR信号,其位移值差值Δδ=δS-δR>0(图 9)。

|
图 9 (R)- 和 (S)-M*TPA酯在1H-NMR谱中的位移变化 Fig.9 Difference between (R)- and (S)-M*TPA esters in 1H-NMR chemical shift |
Mosher教授最终发现,将Δδ为负值的β-H所在基团(R1)放在Mosher模式图中MTPA平面的左侧,将Δδ为正值的β-H所在基团(R2)放在Mosher模式图中MTPA平面的右侧,最终可判断仲醇样品手性碳的绝对构型(图 8-B)。
测定及分析程序:(1)将一对手性试剂 (R)-M*TPA和 (S)-M*TPA分别与待测样品仲醇反应,制备成Mosher酯;(2)分别测定 (R)-M*osher酯和 (S)-M*osher酯的1H-NMR,并归属各质子信号;(3)计算仲醇基手性碳上取代基上β-H的Δδ=δS-δR值;(4)将Δδ值为负值的β-H所连取代基放在Mosher模式图中MTPA平面的左侧;(5)将Δδ值为正值的β-H所连取代基放在Mosher模式图中MTPA平面的右侧;(6)推定出样品仲醇的绝对构型。
通过应用Mosher法,确定了许多化合物的手性中心的绝对构型,如2-pentanol(图 10)[4]、(−)-mentho(图 11),以及从海藻中分离得到的1个化合物,也应用Mosher法,确定了手性中心的绝对构型(图 11)[9]。

|
图 10 2-pentanol手性中心的绝对构型的确定 Fig.10 Determination of absolute configuration of chiral center in 2-pentanol |

|
图 11 2-pentanol和海藻中衍生物手性中心的绝对构型的确定 Fig.11 Determination of absolute configuration of chiral center in 2-pentanoland algal MTPA derivatives |
3 改进的Mosher法
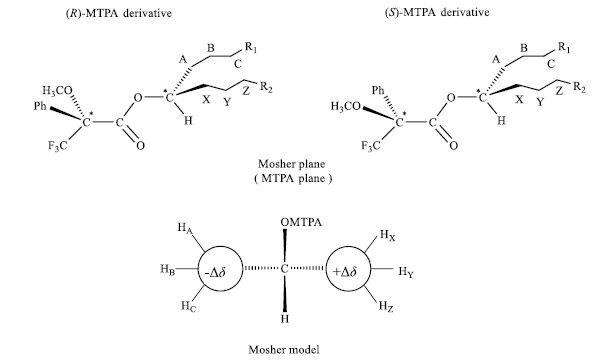
又有科学家通过研究发现[4],在MTPA酯中,苯环对手性仲醇取代基非β-位的远程质子同样存在抗磁屏蔽作用,而且对于与β-H处于同侧的、更远的质子具有相同的抗磁屏蔽作用,只是作用强度大小不同。如日本科学家楠见武德(Kusumi Takenori)研究发现[9],苯环的磁屏蔽作用不仅限于手性仲醇取代基β-H位质子,还可以向更远的质子延伸,如果将(R)-M*TPA酯、(S)-M*TPA酯中手性仲醇取代基上各质子的Δδ计算出来,发现正Δδ值和负Δδ值在Mosher模式图中2侧整齐排列。图 12为改进的1H-NMR Mosher模式图,从中可以看出,由于苯环的抗磁屏蔽作用,在 (R)-M*TPA酯中HA、HB、HC…的1H-NMR信号较 (S)-M*TPA酯中相应的信号出现在较低场,所以Δδ为负值;相反,HX、HY、HZ…的Δδ则为正值。因此,根据Mosher 模式图(图 12),将手性仲醇基上Δδ为负值的质子所在基团放在MTPA平面的左侧,将手性仲醇基上Δδ为正值的质子所在基团放在MTPA平面的右侧,即可判断出该手性仲醇的绝对构型。改进的1H-NMR Mosher法得到的结果比仅运用β-H的符号来判断手性碳的绝对构型的经典Mosher法所得结果更加可靠。
|
图 12 改进的Mosher酯构型关系模式图 Fig.12 Modified Mosher model or configurational correlation model |
例如,(−)-menthol MTPA酯1H-NMR的Δδ值(图 13-A*)[4]。Saccopetrin A是从番荔枝科植物囊瓣木中得到一个末端含饱和γ-内酯环的新型长链内酯类化合物,我国科学家首次运用化学转化与Mosher法相结合确定了其绝对构型(图 13-B)[6]。楠见武德从海洋生物海马中分离得到2个化合物A和C(图 13-C)[10-11],水解后得到化合物B和D,用1H-NMR Mosher法测定手性中心构型为S,并经单晶X-ray结果证实。
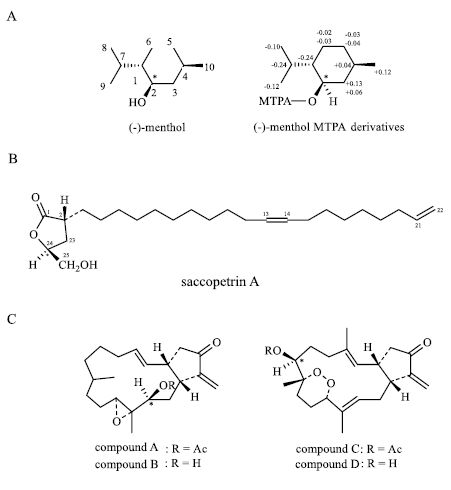
|
图 13 改进的Mosher酯构型关系模式相关实例 Fig.13 Examples of modified Mosher model |
4 经典19F-NMR Mosher法解析
在低场NMR条件下,对于较复杂的化合物准确归属质子的信号有时还是相当困难。因为19F-NMR图谱信号清楚简单,所以Mosher教授又提出了19F-NMR Mosher 法(19F-NMR Mosher’s method)。19F-NMR Mosher法的应用前提是手性仲醇样品中手性碳上所连基团即β-位取代基的立体空间大小要明显不同。MTPA酯的19F-NMR构型关系模式图(预设基团体积R1>R2)见图 14。

|
图 14 19F-NMR Mosher酯构型关系模式图 Fig.14 19F-NMR Mosher model or configurational correlation model |
从MTPA酯构型关系模式图(图 14)可以看出,在MTPA酯中,R1、R2与甲氧基、苯环之间存在的空间或电子云的相互作用,致使三氟甲基偏离MTPA平面,19F-NMR位移信号不同主要是由于MTPA酯中羰基对9F的各向异性(anisotropy)的去屏蔽作用(deshielding effect)不同引起的。若基团R1比基团R2的体积要大,在 (R)-M*TPA酯中,三氟甲基与羰基应更接近处于平面位置,因此19F受到羰基的顺磁屏蔽作用较强,其19F-NMR信号应处于较低场;在 (S)-M*TPA酯中,三氟甲基与羰基应较大偏离MTPA平面,因此19F受到羰基的顺磁屏蔽作用较弱,其19F-NMR信号应处于较高场。
Mosher教授认为,若 (R)-M*TPA酯在较低场、(S)-M*TPA酯在较高场,则较大基团在MTPA平面的左侧;若 (R)-M*TPA酯在较高场、(S)-M*TPA酯在较低场,则较大基团在MTPA平面的右侧。测定及分析程序:(1)待测手性仲醇样品分别与手性试剂 (R)-M*TPA、(S)-M*TPA反应,制备相应MTPA酯;(2)分别测定 (R)-M*TPA酯和 (S)-M*TPA酯的19F-NMR;(3)比较 (R)-M*TPA酯与 (S)-M*TPA酯的19F-NMR化学位移值大小;(4)结合模型图确定 出该手性仲醇样品的绝对构型。
5 结语在研究天然产物时应用NMR法测定有机化合物绝对构型的方法中,Mosher法是较常用的方法。在经典Mosher法中,MTPA分子中苯环的屏蔽作用相对较弱,其样品衍生酯的NMR信号有时因样品分子中基团的重叠而难以得到准确的判断,特别是在长链化合物或空间位阻较大时尤为明显,因此限制了应用。有时还因为MTPA与手性醇生成的MTPA酯可能存在不稳定性,从而容易引起质子信号的相互干扰。
科学家们不断研究并发展了Mosher法,一些新的手性试剂被开发应用到绝对构型的测定,后经日本科学家大谷郁子(Ohtani Ikuko)、楠见武德等逐渐完善为“改进的Mosher法”(modified Mosher’s method)[12]。例如,用新开发的手性试剂methoxyphenylacetic acid(MPA)、1,5-difluoro-2,4- dinitrobeneze(FFDNA)、9-anthranylmethoxyacetic acid(9ATMA)以及1- 或2-naphthylmethoxyacetic acid(NMA)、2-(2′-methoxy-1,1′-naphthyl)-3,5- dichlorobenzoic acid(MNCB)、2′-methoxy-1,1′- binaphthyl-2-carboxylic acid(MBNC)(图 15)等代替MTPA作为手性试剂,并且在实际工作中得到较广泛应用[9-13]。其中,9ATMA引起的高场位移值为MTPA的6~10倍,2NMA引起的高场位移值约为MTPA的3倍,9ATMA和2NMA产生的屏蔽效应要远远强于MTPA,尤其适用于长链化合物中手性仲醇绝对构型的测定。因为9ATMA、2NMA、1NMA酯中1H-NMR的Δδ值较大,所以实际上手性样品仲醇只需要与一对手性试剂中的一个反应,再通过与手性样品仲醇中1H-NMR化学位移比较,即可推测出手性样品仲醇的绝对构型,由此还可大大节省手性试剂用量以及减小待测样品的消耗量。还发现MNCB、MBNC的适用范围更广,且可应用于有空间位阻的仲醇。

|
图 15 新手性试剂的化学结构 Fig.15 Chemical structure of new chiral reagents |
无论用其中任何一对手性试剂进行测试,从原理上都是一致的,即采用手性试剂与待测手性样品仲醇生成衍生物,根据芳香环的屏蔽效应,再由1H-NMR谱中化学位移的差值和模型图来推测手性仲醇的绝对构型。Mosher法已经成为应用广泛的决定仲醇构型的经典方法,已报道其应用于番荔枝内酯、多氧取代环已烯、二萜、三萜、甾醇、二氢呋喃等化合物的研究。
在Mosher法基础上,研究者们还发现了各种新的扩展应用,如伯醇β-位手性中心绝对构型的测定、羧酸β-位手性中心绝对构型的测定、伯胺α-位手性中心绝对构型的测定、醛β-位手性中心绝对构型的测定等,为复杂有机化合物的结构鉴定提供了更多的途径。近年随着高场核磁共振技术的发展和新的手性试剂的不断发现和应用,特别是二维核磁技术的应用,NMR法在天然有机物绝对构型测定中越来越得到广泛应用,利用现代波谱技术进行结构鉴定也是科技的发展方向[14]。不过,将抽象的数据、谱图转化为具体的分子结构,除必须有扎实的化学基础外,还必须要有深厚的谱学知识、逻辑推理能力、抽象的思维以及丰富的想象力。
复杂有机化合物结构的鉴定,是科学家必须完成的最为复杂、艰难的工作之一。20世纪最伟大的科学家之一、天然产物研究大师、著名有机合成化学家、诺贝尔化学奖获得者Robert Burns Woodward(1917—1979)曾经指出:“只有化学意义上新的分子才是新药开发。”化学意义上的新分子无论是通过化学合成创造和在天然产物中发现,哪个来源的分子,都必须明确其立体构型。Mosher法的发明和应用,是Mosher教授为科学进步做出的一项具有推动作用的重要贡献,而科学史上每一个伟大的“第一次”也值得后人永远铭记。在此,再一次向前辈科学家表示崇高的敬意。
本文为笔者所编著《天然药物化学史话系列》文章之一。文章中引用各方文献,在此表示衷心感谢。
| [1] | 郭瑞霞, 李力更, 王于方, 等. 天然药物化学史话:天然产物化学研究的魅力[J]. 中草药, 2015, 46(14):2019–2033. |
| [2] | 史清文, 李力更, 霍长虹, 等. 天然药物化学学科的发展以及与相关学科的关系[J]. 中草药, 2011, 42(8):1457–1463. |
| [3] | 郭瑞霞, 李力更, 王磊, 等. 天然药物化学史话:河豚毒素[J]. 中草药, 2014, 45(9):1330–1335. |
| [4] | Seco J M, Quinoa E, Riguera R. The assignment of absolute configuration by NMR[J]. Chem Rev, 2004, 104(1): 17–118. DOI:10.1021/cr000665j |
| [5] | Kong L Y, Wang P. Determination of the absolute configuration of natural products[J]. Chin J Nat Med, 2013, 11(3): 193–198. |
| [6] | 王明雷, 杜江, 王嗣, 等. 核磁共振法在天然有机化合物绝对构型测定中的应用[J]. 有机化学, 2001, 21(5):341–349. |
| [7] | 滕荣伟, 沈平, 王德祖, 等. 应用核磁共振测定有机化合物绝对构型的方法[J]. 波谱学杂志, 2002, 19(2):107–127. |
| [8] | Dale J A, Mosher H S. Nuclear magnetic resonance enantiomer regents. Configurational correlations via nuclear magnetic resonance chemical shifts of diastereomeric mandelate, O-methylmandelate, and α-methoxy-α-trifluoromethylphenylacetate (MTPA) esters[J]. J Amer Chem Soc, 1973, 95(2): 512–519. DOI:10.1021/ja00783a034 |
| [9] | Kusumi T, Takahashi H, Xu P, et al. New chiral anisotropic reagents, NMR tools to elucidate the absolute configurations of long-chain organic compounds[J]. Tetrahedron Lett, 1994, 35(25): 4397–4400. DOI:10.1016/S0040-4039(00)73366-1 |
| [10] | Kusumi T, Ohtani I, Inouye Y, et al. Absolute configurations of cytotoxic marine cembranolides; Consideration of Mosher's method[J]. Tetrahedron Lett, 1988, 29(37): 4731–4734. DOI:10.1016/S0040-4039(00)80593-6 |
| [11] | Kusumi T. Determination of the absolute configuration of organic compounds by means of NMR spectroscopy-Modified Mosher's method[J]. J Synth Org Chem Jap, 1993, 51(6): 462–470. DOI:10.5059/yukigoseikyokaishi.51.462 |
| [12] | Ohtani I, Kusumi T, Kashman Y, et al. High-field FT NMR application of Mosher's method. The absolute configurations of marine terpenoids[J]. J Amer Chem Soc, 1991, 113(11): 4092–4096. DOI:10.1021/ja00011a006 |
| [13] | Zhou B N, Baj N J, Glass T E, et al. Bioactive labdane diterpenoids from Renealmia alpinia collected in the Suriname rainforest[J]. J Nat Prod, 1997, 60(12): 1287–1293. DOI:10.1021/np970233c |
| [14] | 王思明, 付炎, 刘丹, 等. 天然药物化学史话:"四大光谱"在天然产物结构鉴定中的应用[J]. 中草药, 2016, 47(16):2779–2796. |
 2017, Vol. 48
2017, Vol. 48


