2. 云南中医学院中药学院, 云南 昆明 650500;
3. 昆明医科大学药学院, 云南 昆明 650500
2. College of Chinese Materia Medica, Yunnan University of Traditional Chinese Medicine, Kunming 650500, China;
3. School of Pharmacy, Kunming Medical University, Kunming 650500, China
丫蕊花Ypsilandra thibetica Franch是百合科(Liliaceae)丫蕊花属Ypsilandra Franch多年生草本植物,别称一枝花、石凤丹、随身丹(四川峨眉)、峨眉石凤丹、小瓢儿菜等。丫蕊花一般以全草入药,味苦,微寒,具有清热解毒、利湿消肿和止血等功效,主治瘰疬、小便不利、水肿、崩漏、外伤出血等[1]。在民间,尤其是在彝族地区,丫蕊花早已成为止血习用药材[2]。
药用植物丫蕊花的研究起步较早,但发展较为缓慢。目前数据库中能查到的关于丫蕊花研究最早的文献是20世纪80年代,郑学经等[3]发表的“丫蕊花营养器官形态解剖及气孔复合体发育的初步观察”,这仅仅是对丫蕊花外部及组织形态学的观察研究。随后,郑学经等[3]研究了丫蕊花的胚胎发育、双受精以及胚和胚乳的发育等。20世纪90年代对丫蕊花的现代研究几乎是空白,只有一项关于丫蕊花抗癌活性的专利报道[4]。直到21世纪初,中国科学院昆明植物研究所的周俊院士课题组研究发现丫蕊花属植物具有显著的类似于重楼的止血活性,尤其是在治疗妇女出血方面,具有疗效显著、使用安全等特点[5],使丫蕊花属植物药用价值受到越来越广泛的关注。本文就丫蕊花属植物的研究现状进行综述,以期加快该属植物替代重楼的步伐,缓解重楼濒危现状。以期为该属植物进一步的研究开发提供参考。
1 生药学研究 1.1 鉴别研究市场上常把丫蕊花与兰科植物高斑叶兰Goodyera procera (Ker -Gawl.) Hook.的全草(石凤丹)和菊科植物光叶兔耳风Ainsliaea glabra Hemsl.的全草(红石凤丹)混淆,因此,研究者对丫蕊花进行了鉴别研究[6-7]。
1.1.1 性状特征根状茎圆柱形,有的微弯曲,节明显,质坚实,具极密的环纹或残存的叶基;基生叶,呈匙形或倒披针形,全缘,平行脉;茎生叶倒披针形,基部抱茎;花葶单一,常比叶长,总状花序,花被片白色、淡红色;种子细梭状。气微,味较苦。
1.1.2 结构特征叶的上下表皮细胞均为一层,横切面观略呈长方形,排列紧密;叶肉组织由薄壁细胞构成,没有栅栏组织与海绵组织的区分;皮层中有维管束,并常可见根迹维管束,斜向向外通过。
1.1.3 显微特征主要为螺纹导管,草酸钙针晶束常见,韧皮细胞边缘略呈连珠状增厚;表面观表皮细胞形态不规则,边缘呈波状,气孔为环式,有副卫细胞4个。
1.2 地理分布及适生区丫蕊花属植物主产于中国,是一个较为典型的中国特有分布属,在不丹、缅甸、尼泊尔、越南也有分布。在中国主要分布于云南、湖南南部(雪峰山区)、广西北部、四川中部至东南部、重庆[8]和台湾[9]地区。
丫蕊花喜生于路旁湿地、沟边或瀑布两旁疏松、湿润的石灰岩、红壤或黑壤的腐殖土,以及海拔1 300~2 850 m的地区。尹子丽等[8]根据丫蕊花植物生长的地理、气候等因素,分析预测该植物的主要适生区为西南,即四川、云南、贵州,贵州为最有可能的新适生区,而甘肃(平凉、天水)为次可能的新适生区。
1.3 分子生物学研究为保护丫蕊花植物的物种资源,研究者采用12个微卫星多态标记物,对来自6个自然种群的90株丫蕊花植物个体进行了遗传多态性和遗传结构的研究。结果发现,12个标记物均有多态性,提示丫蕊花植物种群内遗传多态性较高,种群间遗传结构层次较高。另外还发现环境因素可能限制丫蕊花种群间的遗传传递,而种群间的遗传距离与物理距离无较大联系[10]。
1.4 栽培种植研究目前,药用植物丫蕊花已作为峨眉苷胶囊等多种制剂的原料药,随着市场对丫蕊花的需求量日益增大,丫蕊花植物资源日渐萎缩。为保证丫蕊花药用资源的可持续利用,杨建文等[11]发明了一种人工繁育方法,该方法出苗率在67%以上,有效成分的量为2.5%~2.8%,远远高于野生株的量;贺树珍等[12]利用丫蕊花的母体组织叶为外植体材料,进行组织离体培养和无公害种植,获得了大批组培苗,成活率高达95.5%,且止血活性成分高于同年野生药材。
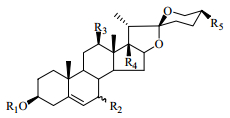
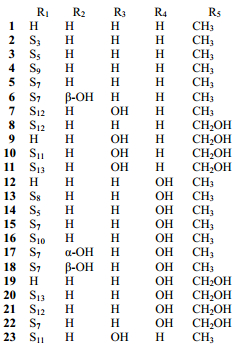
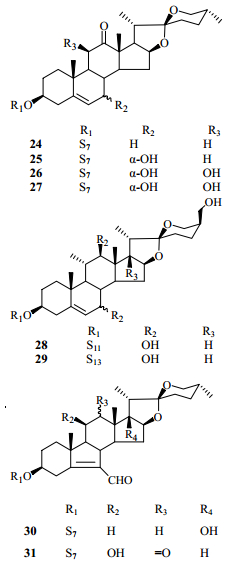
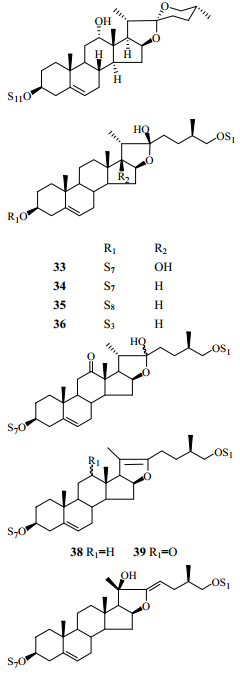
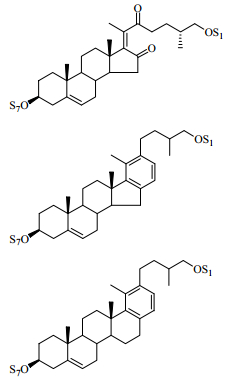
2 化学成分研究丫蕊花的化学成分研究起步较晚,直到21世纪才出现关于丫蕊花化学成分的研究报道。到目前为止,从丫蕊花中分离出甾体皂苷类、黄酮类、糖脂类成分等60余种化合物[13-21],其中以甾体皂苷类成分较多,为56个,按其结构又可大致分为以下几类:螺甾烷型(1~32)、呋甾烷型(33~40)、胆甾烷型(41~43)、雄甾烷型(44、45)、孕甾烷型(46~48)、C22甾体皂苷(49~50)、麦角甾烷型(51~53)和类胆甾烷型(54~56),其中化合物32、48、54~56是近3年来从丫蕊花中分离得到的新甾体皂苷类化合物(表 1)。
|
|
表 1 丫蕊花中的甾体皂苷类化合物 Table 1 Steroid saponins in Y. thibetica |
在已报道的螺甾烷型甾体皂苷中,连接的糖基多是D-葡萄糖、L-鼠李糖和L-呋喃阿拉伯糖,其苷元主要是薯蓣皂苷元和偏诺皂苷元,并且多在3位与糖基成苷。
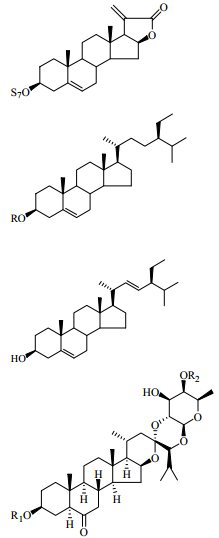
呋甾烷型皂苷是天然产物中的一类重要成分,其苷元与螺甾烷型苷元类似,在酶和一定的酸性条件下,可水解转化成螺甾烷型苷元。研究发现与用70%乙醇水从丫蕊花中提取得到的甾体皂苷相比,大极性部分(40%乙醇水提取部分)中大多数成分是呋甾烷型皂苷,C-3位的糖链构型几乎都是α-L-rhamnopyranosyl-(1→4)-α-L-rhamnopyranosyl-[α-L-rharnnopyranosy-(1→2)]-β-D-glucopyranoside,并且C-26位接一个葡萄糖基。此外,C-22位上的羟基容易甲基化而形成甲氧基[16]。螺甾烷型和呋甾烷型甾体皂苷的母核结构见图 1。
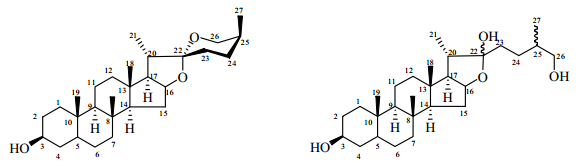
|
图 1 螺甾烷型(A)和呋甾烷型(B)甾体皂苷的母核结构 Fig.1 Mother nucleus structures of spirostanol (A) and furostanol (B) steroid saponins |
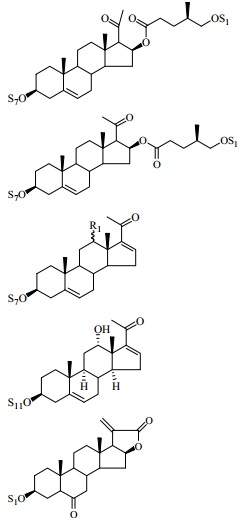
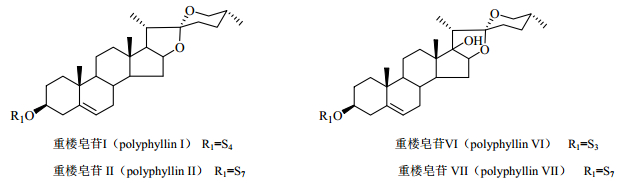
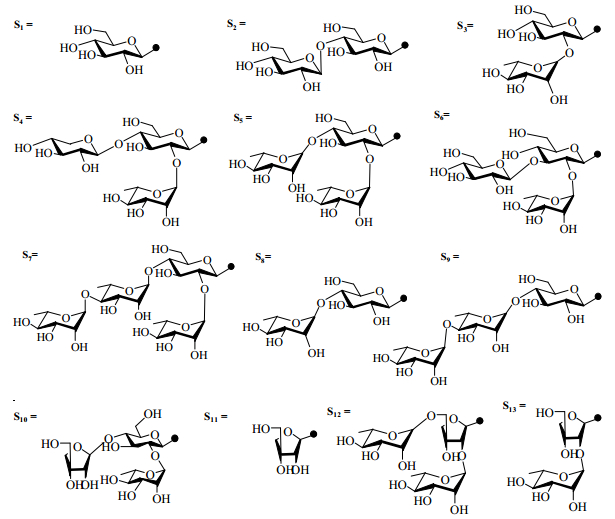
重楼的主要活性成分为甾体皂苷,其在《中国药典》2015年版的定量检测成分见图 2。从丫蕊花和重楼的甾体类化合物结构中不难看出,丫蕊花的多个化学成分在结构上与重楼活性成分十分相似,因此,丫蕊花具有替代重楼的物质基础。重楼和丫蕊花中皂苷类成分的糖配体见图 3。
|
图 2 重楼中的主要活性成分 Fig.2 Main active ingredients in Paris polyphylla |
|
图 3 重楼和丫蕊花中皂苷类成分的糖配体 Fig.3 Sugar ligand saponins in Paris polyphylla and Ypsilandra thibetica |
另外,从丫蕊花中分离得到的黄酮类化合物是木犀草素和木犀草素-7-O-β-D-葡萄糖苷[20];糖脂类成分是helonioside A和helonio1side B[16]。
3 药理作用研究研究发现丫蕊花属植物提取物具有显著的类似于重楼提取物的抗菌、止血、抗肿瘤等药理活性。
3.1 抗菌作用Xie等[13]研究了从丫蕊花中提取得到的5个新的甾体皂苷对多种植物病原真菌和动物致病性细菌的抑制活性,结果发现当浓度达到50 μg/disk时,丫蕊花皂苷B(28)、异丫蕊花皂苷元(9)、异丫蕊花皂苷B(11)均有抑菌活性。异丫蕊花皂苷元浓度为50 μg/disk时,其对串珠镰刀菌Fusarium moniliforme的抑制区大小为9.5 mm,对酿酒酵母菌Saccharomyces cerevisiae抑制区大小为16 mm;丫蕊花皂苷B在浓度为12 μg/disk时,对蜡样芽胞杆菌Bacillus cereus有中等抑菌活性;当异丫蕊花皂苷元浓度为50 μg/disk,异丫蕊花皂苷B浓度为4 μg/disk时,对藤黄微球菌Micrococcus luteus的抑菌区大小分别是17 mm和8 mm。该研究组同时还测定了从丫蕊花中新分离出的5种螺甾烷皂苷的抗真菌活性,结果表明丫蕊花皂苷G(ypsilandroside G,23)对白色念珠菌Candida albicans具有中等抑制作用,其最小抑菌浓度(MIC)为10 μg/mL[14]。
3.2 止血作用周俊院士课题组根据植物亲缘关系具有类似化学成分的原理,经过长期的筛查研究,发现丫蕊花属植物的生药、水提物、有机溶剂提取物、皂苷提取物、偏诺皂苷提取物、复方制剂等均具有显著的类似于重楼提取物的缩宫止血活性,尤其适用于月经过多、产后出血、功能子宫出血、药流术后出血等妇科出血的治疗,并且从丫蕊花中提取分离出一种高含量的止血活性成分Y-1[5, 22],为丫蕊花作为止血民族药提供了科学证据。另外,以丫蕊花为原料药制成的“娥眉甘胶囊”临床前药效学研究表明,与目前临床常用的同类止血药宫血宁胶囊相比,娥眉甘胶囊具有剂量小、疗效显著、使用安全的特点。
3.3 抗肿瘤活性1996年有专利报道丫蕊花中的呋甾烷型皂苷对皮肤癌、子宫癌、肝癌等多种肿瘤细胞增殖具有明显的抑制作用[4]。近年来,从丫蕊花中分离出了多种具有抗肿瘤作用的活性成分。谢百波等[14]研究了从丫蕊花中提取出的5种新螺甾烷型皂苷对5种人肿瘤细胞株(K562、SPC-A-1、BGC-823、Eca-109和AGS)在体外的细胞毒活性,其中发现丫蕊花皂苷G(23)和pennogenin 3-O-α-L-rhamnopyranosyl-(1→2)-[α-L-rhamnopyranosyl-(1→4)-α-L-rhamnopyranosyl-(1→4)]-β-D-glucopyranoside(15)对5种肿瘤细胞株增殖有中等抑制作用。Liu等[18]从丫蕊花中分离出2种新的bisdesmosidc furostanol皂苷和1种新的孕甾烷皂苷,发现丫蕊花皂苷P(37)在浓度为10 μmol/L时对人肿瘤细胞株A549的抑制率为86.4%,对HL-60细胞株的抑制率为75.9%。
但同时也筛选出丫蕊花中多种无抗肿瘤活性的甾体皂苷。芦毅等[16]研究了从丫蕊花中提取出来的5个螺甾烷醇苷对5种肿瘤细胞株的细胞毒性,发现没有一个化合物对肿瘤细胞株有抑制作用。Zhang等[21]也曾研究了从丫蕊花中提取出的3种小螺甾烷苷对5种癌细胞株的抑制作用,结果发现3个化合物均不能抑制肿瘤细胞的生长。Xie等[13]采用MTT法研究所提取的5种甾体皂苷对上述5种肿瘤细胞株的细胞毒性时发现,丫蕊花皂苷B(28)和异丫蕊花皂苷B(11)对5种细胞株均没有抑制作用,且对肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)也没有影响。
3.4 其他作用Si等[23]研究发现,从丫蕊花中提取出的2个新的单糖甾体皂苷对RAW264.7细胞株中脂多糖诱导的含氮氧化产物有抑制作用。Xie等[24]从丫蕊花中分离出了3种新的23-螺胆甾烷衍生物,并发现其中ypsilanogenin(54)对HIV-1有较高的抑制活性。
4 结语与展望丫蕊花属植物提取物具有显著的类似于重楼提取物的药理活性,且两者的活性成分均为甾体皂苷。重楼因其具有较强的抗菌、止血活性,长期以来作为经典的云南白药、宫血宁胶囊等40余种中成药的原料药,市场需求量较大,但重楼生长周期较为缓慢,且来源多为野生,目前已出现严重的重楼资源危机[25]。丫蕊花具有可替代重楼的药效物质基础,在一定程度上可作为重楼替代品,缓解重楼资源濒危。因此,对丫蕊花的研究开发具有重要的现实意义。目前对丫蕊花的研究已取得了重要的研究进展,如原植物栽培繁育方面,探索出了活性成分含量高、生长周期短的培育方法;质量控制方面,建立了丫蕊花活性成分的快速检测方法[26]。尽管如此,丫蕊花尚有较多领域研究缺乏,如丫蕊花活性成分抗菌、止血、抗肿瘤等药理作用机制还未深入阐明,体内代谢过程及毒副作用未知等,这些研究空白严重阻碍了丫蕊花进一步的开发利用。因此,填补这些研究空白成了丫蕊花今后研究的重要方向。
丫蕊花止血、抗肿瘤等作用均疗效显著,可能是重要的止血和抗肿瘤药物。总的说来,研究丫蕊花既是解决重楼资源危机的重要途径之一,又是新药开发的重要方向。丫蕊花具有十分广阔的应用前景,其潜在的临床价值将不可估量,应加快丫蕊花的研究步伐,使丫蕊花早日应用于临床,发挥其药用价值,缓解重楼资源濒危。
| [1] | 国家中医药管理局《中华本草》编委会. 中华本草[M]. 上海: 上海科学技术出版社, 1999. |
| [2] | 中国科学院昆明植物研究所. 云南植物志[M]. 北京: 科学出版社, 1997. |
| [3] | 郑学经, 何治德, 刘明英, 等. 丫蕊花(Ypsilandra thibetica Fr)营养器官形态解剖及气孔复合体发育的初步观察[J]. 四川大学学报, 1983(2):89–94. |
| [4] | 李宏, 陈新民, 川边纪雄, 等.呋甾醇类抗癌药物:中国, CN1081036C[P].2002-03-20. |
| [5] | 周俊, 陈昌祥, 倪伟, 等.丫蕊花属植物在制备治疗出血性疾病药物中的应用:中国, CN1241618C[P].2006-02-15. |
| [6] | 刘瑶, 张现涛. 峨眉石凤丹的生药鉴定[J]. 中国民族民间医药, 2010, 19(5):22–23. |
| [7] | 尹子丽, 谭文红, 张洁, 等. 药用植物丫蕊花生物学特性的初步研究[J]. 云南中医中药杂志, 2014, 35(2):39–40. |
| [8] | 尹子丽, 杨仙雨, 谭文红, 等. 丫蕊花适生区的预测分析研究[J]. 中药材, 2014, 37(7):1154–1157. |
| [9] | Hsu T W, Kono Y, Chiang Hsu T Y, et al. Ypsilandra (Melanthiaceae; Liliaceae sensu lato), a new generic record for Taiwan[J]. Botanical Stud, 2011, 52(1): 99–104. |
| [10] | Li H T, Wang H, Yang J B, et al. Genetic diversity of the traditional Chinese medicinal plant Ypsilandra thibetica (Melanthiaceae):applications for conservation[J]. Biochem Syst Ecol, 2011, 39(4/6): 425–433. |
| [11] | 杨建文, 贺树珍, 杨忠孝, 等.一种丫蕊花的人工繁育方法:中国, CN 200610048655.1[P].2007-07-28. |
| [12] | 贺树珍, 陈昌祥, 刘海洋, 等.丫蕊花组培及种植方法:中国, CN 200910094057.1[P].2009-07-08. |
| [13] | Xie B B, Liu H Y, Ni W, et al. Five new steroidal compounds from Ypsilandra thibetica[J]. Chem Biodivers, 2006, 3(11): 1211–1218. DOI:10.1002/(ISSN)1612-1880 |
| [14] | Xie B B, Liu H Y, Ni W, et al. Ypsilandrosides C-G, five new spirostanol saponins from Ypsilandra thibetica[J]. Steroids, 2009, 74(12): 950–955. DOI:10.1016/j.steroids.2009.07.001 |
| [15] | 杨俊芸.丫蕊花和裂果薯的化学成分研究以及taccalonolide A的化学结构修饰[D].昆明:云南中医学院, 2008. |
| [16] | 芦毅.丫蕊花的化学成分研究[D].昆明:西南林学院, 2009. |
| [17] | Lu Y, Chen C X, Ni W, et al. Spirostanol tetraglycosides from Ypsilandra thibetica[J]. Steroids, 2010, 75(12): 982–987. DOI:10.1016/j.steroids.2010.06.003 |
| [18] | Liu H Y, Chen C X, Ni W, et al. Steroidal and pregnane glycosides from Ypsilandra thibetica[J]. Nat Prod Bioprospect, 2012, 2(1): 11–15. DOI:10.1007/s13659-011-0039-z |
| [19] | Lu Y, Xie B B, Chen C X, et al. Ypsilactosides A and B, two new C22-steroidal lactone glycosides from Ypsilandra thibetica[J]. Helv Chim Acta, 2011, 94(1): 92–97. DOI:10.1002/hlca.v94.1 |
| [20] | 杜丙源, 张现涛, 张雷红, 等. 丫蕊花的化学成分[J]. 药学与临床研究, 2011, 19(4):325–326. |
| [21] | Zhang X D, Chen C X, Yang J Y, et al. New minor spirostane glycosides from Ypsilandra thibetica[J]. Helv Chim Acta, 2012, 95(7): 1087–1093. DOI:10.1002/hlca.v95.7 |
| [22] | 陈昌祥, 周俊, 倪伟, 等.妇科止血新药娥眉苷胶囊及其原植物丫蕊花药材的研究[A]//2011年全国药物化学学术会议论文集[C].广州:中国药学会, 2011. |
| [23] | Si Y A, Yan H, Ni W, et al. Two new steroidal saponins from Ypsilandra thibetica[J]. Nat Prod Bioprospect, 2014, 4(6): 315–318. DOI:10.1007/s13659-014-0043-1 |
| [24] | Xie B B, Chen C X, Guo Y H, et al. New 23-spirocholestane derivatives from Ypsilandra thibetica[J]. Planta Med, 2013, 79(12): 1063–1067. DOI:10.1055/s-00000058 |
| [25] | 李恒, 苏豹, 张兆云, 等. 中国重楼资源现状评价及其种植业的发展对策[J]. 西部林业科学, 2015, 44(3):1–7. |
| [26] | Li X, Ouyang P Y, Gao W, et al. Rapid and sensitive determination of the major ster, oidal Saponins of Ypsilandra thibetica Franch by ultra high-performance liquid chromatography coupled with triple quadrupole mass spectrometry[J]. J Chromatogr Sci, 2016, 54(6): 1010–1015. DOI:10.1093/chromsci/bmw037 |
 2017, Vol. 48
2017, Vol. 48