Waters 2695高效液相色谱仪,紫外检测器(美国waters公司),Empower色谱工作站;CP214型分析天平(奥豪斯仪器有限公司);超声清洗器(洁康超声波有限公司;超声波功率120 W,频率40 kHz);RE-52旋转蒸发器(上海亚荣公司)。
1.2 材料乙腈(HPLC级,Fisher公司),甲酸(优级纯),甲醇(HPLC级,Fisher公司),无水乙醇(分析级,天津大茂化学试剂厂),娃哈哈纯净水。连翘酯苷B(批号111811-201001)和金石蚕苷(批号111812-201001)对照品购自南京泽朗医药有限公司,质量分数经检验大于98%。
广东紫珠药材样品分别来源于江西、广东、广西、湖南、贵州等地,见表 1。所有药材均经江西省林业科学院森林食品与药材研究所朱培林研究员鉴定为马鞭草科紫珠属植物广东紫珠Callicarpa kwangtungensis Chun.。
|
|
表 1 15批广东紫珠样品的产地 Table 1 Sourses of 15 groups of C. kwangtungensis |
2 方法与结果 2.1 溶液的制备 2.1.1 对照品溶液制备
精密称取连翘酯苷B和金石蚕苷对照品约5.0 mg,加甲醇溶解,并定容于10 mL量瓶中,得质量浓度依次为0.52、0.48 mg/mL的对照品溶液,经0.45 μm微孔滤膜滤过,备用。
2.1.2 供试品溶液制备广东紫珠干燥药材经粉碎(过3号筛),精密称取广东紫珠粉末2.0 g,用50 mL 50%乙醇室温下超声提取2次,每次45 min。合并2次滤液,减压浓缩并定容至10 mL,经0.45 μm微孔滤膜滤过,取滤液为供试品溶液。
2.1.3 色谱条件sunfire C18(250 mm×4.6 mm,5 μm)色谱柱;柱温25 ℃;进样量10 μL;体积流量1.0 mL/min;运行时间:110 min;检测波长:265 nm。流动相为乙腈(A)-0.05%甲酸水溶液(B),梯度洗脱,0~15 min,8% A;15~30 min,8%~12% A;30~40 min,12% A;40~60 min,12%~15% A;60~90 min,15%~18% A;90~100 min,18%~20% A;100~110 min,20% A。
2.2 色谱条件的确定 2.2.1 流动相的选择在流动相系统的选择中,分别以乙腈-水、乙腈-0.1%磷酸、乙腈-0.25%磷酸、乙腈-水-冰醋酸、甲醇-水、乙腈-甲醇-0.25%磷酸等不同体积分数、不同比例的流动相系统进行梯度洗脱实验。结果表明,用乙腈-0.1%磷酸进行梯度洗脱为佳,基线平稳,各主要峰之间能够基本实现基线分离,且峰形较好,在调整好流动相的不同时间洗脱比例之后,各峰的保留时间适中,重现性及精密度都较好,有利于指纹图谱的分析。
2.2.2 检测波长的选择文献报道测定广东紫珠药材中2个主要化学成分金石蚕苷、连翘酯苷B多选择于332 nm处测定。而另一类主要成分黄酮类成分一般选择360 nm处进行测定分析。本研究在检测波长的选择实验中,分别尝试了360、332、280、265、210 nm等不同的检测波长进行测定分析,结果显示,于265 nm处检测下的广东紫珠药材图谱信号峰最多,且其中的两个主要成分金石蚕苷、连翘酯苷B的峰相对弱化,从而使其他各相对较弱的峰凸显出来。而指纹图谱的原则是在一张图谱中尽可能多地体现待测样品中的化学成分信号峰,因此,本实验最终选择265 nm为广东紫珠指纹图谱的检测波长。
2.3 方法学考察 2.3.1 精密度试验精密吸取同一供试品溶液各10 μL,按“2.2.3”项下色谱条件连续进样6次测定,记录色谱峰。以连翘酯苷B色谱峰(6号峰)为参照峰,考察共有峰相似度的一致性。结果显示,各共有峰的相对保留时间RSD < 0.3%,相对峰面积的RSD值均小于 < 1.4%,说明该方法精密度良好。
2.3.2 稳定性试验将供试品溶液室温保存,分别于0、1、4、8、12、24 h取同一供试品溶液依法测定。以连翘酯苷B色谱峰(6号峰)为参照峰,计算各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰的相对保留时间RSD < 0.4%,相对峰面积的RSD值均小于 < 1.8%,表明供试品溶液在24 h内稳定性良好。
2.3.3 重复性试验取广东紫珠药材粉末6份,按“2.1.2”项下方法制备供试品溶液,按“2.1.3”项下色谱条件测定,记录色谱峰。以连翘酯苷B色谱峰(6号峰)为参照峰,计算各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰的相对保留时间RSD < 0.5%,相对峰面积的RSD值均小于 < 2.1%,表明该方法重复性良好。
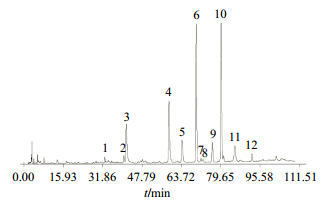
2.4 指纹图谱的建立 2.4.1 广东紫珠药材HPLC指纹图谱测定分别取15批不同来源的广东紫珠药材2 g,按照“2.1.2”项下方法制备供试品溶液,按照“2.1.3”项下色谱条件进行测定,记录色谱图(图 1)。采用中药色谱指纹图谱相似度评价系统(2004A)对15批广东紫珠药材HPLC图谱进行处理,共标定12个共有峰,且该12个共有峰的总面积占总峰面积的90%以上。经与对照品溶液色谱图比对后,确认样品图谱中6号峰是连翘酯苷B,10号峰是金石蚕苷。二者分别是广东紫珠药材的主要活性成分,从图 1中可以看出连翘酯苷B的色谱峰分离度较好,峰面积所占比例较大且相对稳定,因此选择连翘酯苷B(6号峰)为参照峰,建立广东紫珠药材的对照指纹图谱,见图 2。
|
图 1 15批广东紫珠药材指纹图谱 Fig.1 HPLC fingerprints of 15 groups of C. kwangtungensis |
|
6-连翘酯苷B 10-金石蚕苷 6-forsythiaside B 10-poliumoside 图 2 广东紫珠药材对照指纹图谱 Fig.2 HPLC fingerprints of C. kwangtungensis |
2.4.2 相似度评价
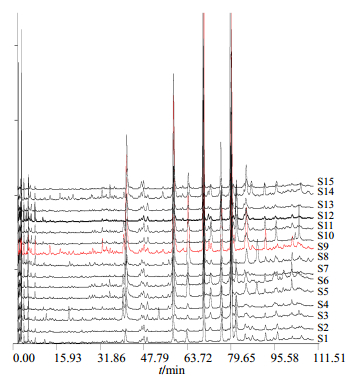
将15批广东紫珠样品指纹图谱数据导入中药色谱指纹图谱相似度评价系统(2004A),利用中位数法,以S9号样品色谱图为参照图谱,采用多点校正后进行自动匹配,生成对照图谱,以此作为广东紫珠药材的对照指纹图谱,进行相似度评价,其计算结果见表 2。15批样品的相似度计算结果均大于0.9,说明各产地的药材有较好的一致性,可以用于综合评价广东紫珠药材的整体质量。
|
|
表 2 15批广东紫珠药材相似度分析结果 Table 2 Results of similarity of 15 batches of C. kwangtungensis |
2.5 聚类分析
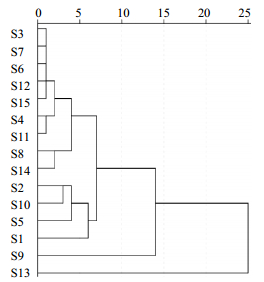
将不同产地的广东紫珠药材HPLC指纹图谱的12个共有峰的峰面积为特征,得到15×12阶原始数据矩阵,运用SPSS19.0分析软件对其进行聚类分析,采用组间连接法,以欧式平方距离为测度,Z标准化,对样品进行聚类分析,结果见图 3。
|
图 3 15批广东紫珠指纹图谱的聚类分析树状图 Fig.3 Hierarchical cluster analysis for 15 batches of C. kwangtungensis |
从中可以看出,15个广东紫珠药材样品总共可以聚为4类,其中,江西寻乌、江西赣州、江西安福、江西井冈山、江西铅山、广东南雄、江西安远、江西余江、贵州榕江聚为第1类;江西南昌、江西宜春、江西武宁、江西萍乡聚为第2类;广西桂林单独聚为第3类;湖南会同单独聚为第4类。从聚类分析结果来看,广东紫珠药材的指纹图谱与其地理位置、外界环境具有一定的相关性,但不绝对相关。
2.6 主成分分析主成分分析是最常用的多指标线性降维压缩和多变量分析方法。它可将原有众多具有一定相关性的变量,重新组合成一组新的、相互无关的综合指标来代替原有的变量,从而实现以最少的主成分尽可能多的体现原变量的信息,以揭示数据结构特征,提取化学信息,已经广泛应用于中药材的品质综合评价与分类。
采用SPSS 19.0统计软件对15个产地广东紫珠药材的指纹图谱数据进行主成分分析,将15批次样品12个共有峰峰面积导入SPSS 19.0软件,进行主成分分析。对广东紫珠药材共有峰峰面积Z标准化处理后,计算相关系数矩阵,主成分特征值、累计贡献率及主成分综合得分等。
2.6.1 相关性分析相关系数矩阵见表 3。6号峰为连翘酯苷B,10号峰为金石蚕苷。色谱峰5和色谱峰2、3具有较大的正相关性;色谱峰6(连翘酯苷B)和色谱峰7具有较大的正相关性;色谱峰9、10(金石蚕苷)、色谱峰11及色谱峰12相互之间均有较大的正相关性。
|
|
表 3 相关系数矩阵 Table 3 Matrix of correlation coefficients |
2.6.2 特征值、方差贡献率
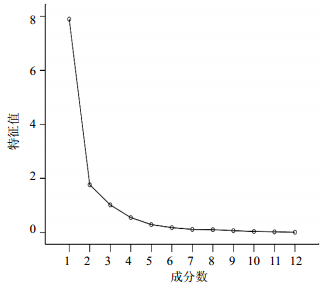
相关系数的特征值和方差贡献率见表 4和图 4。以特征值 > 1为提取标准,得到前3个主成分的累计方差贡献率为88.997% > 85%,故选取前3个主成分即可进行评价,它代表了广东紫珠药材中12个成分量的88.997%的信息量,具有很好的代表性,足以评价广东紫珠药材的品质。
|
|
表 4 特征值和方差贡献率 Table 4 Characteristic value and variance contribution rate |
|
图 4 公共因子碎石图 Fig.4 Macadam figure of common factor |
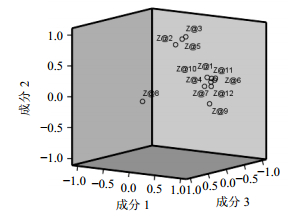
根据因子荷载矩阵,推测影响广东紫珠药材质量差异的并不是单一成分,而是多成分(群)的协同作用的结果。从表 5和图 5中可以看出,第1主成分的信息主要来自于色谱峰1、4、6、7、9、10、11、12;第2主成分主要来自色谱峰2、3、5;第3主成分主要来自色谱峰8的信息。
|
|
表 5 初始因子荷载矩阵 Table 5 Component matrix |
|
图 5 样本在3个主成分的平面分布图 Fig.5 Samples in planar distribution of three main components |
2.6.3 不同产地广东紫珠药材的综合评价
用3个主成分对广东紫珠药材进行综合评价,将得到的特征向量与标准化后的数据相乘,得到主成分表达式,再以每个主成分所对应的特征值占提取主成分总的特征值之和的比例作为权重得到了主成分综合模型,根据主成分综合模型计算15批广东紫珠药材的主成分得分及综合得分值,见表 6,综合得分越高,表明质量越好。综合得分结果显示,湖南会同、广西桂林、江西武宁、江西南昌、江西萍乡、江西宜春的广东紫珠药材在所有样品中的综合得分位于前6名,表明该6个产地的广东紫珠药材质量较好,对应药材指纹图谱信息,该6个产地的广东紫珠药材的指纹图谱中主要成分3、4、5、6、9、10、11的峰面积值均较大,结果也证明了主成分分析时提取的3个主成分能够基本体现指纹图谱的所有信息。综合聚类分析结果,第1类广东紫珠药材质量较差,其余产地的广东紫珠药材质量较好,且湖南会同产广东紫珠药材质量最好。主成分综合分析结果与聚类分析的结果相互得以印证。
|
|
表 6 主成分得分、综合得分排序 Table 6 Rank of principal compoment scores and comprehensive scores |
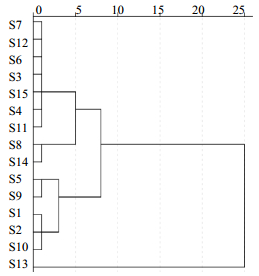
15个不同产地的广东紫珠药材质量的差异,分析原因可能是不同的生态环境(包括土壤、气候、水分、矿物质分布情况等)对中药材的质量产生一定的影响。自然生态环境与中药资源的质量(有效成分的形成和积累)、数量密切相关,是其生态适宜性评价的客观基础,也是药材生产区划的关键所在。不同产地广东紫珠药材再按综合主成分得分值进行聚类分析,聚类结果见图 6。15批广东紫珠药材分为3类,综合得分排名第1的湖南会同产广东紫珠药材单独聚为第1类;综合得分排名第2、3、4、5、6位广西桂林、江西武宁、江西南昌、江西萍乡、江西宜春产的广东紫珠药材聚为第2类;其他产地广东紫珠药材聚为第3类,与上述聚类分析结果基本一致,略有不同。
|
图 6 15批广东紫珠药材指纹图谱主成分聚类图 Fig.6 Hierarchical cluster analysis of principal compoment for 15 batches of C. kwangtungensis |
3 讨论
中药化学成分复杂多样,通过研究很难将其中所有的化学物质一一明确,因此,如何在化学物质不完全明确的前提下,依然能够提取出充分的、可靠的信息用以控制药材质量显得非常重要。指纹图谱技术的优势便在于此。目前,对于广东紫珠药材的HPLC指纹图谱报道较少,余婧等[8]对广东紫珠的止血谱效模式做了初步的研究,其中包括了广东紫珠指纹图谱的构建,但是其研究重点在于广东紫珠的止血谱效关系,并未对指纹图谱本身进行深入分析。
本实验首先对广东紫珠HPLC指纹图谱的色谱条件进行了深入的摸索,获得的广东紫珠HPLC指纹图谱基线平稳,各主要峰之间能够基本实现基线分离,且峰形较好,各峰的保留时间适中,重现性及精密度都较好,有利于指纹图谱的进一步分析。
其次,本实验对广东紫珠的指纹图谱进行了相似度评价、聚类分析及主成分分析。根据15个不同产地的广东紫珠药材指纹图谱的分析结果可以看出,15批药材的相似度计算结果均大于0.900,说明各产地的药材有较好的一致性。聚类分析将15批广东紫珠药材聚为4类,聚类结果表明广东紫珠药材的指纹图谱与其地理位置、外界环境具有一定的相关性,但不绝对相关。用提取的3个主成分对广东紫珠药材进行综合评价,综合得分结果显示,湖南会同、广西桂林、江西武宁、江西南昌、江西萍乡、江西宜春的广东紫珠药材在所有样品中的综合得分位于前6名,综合聚类分析结果,第1类广东紫珠药材质量较差,其余产地的广东紫珠药材质量较好,且湖南会同产广东紫珠药材质量最好。
本实验运用指纹图谱结合化学计量学对不同产地的广东紫珠药材质量进行评价,结论较之单一的测定更为全面准确,可用于广东紫珠药材质量的评价和控制,对广东紫珠的规范化种植也具有很好的指导意义。
| [1] | 中国药典[S].一部.2015. |
| [2] | 郭文, 付辉政, 周国平, 等. 广东紫珠正丁醇部位化学成分分析[J]. 中国实验方剂学杂志, 2015, 21(3):52–55. |
| [3] | 周凌云. 紫珠地上部分的化学成分[J]. 中草药, 2011, 42(3):454–457. |
| [4] | 贾安, 杨义芳, 孔德云. 广东紫珠中黄酮碳苷的分离与结构鉴定及初步体外抗炎活性研究[J]. 中国医药工业杂志, 2012, 43(4):263–268. |
| [5] | 蔡灏, 孙秀漫, 欧阳彩君, 等. HPLC测定不同产地广东紫珠中3种苯乙醇苷的含量[J]. 中国实验方剂学杂志, 2013, 19(10):63–65. |
| [6] | 陈颖, 许敏, 凌嘉伟, 等. 不同采收期广东紫珠中两种抗炎活性成分的动态变化[J]. 中医药学报, 2014, 42(1):29–31. |
| [7] | 唐玉莲, 易凯, 史外鹏, 等. 广东紫珠总黄酮提取工艺优化及含量测定[J]. 怀化学院学报, 2014, 33(5):5–9. |
| [8] | 余婧, 杨义芳, 胡晓, 等. 广东紫珠止血谱效相关模式的研究[J]. 中国医药工业杂志, 2015, 46(5):467–472. |
 2017, Vol. 48
2017, Vol. 48


