2. 沈阳药科大学 基于靶点的药物设计与研究教育部重点实验室, 辽宁 沈阳 110016
2. Key Laboratory of Structure-Based Drug Design and Discovery of Ministry of Education, Shenyang Pharmaceutical University, Shenyang 110016, China
牛黄解毒片作为经典的中成药品种,临床上主要应用于火热内盛、咽喉肿痛、牙龈肿痛、口舌生疮、目赤肿痛等症状,经过几百年的临床实践,其疗效已得到中医药界的广泛认可,并已成为临床最为常用的中成药之一,被《中国药典》2015年版一部收载。牛黄解毒片由人工牛黄、雄黄、冰片、石膏、大黄、黄芩、桔梗和甘草8味中药组成。牛黄解毒片每日服用量中雄黄的量高达200~300 mg,相当于《中国药典》规定的雄黄最高服用量的2~3倍。作为含砷复方牛黄解毒片的安全性问题已引起国内外药品监管部门的关注。
作为系统生物学的一个重要分支,代谢组学被定义为“生物体对疾病生理或基因修饰等刺激产生的代谢物质动态应答的定量测定”[1],其核心在于研究比较外源物刺激或基因变异后体液中代谢物组的变化应答规律,进而研究生物体系的代谢途径。代谢组学的整体性、系统性和综合性与中医药理论的整体观、动态观、辩证观及中药及其复方多组分、多靶点、多层次、多代谢途径的作用特点相吻合[2]。随着基于核磁、质谱以及化学计量学软件的代谢组学分析技术平台的不断发展,代谢组学已在中医药现代研究中得到了广泛的应用,包括中药作用机制、中药整体药效评价和安全性评价及质量控制等[3-5]。
前期研究结果表明牛黄解毒片配伍后使得雄黄肝肾毒性降低,而雄黄同时配伍人工牛黄、石膏、冰片3味中药,其肝肾毒性并没有明显降低[6]。本实验继续采用基于1H-NMR代谢组学技术,研究牛黄解毒片处方分别去除人工牛黄、石膏、冰片3味中药后雄黄的肝、肾毒性情况,进一步探讨人工牛黄、石膏、冰片3味中药对雄黄的配伍减毒作用。
1 材料 1.1 动物雄性Wistar大鼠(SPF级)42只,体质量(170±20)g,由沈阳药科大学实验动物中心提供,动物许可证号SCXK-(军)-2009-0004。动物自由摄食饮水,饲养室光照12 h,黑暗12 h,室温17~25 ℃,湿度45%~60%。
1.2 药材牛黄解毒片中各单味中药均购于河北省安国市昌达中药饮片公司。沈阳药科大学生药学教研室路金才教授对各单味中药予以鉴定,均符合《中国药典》2010年版标准。
1.3 试剂与仪器2, 2, 3, 3-三甲基硅烷基丙酸(TSP)、重水(D2O)购自青岛腾龙微波科技有限公司。Bruker AVANCE-600型核磁共振波谱仪(瑞士Bruker公司)。
2 方法 2.1 动物分组及给药将大鼠于代谢笼中饲养适应7 d,按照体质量随机分成6组,每组7只,分别为对照组(A组)、雄黄组(B组)、牛黄解毒片全方组(C组)、牛黄解毒片去人工牛黄组(D组)、牛黄解毒片去石膏组(E组)、牛黄解毒片去冰片组(F组)。大鼠的给药剂量见表 1,雄黄的剂量(2 g/kg)参考文献报道[7]及预试验设定,其他中药的剂量是按照《中国药典》2010年版中牛黄解毒片各味中药的配比设定的。牛黄解毒片按照《中国药典》2010年版的制备方法,雄黄水飞成细粉;大黄粉碎成细粉;人工牛黄、冰片研细;石膏、黄芩、桔梗、甘草4味药加水煎煮2次,每次2 h,滤过,合并滤液,滤液浓缩成稠膏或干燥成干浸膏,加入大黄、雄黄粉末,再加入人工牛黄、冰片粉末,混匀,4 ℃条件下保存备用。每天上午固定时间ig给药,连续给药7 d。给药体积为20 mL/kg。
|
|
表 1 6组大鼠的给药情况 Table 1 Dosage of six groups |
2.2 生物样品的采集
采用代谢笼法,从给药前1 d开始分别收集每天夜间12 h尿液直到实验结束。收集尿液的试管需放置于装有冰块的烧杯中,并在试管中加入100 μL NaN3作为抑菌剂。将收集好的尿液转移至EP管中,于−20 ℃条件下保存待用。采用腹腔动脉取血方式采集血液样品,离心(15 000×g,10 min),将上清液即血清样品转移至EP管中,于−80 ℃条件下保存待用。
2.3 尿液和血清样品的处理 2.3.1 尿液样品的处理取出尿液样品,常温解冻,离心(3 500×g,5 min,4 ℃),取上清液400 μL与200 μL磷酸盐缓冲液(0.2 mol/L,pH=7.4)混匀,静置5 min,离心(3 500×g,5 min,4 ℃),取上清液500 μL加入40 μL TSP和20 μL D2O,混匀,转移至5 mm核磁样品管中进行测试。
2.3.2 血清样品的处理取出血清样品,常温解冻,离心(15 000×g,10 min,4 ℃),取上清液300 μL加入100 μL TSP和200 μL D2O,混匀,转移至5 mm核磁样品管中进行测试。
2.4 尿液和血清样品的测试在298.2 K条件下,使用Bruker AVANCE-600型核磁共振波谱仪采集尿液和血清样品的核磁共振数据。尿液样品采用有水峰压制的1D NOESY脉冲程序,测试参数如下:谱宽12 019.2 Hz,弛豫延迟时间3 s,混合时间0.1 s,测试时间2.73 s,采样数据点64 K,累加次数64次,在弛豫延迟时间内采用预饱和方式压制水峰,水峰压制脉冲强度为50 dB。血清样品采用有水峰压制的1D CPMG(Carr-Purcell-Meiboom-Gill)脉冲程序,测试参数如下:谱宽12 019.2 Hz,弛豫延迟时间3 s,混合时间0.1 s,测试时间2.73 s,采样数据点64 K,累加次数64次,在弛豫延迟时间内采用预饱和方式压制水峰,水峰压制脉冲强度为50 dB。
2.5 数据的处理与分析采用MestReNova软件(MestReNova 6.1,Mestrelab Research SL.)将FID信号通过傅里叶变换成一维NMR谱图,进行相位和基线校正,以TSP峰为化学位移参考峰,化学位移标记为δ 0,将δ 9.60~0.20的谱图以0.04为宽度进行分段积分,并将产生的积分面积数据以Excel文件格式保存,其中尿液样品谱图中δ 6.20~5.48(尿素峰),δ 5.20~4.72(水峰),血清样品谱图中δ 5.20~4.60(水峰)需要删除,将柠檬酸的信号δ 2.70~2.64、δ 2.58~2.52合并为δ 2.66和δ 2.54,然后将所有数据进行归一化和标准化处理(SPSS 11.5,Chicago,Inc,美国),用于模式识别分析。
最后将上述数据导入SIMCA-P 11.5软件包(Umetrics AB,Umea,瑞士)进行偏最小二乘判别分析(PLS-DA),分析结果以得分图(Scores plot)和载荷图(Loadings plot)的形式表示。
3 尿液及血清样本1H-NMR模式识别分析各组大鼠尿液及血清样本的600 MHz 1H-NMR代表性谱图分别见图 1和2。PLS-DA得分图(图 3-a-Ⅰ、图 3-b-Ⅰ)显示牛黄解毒片去人工牛黄组(D组)、牛黄解毒片去石膏组(E组)、牛黄解毒片去冰片组(F组)大鼠尿液及血清的代谢轮廓趋同于牛黄解毒片组,与对照组相似,区别于雄黄组(B组)。
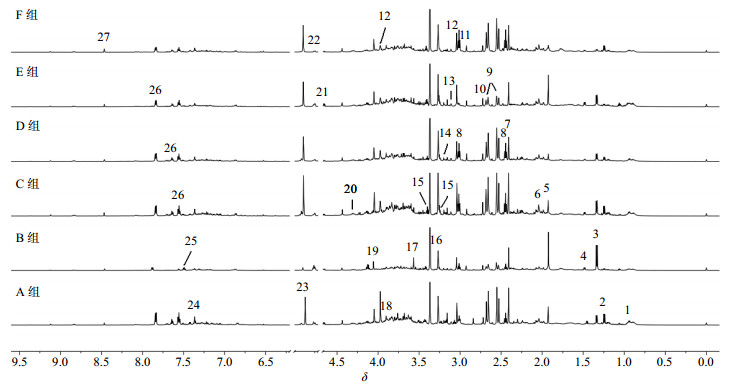
|
1-亮氨酸/异亮氨酸2-3-羟基丁酸盐3-乳酸盐4-丙氨酸5-乙酸盐6-乙酰乙酸盐7-丙酮酸盐8-2-酮戊二酸盐9-柠檬酸盐10-二甲胺11-二甲基甘氨酸12-肌酸13-丙二酸盐14-胆碱15-牛磺酸16-N-氧化三甲胺17-甘氨酸18-甜菜碱19-肌酸酐20-苹果酸21-β-葡萄糖22-α-葡萄糖23-尿囊素24-苯丙氨酸25-3-羟基吲哚硫酸盐26-马尿酸盐27-甲酸盐 1-leucine/isoleucine 2-3-hydroxybutyrate 3-lactate 4-alanine 5-acetate 6-acetoacetate 7-pyruvate 8-2-ketoglutarate 9-citrate 10-dimethylamine 11-dimethylglycine 12-creatine 13-malonate 14-choline 15-taurine 16-trimethylamine-N-oxide 17-glycine 18-betaine 19-creatinine 20-malate 21-β-glucose 22-α-glucose 23-allantoin 24-phenylalanine 25-3-indoxylsulfate 26-hippurate 27-formate 图 1 各组大鼠尿液1H-NMR谱图 Fig.1 1H-NMR spectra of urine obtained from rats in each group |
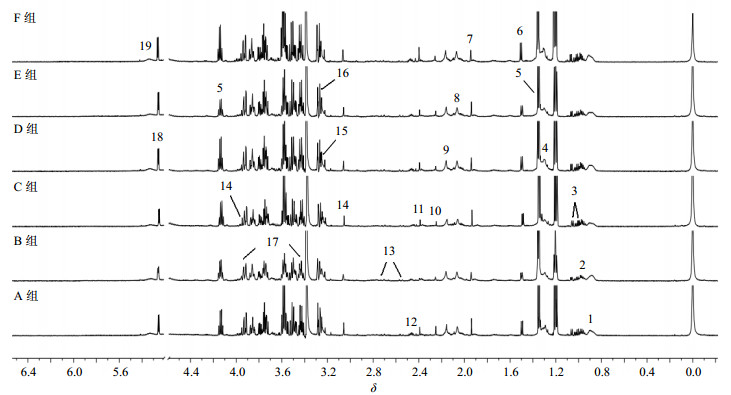
|
1-低密度/极低密度脂蛋白-CH3 2-亮氨酸/异亮氨酸3-缬氨酸4-低密度/极低密度脂蛋白-CH2-5-乳酸盐6-丙氨酸7-乙酸盐8-N-乙酰糖蛋白9-甲硫氨酸10-乙酰乙酸盐11-丙酮酸盐12-2-酮戊二酸盐13-柠檬酸盐14-肌酸15-胆碱16-N-氧化三甲胺17-葡萄糖18-α-葡萄糖19-不饱和脂类 1-very low-density lipoprotein (VLDL)/low-density lipoprotein (LDL)-CH3 2-leucine/isoleucine 3-valine 4-VLDL/LDL-CH2-5-lactate 6-alanine 7-acetate 8-N-acetylglycoprotein 9-methionine 10-acetoacetate 11-pyruvate 12-2-ketoglutarate 13-citrate 14-creatine 15-choline 16-trimethylamine-N-oxide 17-glucose 18-α-glucose 19-unsaturated lipid 图 2 各组大鼠血清1H-NMR谱图 Fig.2 1H-NMR spectra of serum obtained from rats in each group |
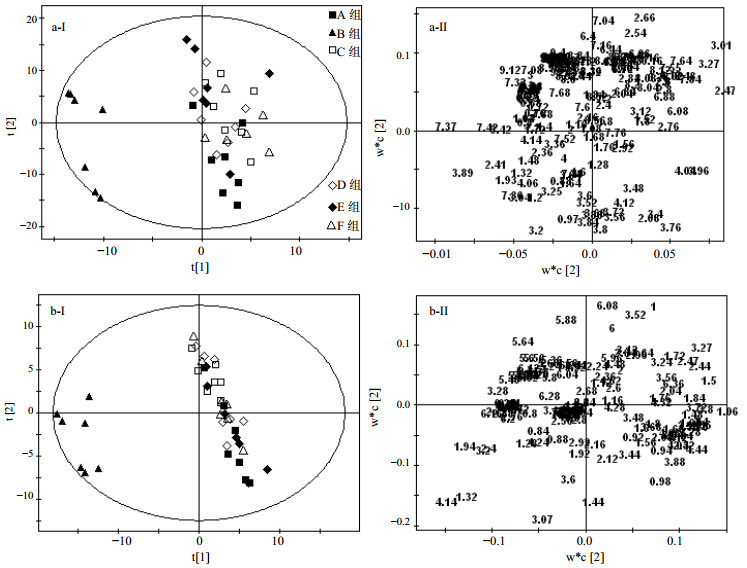
|
图 3 各组大鼠尿液(a)和血清(b)样本1H-NMR谱图数据PLS-DA得分图(Ⅰ)及其载荷图(Ⅱ) Fig.3 PLS-DA Scores plot (Ⅰ) and corresponding loadings plot (Ⅱ) based on 1H-NMR spectra of urine (a) and serum (b) of rats in each group |
相应的载荷图(图 3-a-Ⅱ、图 3-b-Ⅱ)显示牛黄解毒片去人工牛黄组(D组)、牛黄解毒片去石膏组(E组)、牛黄解毒片去冰片组(F组)大鼠尿液与雄黄组(B组)大鼠尿液相比亮氨酸、异亮氨酸、3-羟基丁酸盐、乳酸盐、丙氨酸、乙酸盐、丙酮酸盐、肌酸、胆碱、牛磺酸、甜菜碱、肌酸酐和苯丙氨酸等内源性代谢产物水平降低,而2-酮戊二酸盐、柠檬酸盐、N-氧化三甲胺(TMAO)和马尿酸盐水平升高。
相比雄黄组(B组),牛黄解毒片去人工牛黄组(C组)、牛黄解毒片去石膏组(E组)、牛黄解毒片去冰片组(F组)大鼠血清中亮氨酸、异亮氨酸、缬氨酸、丙氨酸、2-酮戊二酸盐和TMAO等内源性代谢产物浓度升高,而乳酸盐、乙酸盐、丙酮酸盐、肌酸和胆碱的浓度降低。
各组大鼠尿液和血清样本中内源性代谢产物的变化趋势分别见表 2和3。
|
|
表 2 各组与对照组相比大鼠尿液中内源性代谢产物的变化趋势 Table 2 1H-NMR detected relative integral levels of metabolites in urine samples of different groups |
|
|
表 3 各组与对照组相比大鼠血清中内源性代谢产物的变化趋势 Table 3 Alterations of relative integral concentration of endogenous metabolites in serum among groups |
4 讨论
柠檬酸盐和2-酮戊二酸盐是三羧酸循环的重要中间产物。肝细胞线粒体是三羧酸循环的主要场所。柠檬酸盐与2-酮戊二酸盐量的变化与肝脏能量代谢有关,可反映肝脏线粒体的功能,其量降低通常是由于线粒体功能紊乱引起的[8]。当线粒体功能减弱,三羧酸循环和氧化磷酸化的效率降低,肝细胞通过增强糖酵解-糖异生途径来弥补ATP生成的不足[9]。丙酮酸是糖酵解-糖异生过程的重要中间产物,所以雄黄组(B组)大鼠体内丙酮酸的量明显高于其他组大鼠。当三羧酸循环受到抑制,糖酵解-糖异生作用强于氧化磷酸化水平,丙酮酸氧化脱羧作用降低,生成乳酸的过程增强[10]。糖酵解-糖异生功能增强会转而抑制乙酰辅酶A进入三羧酸循环,乙酰辅酶A会被转化成酮体[11]。解释了雄黄组大鼠尿液当中酮体之一的3-羟基丁酸盐的量较其他组大鼠高这一结果。乙酰辅酶A会在乙酰辅酶A水解酶的作用下生成乙酸盐[12]。
雄黄组尿液中氨基酸(亮氨酸、异亮氨酸、丙氨酸)的浓度升高,意味着肾小管对低分子化合物重吸收的能力下降,是一个典型的近曲小管非特异性损伤标志[13]。肝脏是体内氨基酸代谢的主要场所,当肝脏产生损伤时,肝细胞中氨基酸代谢紊乱,可造成血清中支链氨基酸(亮氨酸、异亮氨酸、缬氨酸)浓度的降低[14]。
肌酸酐是肌酸的代谢产物,其量基本恒定,大部分从肾小球滤过而不被肾小管吸收,其变化主要反映肾小球的滤过功能(肾脏的排泄能力)[15]。实验中,雄黄组大鼠血清中肌酸酐的量较其他组升高,说明肌酸酐的清除率在雄黄组大鼠肾脏中降低,即雄黄会影响肾小球的滤过功能。
TMAO是胆碱的降解产物,首先胆碱需要在肠道菌群的作用下转化成TMAO的前体物三甲胺,然后三甲胺在肝脏中被黄素单加氧酶系统氧化为TMAO。雄黄作为一种矿物药对肠道菌群会产生影响,雄黄组大鼠体内TMAO的量下降很有可能是雄黄改变肠道微生物环境造成的。甜菜碱也是胆碱的代谢产物。当肠道微生物活性降低,TMAO生成减少,尿液中甜菜碱的量会增加[16],与实验结果雄黄组大鼠尿液中甜菜碱的量升高相吻合。此外,肾小管损伤也会造成尿液当中甜菜碱量的增加[17]。马尿酸盐的生成需要有充足的ATP,由于线粒体中氧化磷酸化过程活性降低,ATP生成不足,会影响马尿酸盐的生成。其次,马尿酸盐的前体苯甲酸是肠道菌群的产物[18],肠道菌群活性降低,苯甲酸的生成量会受到影响,进而影响马尿酸盐的生成。雄黄组大鼠尿液中马尿酸盐的量下降进一步证实雄黄对大鼠肝脏造成的损伤以及对肠道菌群活性的影响。
现代毒理学研究结果表明,雄黄对肝脏和肾脏具有明显的毒性[19-21],前期实验证实了这一点,并且发现牛黄解毒片全方配伍后与雄黄相比,几乎不呈现等剂量雄黄所表现出的肝肾毒性[6]。本实验发现牛黄解毒片去人工牛黄,牛黄解毒片去石膏,牛黄解毒片去冰片3组大鼠与牛黄解毒片组和对照组大鼠的代谢轮廓相似,没有表现出雄黄样的肝肾毒性。说明人工牛黄、石膏、冰片3味中药在牛黄解毒片配伍降低雄黄肝肾毒性方面作用不明显。经文献调研确未发现人工牛黄、石膏、冰片具有肝、肾保护作用。进一步证实人工牛黄、石膏、冰片并不是牛黄解毒片配伍降低雄黄肝肾毒性方面起主要作用的中药。
| [1] | Nicholson J K, Lindon J C, Holmes E. 'Metabonomics':understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29(11): 1181–1189. DOI:10.1080/004982599238047 |
| [2] | 李春雨, 王张, 王平, 等. 基于代谢组学技术的中药效应物质基础及作用机制研究[J]. 中草药, 2013, 44(7):918–922. |
| [3] | 王广基, 查伟斌, 郝海平, 等. 代谢组学技术在中医药关键科学问题研究中的应用前景分析[J]. 中国天然药物, 2008, 6(2):89–97. |
| [4] | 李震宇, 何盼, 秦雪梅. 代谢组学技术在中药材商品规格研究中的应用思考[J]. 中草药, 2015, 46(7):943–948. |
| [5] | 赵珊, 王鹏程, 冯健, 等. 代谢组学技术及其在中医药研究中的应用[J]. 中草药, 2015, 46(5):756–765. |
| [6] | Xu W F, Wang H F, Chen G, et al. 1H NMR-based metabonomics study on the toxicity alleviation effect of other traditional Chinese medicines in Niuhuang Jiedu tablet to realgar (As2S2)[J]. J Ethnopharmacol, 2013, 148(1): 88–98. DOI:10.1016/j.jep.2013.03.073 |
| [7] | Wei L, Liao P, Wu H, et al. Metabolic profiling studies on the toxicological effects of realgar in rats by 1H NMR spectroscopy[J]. Toxicol Appl Pharm, 2009, 234(3): 314–325. DOI:10.1016/j.taap.2008.11.010 |
| [8] | Jaeschke H, Gores G J, Cederbaum A I, et al. Mechanisms of hepatotoxicity[J]. Toxicol Sci, 2002, 65(2): 166–176. DOI:10.1093/toxsci/65.2.166 |
| [9] | Marty C, Posthuma C, Lolkema J S, et al. Proton motive force generation by citrolactic fermentation in Leuconostoc mesenteroides[J]. J Bacteriol, 1996, 178(8): 2178–2185. DOI:10.1128/jb.178.8.2178-2185.1996 |
| [10] | Liao P, Wei L, Zhang X, et al. Metabolic profiling of serum from gadolinium chloride treated rats by 1H NMR spectroscopy[J]. Anal Biochem, 2007, 364(2): 112–121. DOI:10.1016/j.ab.2007.02.020 |
| [11] | McGarry J D, Foster D W. Regulation of hepatic fatty acid oxidation and ketone body production[J]. Annu Rev Biochem, 1980, 49(1): 395–420. DOI:10.1146/annurev.bi.49.070180.002143 |
| [12] | Knowles S E, Jarrett I G, Filsell O H, et al. Production and utilization of acetate in mammals[J]. Biochem J, 1974, 142(2): 401–411. DOI:10.1042/bj1420401 |
| [13] | Holmes E, Nicholson J K, Nicholls A W, et al. The identification of novel biomarkers of renal toxicity using automatic data reduction techniques and PCA of proton NMR spectra of urine[J]. Chemometr Intell Lab Syst, 1998, 44(1/2): 245–255. |
| [14] | Patelli C, Kong S E, McCauley R, et al. Branched-chain amino acids[J]. J Gastroen Hepatol, 2000, 166(7): 706–717. |
| [15] | Feng J H, Li X J, Pei F K, et al. H-1 NMR analysis for metabolites in serum and urine from rats administrated chronically with La (NO3)3[J]. Anal Biochem, 2002, 301(1): 1–7. DOI:10.1006/abio.2001.5471 |
| [16] | Zeisel S H, Wishnok J S, Blusztajn J K. Formation of methylamines from ingested choline and lecithin[J]. J Pharmacol Exp Ther, 1983, 225(2): 320–324. |
| [17] | Dellow W J, Chambers S T, Lever M, et al. Elevated glycine betaine excretion in diabetes mellitus patients is associated with proximal tubular dysfunction and hyperglycemia[J]. Diabetes Res Clin Pr, 1999, 43(2): 91–99. DOI:10.1016/S0168-8227(98)00115-6 |
| [18] | Phipps A N, Stewart J, Wright B, et al. Effect of diet on the urinary excretion of hippuric acid and other dietary-derived aromatics in rat.A complex interaction between diet, gut microflora and substrate specificity[J]. Xenobiotica, 1998, 28(5): 527–537. DOI:10.1080/004982598239443 |
| [19] | 高双荣, 梁爱华, 戴宝强, 等. 雄黄肝脏毒性的病理学特征[J]. 中国实验方剂学杂志, 2013, 19(19):295–299. |
| [20] | 高双荣, 梁爱华, 戴宝强, 等. 雄黄肾脏毒性的病理学特征[J]. 中国实验方剂学杂志, 2013, 19(18):297–301. |
| [21] | Wei L, Liao P Q, Wu H F, et al. Toxicological effects of cinnabar in rats by NMR-based metabolic profiling of urine and serum[J]. Toxicol Appl Pharm, 2008, 227(3): 417–429. DOI:10.1016/j.taap.2007.11.015 |
 2017, Vol. 48
2017, Vol. 48



