人参Panax ginseng C. A. Meryer属五加科人参属草本植物,是驰名中外的贵重中药。中医认为,人参具有大补元气、生津安神等作用[1]。人参皂苷是人参主要的活性成分,具有滋补强壮、延缓衰老、抗肿瘤、调节内分泌系统,增加免疫功能等独特功效[2-4]。人参皂苷属于三萜类皂苷,可分为3类:原人参二醇类皂苷(PPD)、原人参三醇类皂苷(PPT)和齐墩果烷类皂苷,已知的人参皂苷有180余种[5];但人参中80%~90%的皂苷为人参皂苷Rb1(Rb1)、人参皂苷Rb2(Rb2)、人参皂苷Rc(Rc)、人参皂苷Rd(Rd)、人参皂苷Re(Re)、人参皂苷Rg1(Rg1)和人参皂苷Rf(Rf)等[6],其主要皂苷的人体吸收率较低、活性低[7-8];而人参稀有皂苷C-K(C-K)、人参稀有皂苷C-Mc(C-Mc)、人参稀有皂苷C-Y(C-Y)、人参稀有皂苷F2(F2)、人参稀有皂苷Rh2(Rh2)等,吸收率高、活性高,除了具有安神补脑、抗疲劳、抗肿瘤等功效,还具有促进毛发生长、抗皮肤老化等作用[9-14]。
为了得到高活性人参稀有皂苷,本实验室发现了4种人参皂苷酶:即水解PPD中Rb1、Rb2、Rc和Rd的第3(碳)-O-和20(碳)-O-多种糖基的人参皂苷酶Ⅰ型[15];水解PPD的20-O-多种糖基的人参皂苷酶Ⅱ[16];还有一种克隆在E. coli C41(DE3)菌种中表达的人参皂苷酶Ⅲ型,能水解PPD的3-O-多种糖基[17];水解PPT中Re、三七皂苷R1(R1)、Rg1皂苷6-O-多种糖基的人参皂苷酶IV型[18];利用上述4种酶可以生物转化人参皂苷,制备各种人参稀有皂苷。
本实验室研究了来自Aspergillus g.848菌的人参皂苷酶Ⅰ型,酶相对分子质量为75 000,能水解Rb1、Rb2、Rc、Rd和Rg3的3-O-和20-O-位置的多种糖基。该酶先水解Rb1的20-O-末端Glc变成Rd,然后再水解3-O-末端Glc至F2,最后水解F2的3-O-Glc得到C-K,其水解途径为Rb1→Rd→F2→C-K;该酶先水解Rb2和Rc的3-O-Glc,其水解途径为Rb2→C-O→C-Y→C-K,Rc→C-Mc1→C-Mc→C-K;根据米氏常数计算,酶水解皂苷糖基速度为Rb1的20-O-Glc > Rb2的3-O-Glc > Rc的3-O-Glc > Rd的3-O-Glc;利用该酶,控制酶反应时间、酶反应温度和底物浓度,从PPD中Rb1、Rb2、Rc、Rd可制备C-K、C-Y、C-Mc和F2等[19-20]。
由于纯酶和人参皂苷单体价格昂贵,因此本实验利用廉价的Aspergillus g.848菌人参皂苷酶Ⅰ型粗酶液与市售的PPD混合物反应,低成本制备高活性人参稀有皂苷;研究了PPD混合皂苷中的各种皂苷,在不同反应时间的变化动态和产物的生成机制,为大量制备人参稀有皂苷提供基础依据。
1 仪器与材料Waters 2695高效液相色谱分析仪,Waters 2996二极管阵列检测器及Empower色谱工作站,美国Waters公司;Unitary C18色谱柱(250 mm×4.6 mm,5 μm),华谱创新科技有限公司。核磁共振仪Bruke AVANCE 600、NMR spectrometer,瑞士Bruke公司。Waters UPLC-Q-TOF-MS PremierTM超高效液相色谱-四级杆-飞行时间串联质谱联用仪,美国Waters公司。
Aspergillus g.848菌,本实验室提供;PPD原料、4种异构体的Rg3组和Rh2组,天乐集团产品;人参皂苷对照品C-K、C-Y、C-Mc、F2、20(S)-Rh2、20(R)-Rh2、人参皂苷Rh3(Rh3)、人参皂苷Rk2(Rk2)等,本实验室自制,经中国科学院长春应用化学研究所国家电化学和光谱分析中心核对结构,质量分数均在95%以上。薄层色谱(TLC)板Silica gel 60-F254,德国Merck公司;AB-8大孔树脂、D-280大孔树脂、硅胶,天津南开大学试剂厂。
2 方法与结果 2.1 人参皂苷、PPD原料分析方法 2.1.1 TLC法用毛细管吸取对照品或样品溶液,在TLC板上点样、吹干,放入盛装有展开剂的层析缸中封口展开,展开剂为氯仿-甲醇-水(7:3:0.5)。展开结束后,用10%硫酸加热显色。
2.1.2 HPLC法Unitary C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水;洗脱程序:0~20 min,20%乙腈(等度);20~31 min,20%~32%乙腈(线性梯度);31~40 min,32%~43%乙腈(线性梯度);40~70 min,43%~100%乙腈(线性梯度);进样量10 μL;柱温35 ℃;体积流量0.6 mL/min;检测波长203 nm;柱效为78 000塔板/m。
2.1.3 样品检测将待测人参皂苷样品用色谱甲醇溶解,经0.45 μm滤膜滤过,即为检测样品。分别按“2.1.1”“2.1.2”项条件进行检测。
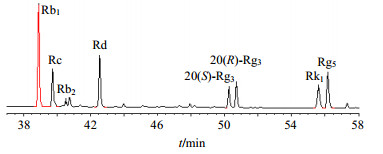
2.2 PPD原料的成分分析为了解PPD中各种皂苷量及其比例,称取4 mg PPD,溶于1 mL色谱纯甲醇中,经HPLC检测,与人参皂苷对照品相比较,结果见图 1。对图 1中的HPLC图谱进行分析,PPD中各种皂苷量见表 1。
|
图 1 原料PPD皂苷HPLC图 Fig.1 HPLC of raw material PPD |
|
|
表 1 原料PPD皂苷的HPLC分析 Table 1 Ginsenoside content of PPD |
从图 1和表 1可以看到,根据其出峰时间,PPD原料中含有Rb1、Rd、Rc、Rb2和4种异构体Rg3组皂苷{即由20(S)-人参皂苷Rg3[20(S)-Rg3]、20(R)-人参皂苷Rg3[20(R)-Rg3]、人参皂苷Rk1(Rk1)、人参皂苷Rg5(Rg5)组成};为了计算方便,将峰面积比视为皂苷量比,根据其峰面积比可知,PPD原料中主要含有30.60%的Rb1、15.94%的Rd、11.87%的Rc、3.22%的Rb2;6.46%的20(S)-Rg3、8.27%的20(R)-Rg3、9.97%的Rk1、13.67%的Rg5。因此原料中Rb1和Rd总量为46.54%;Rg3组量为近38%。
2.3 酶的制备选用产人参皂苷酶Ⅰ型的Aspergillus g.848菌,发酵得到人参皂苷粗酶。在4%麦芽汁中含有1%人参提取液的培养基中,30 ℃搅拌培养5~6 d,离心除菌,加入3倍体积的甲醇,过夜沉淀酶蛋白,离心收集酶蛋白沉淀,溶解于1/10培养液体积的0.02 mol/L、pH 5.0醋酸缓冲溶液,离心除渣,即为酶液。
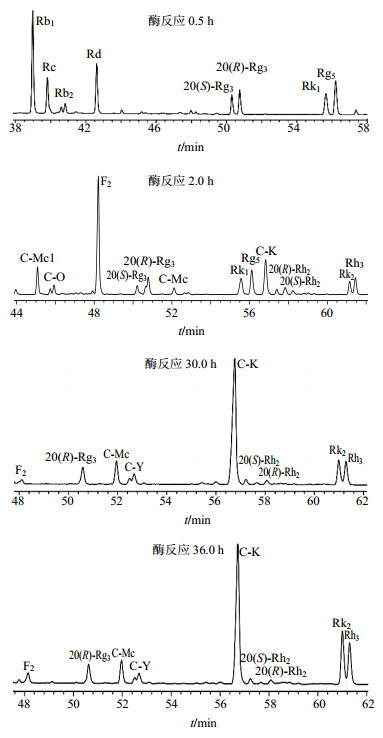
2.4 PPD皂苷酶反应动态以PPD作为酶反应底物,取5 g PPD将其溶于20 mL的甲醇中,并加入80 mL 0.02 mol/L醋酸缓冲溶液(pH 5.0),与等体积的酶液混合,放入45 ℃的摇床中反应。在酶反应过程中,分别在0.5、1.0、1.5、2.0、2.5、3.0、6.0、12.0、24.0、30.0、36.0 h时,取酶反应液1 mL。对每一样品进行萃取、脱糖除杂、蒸干。蒸干后溶于3 mL色谱甲醇中,进行HPLC检测。其中0.5、2.0、30.0、36.0 h的色谱图,如图 2所示。按不同时间0.5、1.0、1.5、2.0、2.5、3.0、6.0、12.0、24.0、30.0、36.0 h,共取11个样品的HPLC色谱图,进行数据分析,见表 2。
|
图 2 酶反应0.5、2.0、30.0、36.0 h时的样品HPLC图 Fig.2 HPLC of reaction product for 0.5, 2.0, 30.0, and 36.0 h in enzyme reaction |
|
|
表 2 PPD中各皂苷在酶反应过程中的动态变化 Table 2 Dynamics of PPD enzymatic conversion |
由图 2和表 2可知,酶先水解Rb1的20-O-末端Glc变成Rd,然后水解Rd的3-O-末端Glc变成F2,继续水解F2的3-O-Glc变成C-K;底物Rb1、Rd在0~1.0 h时皂苷量几乎没有变化,1.5 h时被完全水解生成中间产物F2,在1.5~2.0 h时F2的量为32.50%~35.37%,从2.5 h后F2的量逐渐减少,至6.0 h后F2皂苷量从13.01%逐渐减少到1.45%。
酶先水解Rb2和Rc的3-O-Glc变成C-O和C-Mc1;进一步水解C-O和C-Mc1的3-O-Glc变成C-Y和C-Mc,最终变成C-K。Rb2与酶反应生成中间产物C-O,再逐渐生成C-Y和C-K;底物Rb2在0~1.0 h时皂苷量几乎没变化,1.5 h时被水解生成中间产物C-O,C-O在1.5 h的量为2.62%,随着酶反应时间的增加,C-O的量从2.62%减少到0.85%,C-O在6.0 h后被全部水解成C-Y;在6.0 h时开始有C-Y生成,其皂苷量为3.15%,在酶反应30.0 h时C-Y量最大,其量为4.09%。
Rc与酶反应生成中间产物C-Mc1,再逐渐水解生成C-Mc和C-K;底物Rc在0~1.0 h时皂苷量几乎无变化,在1.5 h时被完全水解生成中间产物C-Mc1,其皂苷量为7.53%,随着酶反应时间的增加,C-Mc1的皂苷量在2.0 h时最大,为7.86%,随后皂苷量逐渐减少,6.0 h后C-Mc1完全被水解成C-Mc;C-Mc在1.5 h时就被水解生成,其量为4.55%;在2.0 h时C-Mc的皂苷量减少到2.21%;在2.0 h后C-Mc的皂苷量逐渐增加,12.0 h时其皂苷量最大,为8.67%;12.0 h后C-Mc的皂苷量逐渐减少。产物C-K在1.5 h时被水解生成,其皂苷量为8.10%,随着酶反应时间的增加,C-K的量在增加,在30.0 h时C-K的皂苷量为57.25%,由于反应时间过长,在36.0 h时C-K的皂苷量减少,会生成少量苷元;如果需要制备稀有皂苷C-K,就在反应进行30.0 h时终止反应。
Rg3组的20(S)-Rg3、20(R)-Rg3、Rk1和Rg5在酶反应过程中分别转化为Rh2组的20(S)-Rh2、20(R)-Rh2、Rk2和Rh3。
20(S)-Rg3随着反应逐渐生成20(S)-Rh2;20(S)-Rg3在0~1.0 h时皂苷量几乎没有变化,在2.0 h后皂苷量逐渐减少,6.0 h后被完全水解;而产物20(S)-Rh2在1.5 h时生成,其皂苷量为1.42%;随着酶反应的增加,20(S)-Rh2的皂苷量缓慢增加。
20(R)-Rg3与酶反应逐渐生成20(R)-Rh2;底物20(R)-Rg3不容易被水解,在酶反应36.0 h,从8%左右降到6.05%;其产物20(R)-Rh2为2.70%。
Rk1与酶反应逐渐生成Rk2;底物Rk1在12.0 h后被完全水解,产物Rk2在1.5 h时开始生成,反应36.0 h时其皂苷量最大,为14.10%。Rg5与酶反应逐渐生成Rh3;底物Rg5在12.0 h后被完全水解,产物Rh3在1.5 h时开始生成,反应36.0 h时其皂苷量最大,为12.90%。反应时间长,可能增加Rh2组转化为苷元组的量。
由此可见,生产C-K为主皂苷时,最佳反应时间为24.0~30.0 h;生产Rh2组为主的皂苷时,反应6.0~12.0 h时Rg3组量低而Rh2组量高;生产以F2为主的皂苷时,最佳反应时间为1.5~2.0 h。
2.5 稀有皂苷的制备生产稀有皂苷C-K为主的皂苷时,将PPD皂苷酶反应进行24.0~30.0 h时,C-K的生成量最多;故酶反应进行30.0 h,生产C-K皂苷。
以PPD作为酶反应底物,取30 g PPD将其溶于60 mL的甲醇中,并加入540 mL 0.02 mol/L醋酸缓冲溶液(pH 5.0),与等体积的酶液混合,45 ℃条件下在反应釜中搅拌反应,反应时间为30.0 h。反应后加入3倍反应液体积的甲醇沉淀酶蛋白,其上清液经AB-8柱脱糖除杂、D-280柱脱色、浓缩,得到20 g含有C-K等皂苷的酶反应产物粗品。经HPLC检测,其产物皂苷量比为57.25%的C-K,2.35%的F2,8.49%的C-Mc,4.09%的C-Y,9.32%的Rk2,8.96%的Rh3,1.94%的20(S)-Rh2,1.16%的20(R)-Rh2,6.31%的20(R)-Rg3(表 2)。
将上述20 g的反应产物与50 g的80~100目硅胶混合(样品胶),装到装有400 g的300~400目硅胶柱的上面,即成硅胶柱。先用纯氯仿通柱,用体积比为氯仿-甲醇(9:1)的洗脱剂洗脱,每瓶收集200 mL,共收集108瓶;经TLC检测,把含有相同皂苷的洗脱液合并,分别浓缩、干燥,得到8种分离物,如表 3所示。表 3中的皂苷,经TLC检测,如图 3所示。
|
|
表 3 硅胶柱分离人参皂苷 Table 3 Separation of ginsenosides by silica gel column |
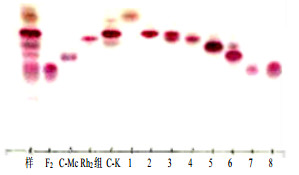
|
样-C-K粗品F2、C-Mc、Rh2组、C-K-人参皂苷对照品1~8-分离得到的表 3的样品号 sample-C-K crude F2, C-Mc, Rh2 group, C-K-ginsenoside reference substance 1—8-the sample numbers of the obtained Table 3 were separated 图 3 硅胶柱分离人参皂苷的TLC图 Fig.3 Ginsenoside TLC from silica gel column |
从表 3和图 3得知,利用硅胶柱分离法,从20 g C-K粗品中,成功地分离得到8.16 g质量分数为95%的C-K单体,1.01 g质量分数为90%的C-Mc单体,0.45 g质量分数为90%的F2单体,0.19 g皂苷量为90%的Rh2组;上述硅胶柱分离得到的皂苷,经HPLC检测,与各皂苷对照品的出峰时间一致,可以认定为C-K、C-Mc、F2和Rh2组皂苷。
C-K、C-Mc、F2单体皂苷,用NMR法核对结构;Rh2组制品,利用UPLC-MS法核对其组成。还得到1.98 g苷元组,其苷元组有待于今后确定。
2.6 酶反应产物C-Mc、F2和C-K的结构核对将C-K、C-Mc、F2单体皂苷,用NMR法核对结构。将样品溶解在Pyridine-d5,用Bruke AVANCE 600 (1H: 600 MHz;13C: 150 MHz)核磁共振仪检测,确认结构。
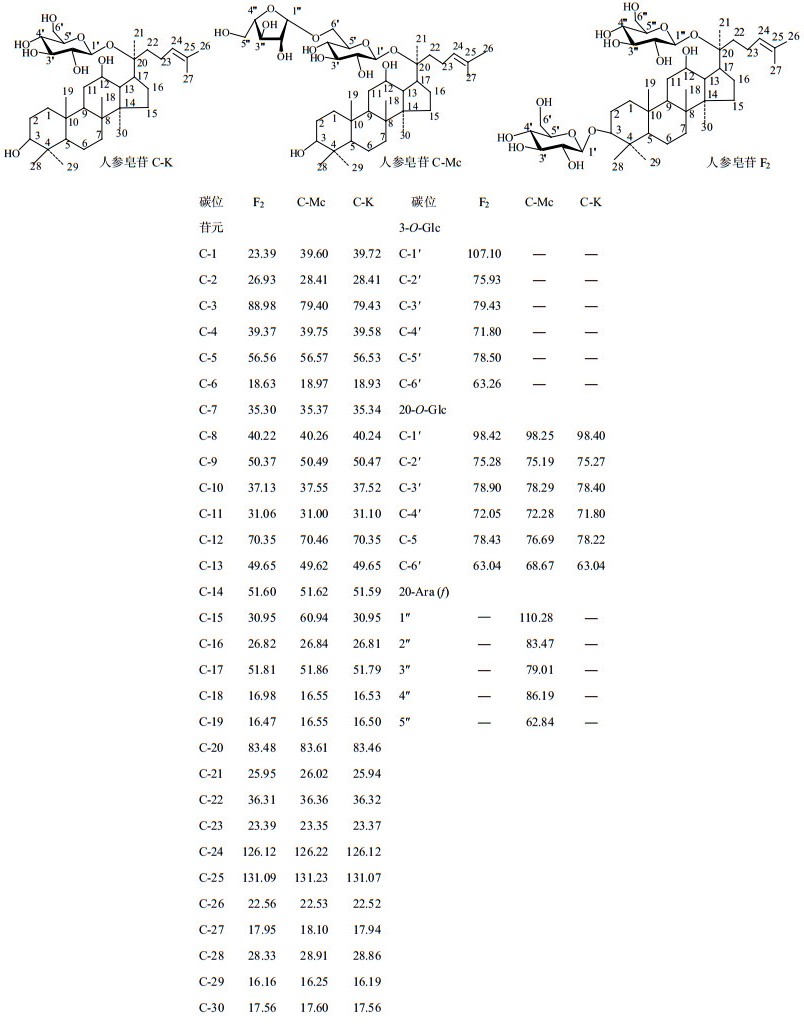
通过对1H-、13C-NMR图谱的分析,与参考文献[21]中人参皂苷核磁数据比对,确认了酶反应产物分离的人参皂苷化学结构,其13C-NMR数据及其结构归属如图 4所示,证明了分离得到的产物为人参皂苷C-K、C-Mc、F2单体;人参皂苷C-Mc结构的系统名称为20-O-[α-L-阿拉伯呋喃糖基-(1→6)-β-D-葡萄糖吡喃糖基]-20(S)-人参二醇苷元;F2皂苷结构的系统名称为3-O-β-D-葡萄糖吡喃糖基-20-O-β-D-葡萄糖吡喃糖基-20(S)-人参二醇苷元;C-K,20-O-β-D-葡萄糖吡喃糖基-20(S)-人参二醇苷元。
|
图 4 酶反应产物F2、C-Mc、C-K结构核磁共振光谱的13C-NMR数据与结构图 Fig.4 13C-NMR spectroscopic data and structures of enzyme reaction products F2, C-Mc, and C-K |
2.7 酶反应产物Rh2组UPLC-MS法[22-25]的确认
UPLC-MS法检测产物Rh2组在UPLC-Q-TOF-MS Premier TM上进行,ESI源,正、负离子模式下,“V”模式下进行检测。
UPLC检测条件:色谱柱为BEH Shield RP18(100 mm×2.1 mm,1.7 μm,Waters);流动相为0.1%甲酸乙腈溶液(A)-0.1%甲酸水溶液(B);梯度洗脱条件:0~5 min,5%~95% A(线性梯度);5~10 min,95% A(等度);进样量10 μL;体积流量0.5 mL/min;柱温30 ℃;检测波长203 nm。
四级杆时间飞行串联质谱(Q-TOF-MS)检测条件:毛细管电压2.5 kV;样品孔电压35 V;离子源温度100 ℃,脱溶剂气温度350 ℃;锥孔气体积流量50 L/h,脱溶剂气体积流量1 000 L/h;质量扫描范围:m/z 100~1 000。
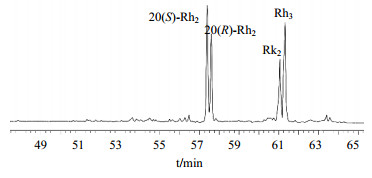
分离得到的酶反应产物Rh2组,经HPLC检测,由20(S)-Rh2、20(R)-Rh2、Rk2、Rh3 4种异构体组成(图 5)。其Rh2组的4种异构体在HPLC中出峰时间,与Rh2组市售产品一致,可以确认为Rh2组皂苷。利用UPLC-MS法进一步确定Rh2组。20(S)-Rh2和20(R)-Rh2的相对分子质量为622,Rk2和Rh3的相对分子质量为604。Rh2组的UPLC图如6图所示。
|
图 5 酶反应产物Rh2组的HPLC图 Fig.5 HPLC of products Rh2 group |
|
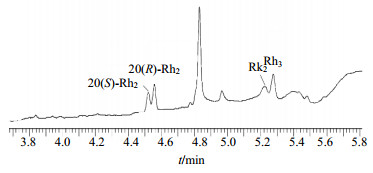
图 6 Rh2组样品的UPLC图谱 Fig.6 UPLC of sample in Rh2 group |
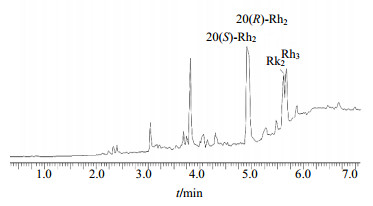
从图 6中可以看出,有4个明显的紫外吸收峰和Rh2组的HPLC检测图谱一致,20(S)-Rh2、20(R)-Rh2、Rk2、Rh3的紫外吸收峰出峰时间依次为4.62、4.66、5.33、5.38 min。其Rh2组通过负离子模式下的串联质谱(Q-TOF)检测,其总离子流图如图 7所示。从图 7中可以看出,总离子流图中的20(S)-Rh2、20(R)-Rh2、Rk2、Rh3的出峰时间依次为4.62、4.71、5.36、5.41 min,与UPLC图谱中各组分的出峰时间相匹配。再通过对总离子流峰进行一级质谱分析,确定样品中各物质的相对分子质量。
|
图 7 ESI−模式下Rh2组样品总离子流图谱 Fig.7 Total ion beam of sample Rh2 group in ESI− mode by MS |
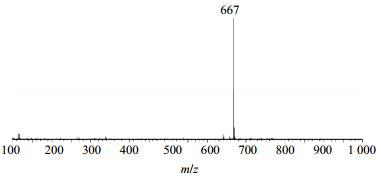
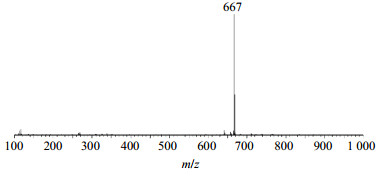
首先对Rh2组人参稀有皂苷中20(S)-Rh2、20(R)-Rh2的离子峰在ESI−模式下进行一级质谱分析,得到的一级质谱如图 8、9所示。从图 8和9中可以看出,Rh2的相对分子质量为622,在ESI−模式下形成[Rh2+HCOOH]−离子峰,而负离子模式下又减少1个H,所以样品Rh2得到的离子峰m/z 667。故可判断,样品中含有20(S)-Rh2和20(R)-Rh2,其相对分子质量为622。
|
图 8 20(S)-Rh2在ESI−模式下的一级质谱图 Fig.8 Level 1 MS of 20(S)-Rh2 in ESI− mode |
|
图 9 20(R)-Rh2在ESI−模式下的一级质谱图 Fig.9 Level 1 MS of 20(R)-Rh2 in ESI− mode |
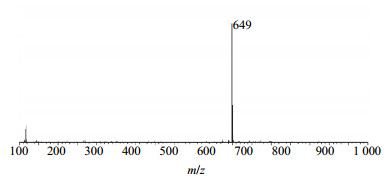
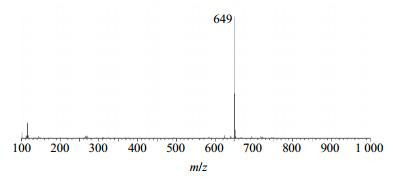
再对Rh2组人参稀有皂苷中Rk2、Rh3的离子峰在ESI−模式下进行一级质谱分析,得到的一级质谱如图 10、11所示。从图 10和11中可以看出,Rk2或Rh3的相对分子质量为604,在ES−模式下形成[Rh2+HCOOH]−离子峰,而负离子模式下又减少1个H,所以Rk2或Rh3得到的离子峰m/z 649。故可判断,样品中含有Rk2和Rh3,其相对分子质量为604。
|
图 10 Rk2在ESI−模式下的一级质谱图 Fig.10 Level 1 MS of Rk2 in ESI− mode |
|
图 11 Rh3在ESI−模式下的一级质谱图 Fig.11 Level 1 MS of Rh3 in ESI− mode |
由此,可以证明酶反应得到的Rh2组是由20(S)-Rh2、20(R)-Rh2、Rk2、Rh3 4种异构体组成。
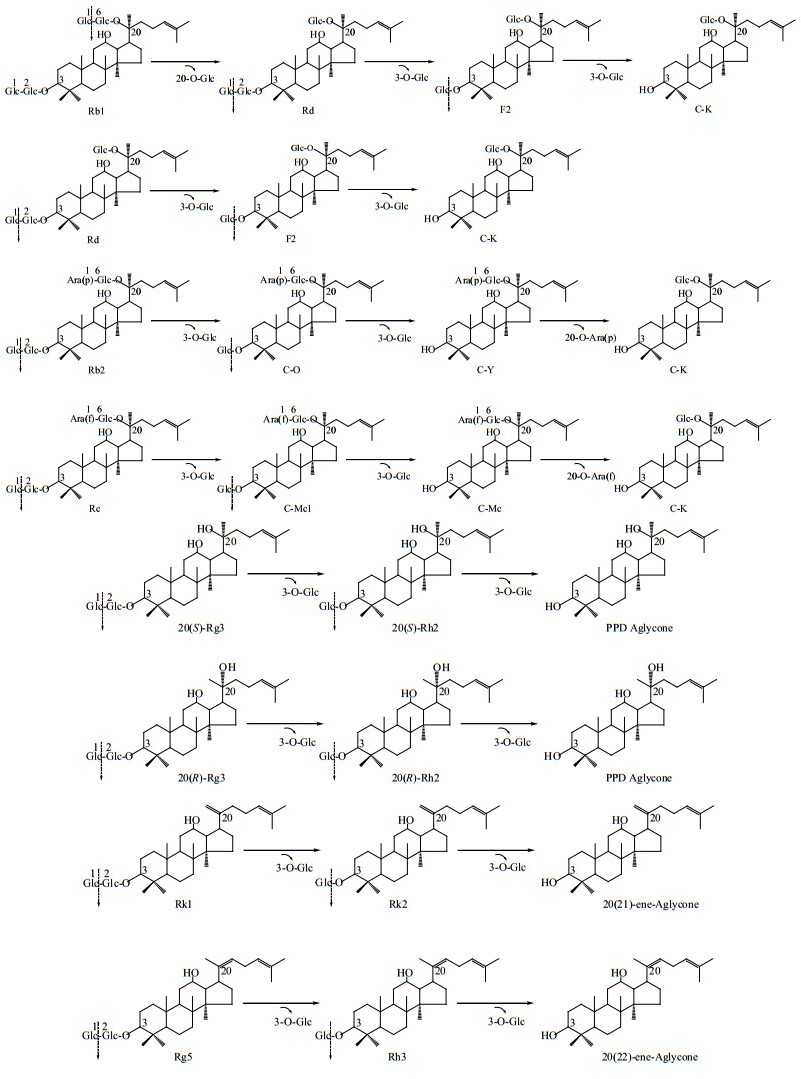
3 讨论PPD原料中主要含有30.60%的Rb1、15.94%的Rd、11.87%的Rc、3.22%的Rb2;还含有6.46%的20(S)-Rg3、8.27%的20(R)-Rg3、9.97%的Rk1、13.67%的Rg5等Rg3组皂苷;与Aspergillus g.848菌所产的人参皂苷粗酶液反应,PPD皂苷转化途径,如图 12所示。但是,酶与Rg3组皂苷反应中所产生的苷元结构,有待于进一步分析确定。
|
图 12 PPD皂苷生物转化途径 Fig.12 Biotransformation pathway of PPD ginsenosides |
酶水解PPD复合皂苷水解动态:
酶水解Rb1时,先水解的20-O-末端Glc变成Rd,然后水解Rd变成F2和C-K;底物Rb1、Rd在1.5 h时被完全水解生成中间产物F2,生成C-K速度快。酶水解Rb2和Rc时,先水解3-O-Glc变成C-O和C-Mc1;进一步水解C-O和C-Mc1的3-O-Glc变成C-Y和C-Mc,最终变成C-K。Rb2和Rc的分解速度快;但是,C-Y和C-Mc变成C-K速度慢。
Rg3组的20(S)-Rg3、20(R)-Rg3、Rk1和Rg5在酶反应过程中分别转化为Rh2组的20(S)-Rh2、20(R)-Rh2、Rk2和Rh3。其中20(S)-Rg3、Rk1和Rg5,分别转化为20(S)-Rh2、Rk2和Rh3速度相对快;但20(R)-Rg3转化速度慢。
由此可见,生产以C-K为主的皂苷时,最佳反应时间为24.0~30.0 h;生产以Rh2组为主的皂苷时,反应6.0~12.0 h时Rg3组产量低而Rh2组产量高;生产以F2为主的皂苷时,最佳反应时间为1.5~2.0 h。
为了从PPD原料皂苷制备高活性皂苷C-K,取30 g PPD皂苷,经酶反应、脱糖脱色、浓缩,得到以C-K为主的等稀有皂苷产物粗干品20 g;经HPLC检测,其产物皂苷量比例为57.25%的C-K、2.35%的F2、8.49%的C-Mc、4.09%的C-Y、9.32%的Rk2、8.96%的Rh3、1.94%的20(S)-Rh2、1.16%的20(R)-Rh2、6.31%的20(R)-Rg3。其稀有皂苷混合物,可直接用于人参制品、化妆品和药物开发,也可以用于分离单体皂苷。
为了得到人参皂苷单体,将其混合皂苷,经硅胶柱分离,最终得到8.16 g的C-K单体,酶反应产物得率为40.80%;Rh2组0.19 g,得率为0.95%;C-Mc单体1.01 g,得率为5.05%;F2单体0.45 g,得率为2.25%。但是,本方法只得到0.19 g Rh2组,得率仅为0.95%;而PPD原料中Rg3组其量为38%,如果酶转化生产Rh2组,有待于今后的研究。
经NMR核对,产物人参皂苷单体是C-K、C-Mc、F2稀有皂苷;经UPLC-MS核对,Rh2组是由20(S)-Rh2、20(R)-Rh2、Rk2、Rh3 4种异构体组成。本研究结果为产业化提供廉价生产人参稀有皂苷C-K、C-Mc、F2和Rh2组的理论方法。
| [1] | 中国药典[S].一部.2015. |
| [2] | 张彩, 史磊. 人参化学成分和药理作用研究进展[J]. 食品与药品, 2016, 18(4):300–304. |
| [3] | 金凤燮. 天然产物生物转化[M]. 北京: 化学工业出版社, 2009. |
| [4] | 张均田. 人参冠百草--人参化学、生物学活性和药代动力学研究进展[M]. 北京: 化学工业出版社, 2008. |
| [5] | Christensen L P.Ginsenosides:Chemistry, Biosynthesis, Analysis, and Potential Health Effects[M/OL].Adv Food Nutrition Res, 2008, 55:1-99.doi:10.1016/S1043-4526(08)00401-4. |
| [6] | 刘春莹, 宋建国, 李鹏飞, 等. 3种人参中的皂苷的组成[J]. 大连工业大学学报, 2011, 30(2):79–82. |
| [7] | Tawab M A, Bahr U, Karas M, et al. Degradation of ginsenosides in humans after oral administration[J]. Drug Metab Dispos, 2003, 31(8): 1065–1071. DOI:10.1124/dmd.31.8.1065 |
| [8] | 周武喜, 杨宁, 赵余庆. 人参皂苷类化合物水溶性提升方法的研究进展[J]. 药物评价研究, 2016, 39(2):322–327. |
| [9] | 刘春莹.酶转化法制备高活性人参稀有皂苷及低聚丹酚酸的研究[D].长春:吉林大学, 2016. |
| [10] | 李永淳, 刘春莹, 鱼红闪, 等. 酶反应产物中人参稀有皂苷F2与C-Mc的分离[J]. 大连工业大学学报, 2014, 33(6):420–422. |
| [11] | 于兆慧, 刘其媛, 崔莉, 等. 微球固定化蜗牛酶转化人参皂苷Rb1制备人参稀有皂苷Compound K研究[J]. 中草药, 2014, 45(21):3092–3097. |
| [12] | 周伟, 周飒. 稀有人参皂苷Compound-K研究进展[J]. 药学学报, 2007, 42(9):917–923. |
| [13] | He D, Sun J, Zhu X, et al. Compound K increases type I procollagen level and decreases matrix metalloproteinase-1 activity and level in ultraviolet-A-irradiated fibroblasts[J]. Formos Med Assoc, 2011, 110(3): 153–160. DOI:10.1016/S0929-6646(11)60025-9 |
| [14] | 于兆慧.人参稀有皂苷Compound K的酶法制备及其混合胶束的研究[D].南京:南京中医药大学, 2015. |
| [15] | Yu H, Zhang C, Lu M, et al. Purification and characterization of new special ginsenosidase hydrolyzing multi-glycisides of protopanaxadiol ginsenosides, ginsenosidase type I[J]. Chem Pharm Bull, 2007, 55(2): 231–235. DOI:10.1248/cpb.55.231 |
| [16] | Yu H, Liu Q, Zhang C, et al. A new ginsenosidase from Aspergillus strain hydrolyzing 20-O-multi-glycoside of PPD ginsenoside[J]. Process Biochem, 2009, 44(7): 772–775. DOI:10.1016/j.procbio.2009.02.005 |
| [17] | Jin F X, Yu H S, Wang D M, et al. Kinetics of a cloned special ginsenosidase hydrolyzing 3-O-glucoside of multi-protopanaxadiol-type ginsenosides, named ginsenosidase type Ⅲ[J]. J Microbiol Biotechnol, 2012, 22(3): 343–351. DOI:10.4014/jmb |
| [18] | Wang D M, Yu H S, Song J G, et al. A novel ginsenosidase from an Aspergillus strain hydrolyzing 6-O-multi-glycosides of protopanaxatriol-type ginsenosides, named ginsenosidase type IV[J]. J Microbiol Biotechnol, 2011, 21(10): 1057–1063. DOI:10.4014/jmb |
| [19] | Liu C Y, Zhou R X, Sun C K, et al. Preparation of minor ginsenosides C-Mc, C-Y, F2, and C-K from American ginseng PPD-ginsenoside using special ginsenosidase type-I from Aspergillus niger g.848[J]. J Ginseng Res, 2014, 58(3): 221–229. |
| [20] | 李翠翠, 刘廷强, 王颖, 等. 酶转化人参皂苷C-K的提取工艺[J]. 大连工业大学学报, 2009, 28(2):87–89. |
| [21] | Tanaka O, Kasai R.Saponins of ginseng and related plants[A]//Fujita E, Johne S, Kasai R, et al.Fortschritte der Chemie organischer Naturstoffe/Progress in the Chemistry of Organic Natural Products[M].Springer Vienna, 1984, 46:1-76. |
| [22] | 张建锋, 刘文, 侯晓杰, 等. 戊己丸UPLC-MS/MS指纹图谱研究[J]. 中草药, 2016, 47(11):1897–1902. |
| [23] | 张莹.新人参二醇的血浆药代动力学研究与初步安全性评价[D].长春:吉林大学, 2012. |
| [24] | 任中楠.西洋参中人参皂苷标准物质的研制及皂苷类成分的UPLC-MS法快速测定[D].北京:北京化工大学, 2011. |
| [25] | 李瑞宏, 房桂珍, 安娜, 等. UPLC-MS/MS方法同时测定百咳宁颗粒中6种主要有效成分[J]. 中草药, 2016, 47(1):76–80. |
 2017, Vol. 48
2017, Vol. 48


