2. 北京大学医学部 天然药物及仿生药物国家重点实验室, 北京 100191;
3. 广东世信药业有限公司, 广东 揭阳 515500
2. State Key Laboratory of Natural and Biomimetic Drugs, Peking University Health Science Center, Beijing 100191, China;
3. Guangdong Sencee Pharmaceutical Co., Ltd., Jieyang 515500, China
马甲子Paliurus ramosissimus (Lour.) Poir.系鼠李科(Rhamnaceae)马甲子属Paliurus Tourn ex Mill.的多年生木本植物,又名白棘、铁篱笆、铜钱树等,多产于广东、江西、湖北等地。其味苦,性平,归心、肺经,通常以根、茎和叶入药,具有祛风利湿、散瘀止血等功效,临床多用于治疗咽喉痛、风湿痹痛、劳伤出血、痈疮溃疡、跌打损伤等症[1-4]。已有研究报道,马甲子主要含有三萜类、环肽生物碱类以及黄酮类等多种化学成分[5-8],具有多种生物活性,包括抗肿瘤、抗氧化、抗炎等[9-13]。国内外有关马甲子的化学成分及药理活性的研究报道较少,为了寻找有活性的天然产物,进一步扩大马甲子的药用资源,本实验对马甲子干燥地上部分进行了化学成分的系统研究,从95%乙醇水提物的醋酸乙酯萃取部分分离得到了6个三萜类化合物,分别鉴定为22β, 24-羟基-A (1)-去甲-2, 20(29)-羽扇豆二烯-27, 28-二羧酸[22β, 24-hydroxy-A (1)-nor-2, 20(29)-lupindien-27, 28-dicarboxylic acid,1]、大枣烯酸(zizyberenalic acid,2)、3-O-原儿茶酰美洲茶酸(3-O-protocatechuoylceanothic acid,3)、美洲茶三酸(ceanothetric acid,4)、2-O-咖啡酰麦珠子酸(2-O-caffeoylalphitolic acid,5)、3-O-咖啡酰麦珠子酸(3-O-caffeoylalphitolic acid,6)。其中,化合物1为新化合物,命名为马甲子酸A,化合物2~6为首次从该植物中分离得到,且首次提供化合物3的完整核磁数据。所有化合物的结构见图 1。
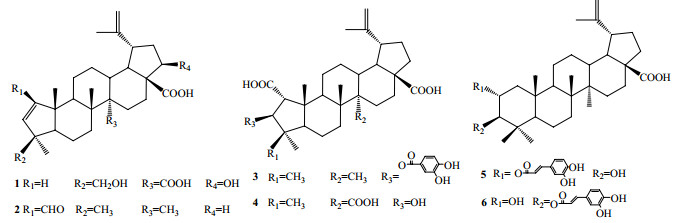
|
图 1 化合物1~6的结构 Fig.1 Chemical structures of compounds 1-6 |
1 仪器与材料
LabAlliance分析型高效液相色谱仪(天津兰博实验仪器设备有限公司);Waters 2487半制备型高效液相色谱仪(Waters,美国);AVANCE Ⅲ 400型核磁共振波谱仪(Bruker,德国);Nicolet Nexus 470红外光谱仪(Thermo,美国);SQD低分辨质谱仪[沃特世科技(上海)有限公司];TOF/TOF 5800高分辨质谱仪(AB SCIEX,新加坡);柱色谱硅胶(青岛海洋化工厂);ODS反相柱色谱硅胶(DAISO Co. Ltd,日本);YMC C18半制备色谱柱(300 mm×10 mm,5 μm,YMC Co.,Ltd.,日本);三氯甲烷、甲醇、石油醚、醋酸乙酯均为分析纯,购自于北京化工厂。
马甲子于2013年3月购自于中国广东省揭阳市,由北京大学医学部付宏征教授鉴定为Paliurus ramosissimus (Lour.) Poir.。植物样品保存于北京大学天然药物及仿生药物国家重点实验室。
2 提取与分离取马甲子干燥地上部分41 kg,用95%乙醇水回流提取3次,合并提取液,减压浓缩回收乙醇,得到马甲子乙醇提取物。将乙醇提取物分散于甲醇中,用等体积的石油醚萃取4次,减压浓缩甲醇层至干,再用适量的水分散,用等体积水饱和后的醋酸乙酯萃取4次,得到醋酸乙酯部分(1.6 kg)。
醋酸乙酯部分经硅胶柱色谱,三氯甲烷-甲醇(100:0→0:100)梯度洗脱,共得到7个流分Fr. 1~Fr. 7。Fr. 1经硅胶柱色谱,石油醚-醋酸乙酯(40:1→1:1)梯度洗脱,再经Sephadex LH-20柱,以三氯甲烷-甲醇(1:1)洗脱,通过HPLC制备得到化合物2(22 mg)。Fr. 3经硅胶柱色谱,石油醚-醋酸乙酯(3:1→1:1)梯度洗脱,得到3个流分Fr. 3.1~3.3。Fr. 3.2经Sephadex LH-20柱、ODS柱反复纯化分别得到化合物3(7 mg)、4(10 mg)、5(17 mg)、6(30 mg)。Fr. 3.3经Sephadex LH-20柱反复纯化后,经HPLC制备得到化合物1(10 mg)。
3 结构鉴定化合物1:淡黄色粉末。[α]D23 +7.2° (c 1.0, MeOH),HR-ESI-MS给出分子离子峰为m/z: 485.291 2 [M-H]−,结合1H-NMR和13C-NMR谱推断出化合物1的分子式为C29H42O6。IR vmaxKBr(cm−1): 3 433, 1 706和1 642分别提示结构中存在羟基、羰基和双键。分析13C-NMR及DEPT谱可知,该化合物结构中存在29个碳原子,包括8个季碳(C)、8个次甲基(CH)、9个亚甲基(CH2)、4个甲基(CH3)。
在1H-NMR (400 MHz, pyridine-d5)谱中,高场区显示有4个单峰甲基质子信号δ 1.09 (3H, s), 1.23 (3H, s), 1.26 (3H, s), 2.17 (3H, s);低场区显示有2个末端亚甲基质子信号δ 5.11 (1H, d, J=2.2 Hz), 4.84 (1H, m);2个烯质子信号δ 6.23 (1H, d, J=5.8 Hz), 5.78 (1H, d, J=5.8 Hz)。在13C-NMR (100 MHz, pyridine-d5)谱中,显示有4个甲基碳信号δ 24.6, 20.9, 19.1, 18.5;2个连氧碳信号δ 75.5, 66.3;2个羧基碳信号δC 179.0, 178.5。化合物1具体的1H-1H COSY和HMBC相关见图 2。
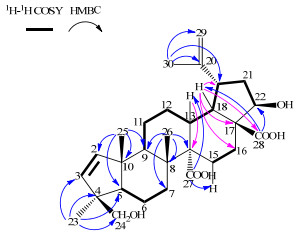
|
图 2 化合物1的1H-1H COSY和HMBC相关 Fig.2 1H-1H COSY and HMBC correlations of compound 1 |
在NOESY谱(图 3)中,H-25 (δ 1.09)分别与H-26 (δ 1.23)、H-24 (δ3.94, 3.74)有NOE相关,H-23 (δ 1.26)与H-5 (δ 1.66)有NOE相关,H-26 (δ 1.23)与H-13 (δ 3.18)有NOE相关,H-13 (δ 3.18)与H-19 (δ 3.81)有NOE相关,H-22 (δ 4.84)与H-18 (δ 3.04)有NOE相关,由1H-和13C-NMR谱核磁数据(表 1),并结合文献报道[14],根据五环三萜类化合物的生物合成途径关系以及波谱特征,确定了化合物1的立体结构。综上所述,化合物1鉴定为22β, 24-二羟基-A (1)-去甲-2, 20(29)-羽扇豆二烯-27, 28-二羧酸,为1个新化合物,命名为马甲子酸A。
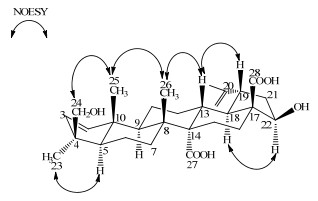
|
图 3 化合物1的NOESY相关 Fig.3 NOESY correlations of compound 1 |
|
|
表 1 化合物1的1H-NMR和13C-NMR数据(400/100 MHz, pyridine-d5) Table 1 1H-NMR and 13C-NMR spectral data of compound 1 (400/100 MHz, pyridine-d5) |
化合物2:白色粉末。HR-ESI-MS m/z: 451.321 5 [M-H]−,分子式为C30H44O3;1H-NMR (400 MHz, pyridine-d5)δ: 9.82 (1H, s, H-2), 6.49 (1H, s, H-3), 4.88 (1H, brs, H-29a), 4.72 (1H, brs, H-29b), 3.48 (1H, m, H-19), 1.75 (3H, s, H-30), 1.09 (3H, s, H-25), 1.05 (6H, s, H-23, 26), 0.97 (3H, s, H-27), 0.84 (3H, s, H-24);13C-NMR (100 MHz, pyridine-d5) δ: 157.7 (C-1), 191.2 (C-2), 163.7 (C-3), 43.7 (C-4), 63.4 (C-5), 17.0 (C-6), 35.4 (C-7), 43.3 (C-8), 47.9 (C-9), 52.4 (C-10), 24.6 (C-11), 25.7 (C-12), 38.4 (C-13), 42.9 (C-14), 30.4 (C-15), 33.0 (C-16), 55.9 (C-17), 49.8 (C-18), 47.7 (C-19), 151.1 (C-20), 31.2 (C-21), 37.6 (C-22), 28.1(C-23), 20.4 (C-24), 19.3 (C-25), 18.0 (C-26), 14.8 (C-27), 178.6 (C-28), 110.0 (C-29), 19.4 (C-30)。结合文献报道[15],鉴定化合物2为大枣烯酸。
化合物3:淡黄色粉末。[α]D26-21.0 (c 0.2, MeOH),HR-ESI-MS给出分子离子峰为m/z: 621.343 4 [M-H]−,结合1H-NMR和13C-NMR谱推断化合物3的分子式为C37H50O8。IR vmaxKBr(cm−1): 3 399, 1 705和1 642分别提示结构中存在羟基、羰基和双键。在1H-NMR (400 MHz, CD3OD)谱中,高场区显示有6个单峰甲基质子信号δ 0.99 (3H, s), 1.03 (6H, s), 1.18 (3H, s), 1.25 (3H, s), 1.71 (3H, s);在低场区δ 5.28 (1H, brs)和2.65 (1H, brs)分别为C-3和C-1位的质子信号,δ 4.72 (1H, brs), 4.60 (1H, brs)为C-29位的烯质子信号,δ 7.44 (1H, brs), 7.42 (1H, brd, J=8.3 Hz), 6.83 (1H, d, J=8.3 Hz)分别为C-2′、C-6′和C-5′的芳质子信号。在13C-NMR (100 MHz, CD3OD)谱中,δ 180.0、177.4和167.8分别为C-28、C-2和C-7′位的羰基碳信号,δ 110.2和151.8分别为C-29和C-20位的烯碳信号,δ 122.7、117.3、146.3、152.0、116.0、123.6分别为C-1′、C-2′、C-3′、C-4′、C-5′和C-6′位的6个芳香碳信号,δ 87.0为C-3位的连氧叔碳信号。
通过碳氢之间1H-1H COSY和HMBC二维谱(图 4),并结合文献报道[16],将化合物3鉴定为3-O-原儿茶酰美洲茶酸。已有文献报道[17]化合物3全甲基化衍生物的结构,但未报道此化合物,本实验首次得到其完整的核磁数据,见表 2。
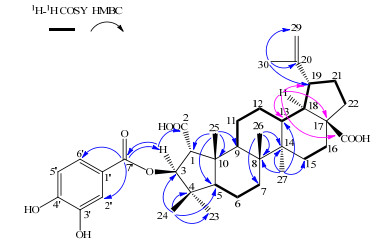
|
图 4 化合物3的1H-1H COSY和HMBC相关 Fig.4 1H-1H COSY and HMBC correlations of compound 3 |
|
|
表 2 化合物3的1H-NMR和13C-NMR数据(400/100 MHz, CD3OD) Table 2 1H-NMR and 13C-NMR spectral data of compound 3 (400/100 MHz, CD3OD) |
化合物4:白色粉末。ESI-MS m/z: 515.36 [M-H]−,分子式为C30H44O7;1H-NMR (400 MHz, pyridine-d5) δ: 4.99 (1H, brs, H-29a), 4.66 (1H, brs, H-29b), 4.80 (1H, brs, H-3), 3.24 (1H, brs, H-1), 1.81 (3H, s, H-30), 1.44 (3H, s, H-25), 1.27 (6H, s, H-23, 26), 1.23 (3H, s, H-24);13C-NMR (100 MHz, pyridine-d5) δ: 67.1 (C-1), 178.8 (C-2), 84.6 (C-3), 43.7 (C-4), 57.1 (C-5), 19.1 (C-6), 37.7 (C-7), 41.6 (C-8), 46.1 (C-9), 50.1 (C-10), 24.3 (C-11), 27.0 (C-12), 40.5 (C-13), 60.3 (C-14), 29.5 (C-15), 35.4 (C-16), 56.6 (C-17), 52.3 (C-18), 47.8 (C-19), 151.0 (C-20), 31.2 (C-21), 37.7 (C-22), 31.4 (C-23), 20.3 (C-24), 19.4 (C-25), 18.1 (C-26), 178.5 (C-27), 179.3 (C-28), 110.1 (C-29), 19.4 (C-30)。结合文献报道[18],鉴定化合物4为美洲茶三酸。
化合物5:白色粉末。ESI-MS m/z: 633.48 [M-H]−,分子式为C39H54O7;1H-NMR (400 MHz, pyridine-d5) δ: 8.02 (1H, d, J=15.8 Hz, H-3′), 7.54 (1H, m, H-5″), 7.21 (1H, m, H-2″), 7.12 (1H, brd, J=8.1 Hz, H-6″), 6.60 (1H, d, J=15.8 Hz, H-2′), 5.60 (1H, ddd, J=10.6, 10.6, 4.6 Hz, H-2), 4.94 (1H, brs, H-29a), 4.79 (1H, brs, H-29b), 3.60 (1H, d, J=10.6 Hz, H-3), 3.52 (1H, m, H-19), 1.79 (3H, s, H-30), 1.26 (3H, s, H-23), 1.07 (3H, s, H-25), 1.06 (3H, s, H-27), 1.01 (3H, s, H-26), 0.97 (3H, s, H-24);13C-NMR (100 MHz, pyridine-d5)δ: 45.0 (C-1), 73.7 (C-2), 79.8 (C-3), 40.4 (C-4), 55.7 (C-5), 18.7 (C-6), 34.7 (C-7), 41.1 (C-8), 50.8 (C-9), 38.6 (C-10), 21.3 (C-11), 26.0 (C-12), 38.7 (C-13), 42.9 (C-14), 30.2 (C-15), 32.9 (C-16), 56.5 (C-17), 49.8 (C-18), 47.7 (C-19), 151.3 (C-20), 31.1 (C-21), 37.6 (C-22), 29.1 (C-23), 17.39 (C-24), 17.36 (C-25), 16.3 (C-26), 14.9 (C-27), 178.8 (C-28), 110.0 (C-29), 19.4 (C-30), 167.5 (C-1′), 115.7 (C-2′), 145.3 (C-3′), 127.0 (C-1″), 116.7 (C-2″), 147.7 (C-3″), 150.3 (C-4″), 115.9 (C-5″), 121.9 (C-6″)。结合文献报道[19],鉴定化合物5为2-O-咖啡酰麦珠子酸。
化合物6:白色粉末。ESI-MS m/z: 633.48 [M-H]−,分子式为C39H54O7;1H-NMR (400 MHz, pyridine-d5) δ: 7.99 (1H, d, J=15.8 Hz, H-3′), 7.54 (1H, m, H-2″), 7.18 (1H, m, H-5″), 7.12 (1H, brd, J=8.0 Hz, H-6″), 6.64 (1H, d, J=15.8 Hz, H-2′), 5.20 (1H, d, J=9.8 Hz, H-3), 4.92 (1H, brs, H-29a), 4.75 (1H, brs, H-29b), 4.25 (1H, dt, J=9.8, 9.8, 4.4 Hz, H-2), 1.77 (3H, s, H-30);13C-NMR (100 MHz, pyridine-d5) δ: 48.8 (C-1), 66.5 (C-2), 84.9 (C-3), 39.7 (C-4), 55.6 (C-5), 17.9 (C-6), 34.6 (C-7), 41.1 (C-8), 50.8 (C-9), 38.5 (C-10), 21.3 (C-11), 26.0 (C-12), 38.5 (C-13), 42.8 (C-14), 31.2 (C-15), 32.8 (C-16), 56.6 (C-17), 47.7 (C-18), 49.7 (C-19), 151.2 (C-20), 30.2 (C-21), 37.5 (C-22), 28.8 (C-23), 16.3 (C-24), 18.0 (C-25), 17.5 (C-26), 14.9 (C-27), 178.8 (C-28), 110.0 (C-29), 19.4 (C-30), 167.9 (C-1′), 115.9 (C-2′), 145.4 (C-3′), 127.0 (C-1″), 115.8 (C-2″), 147.6 (C-3″), 146.5 (C-4″), 116.6 (C-5″), 121.8 (C-6″)。结合文献报道[20],鉴定化合物6为3-O-咖啡酰麦珠子酸。
| [1] | 广西卫生局主编. 广西本草[M]. 南宁: 广西人民出版社, 1974. |
| [2] | 韦国锋, 覃道光, 黄志文. 马甲子镇咳祛痰作用及其化学成分的提取分离[J]. 右江民族医学院学报, 1998(2):176–177. |
| [3] | 朱华, 张可锋, 高雅, 等. 马甲子的生药学研究[J]. 广西中医药, 2008, 31(1):56–57. |
| [4] | 南京中医药大学. 中药大辞典[M]. 上海: 上海科学技术出版社, 2016. |
| [5] | Lee S S, Su W C, Liu K C. Two new triterpene glucosides from Paliurus ramosissimus[J]. J Nat Prod, 1991, 54(2): 615–620. DOI:10.1021/np50074a047 |
| [6] | Lee S S, Su W C, Liu K C, et al. Cyclopenptide alkaloids from stems of Paliurus ramosissimus[J]. Phytochemistry, 2001, 58(8): 1271–1276. DOI:10.1016/S0031-9422(01)00234-5 |
| [7] | Lin H Y, Chen C H, Liu K C, et al. 14-Membered cyclopeptides from Paliurus ramosissimus and P.hemsleyanus[J]. Helv Chim Acta, 2003, 86(1): 127–138. DOI:10.1002/(ISSN)1522-2675 |
| [8] | Danica K, Zeljan M, Adelheid B, et al. Flavonoids of the leaves of Christsthom (Paliurus spinachristi Mill[J]. Acta Pharm Jugosl, 1990, 40(4): 551–557. |
| [9] | 高媛, 宋联强, 樊梅, 等. 马甲子叶提取物的抗肿瘤活性研究[J]. 华西药学杂志, 2015, 30(3):303–305. |
| [10] | 徐超群.一种具有抗肿瘤活性的中药提取物及其制备方法和用途:中国, CN 103550323A[P].2014-02-05. |
| [11] | 徐超群.一种具有抗肿瘤活性的中药提取物及其制备方法和用途:中国, CN 103735653A[P].2014-04-23. |
| [12] | 赵玉丹, 李双君, 张桃, 等. 马甲子果水提物中几类物质含量的测定和DPPH·活性的清除[J]. 广州化工, 2015, 43(23):156–158. |
| [13] | 徐超群.一种治疗口腔及消化道炎症或/和溃疡的马甲子提取物及制剂和应用:中国, CN 103800466A[P].2014-05-21. |
| [14] | Giacomelli S R, Maldaner G, Stucker C, et al. Triterpenoids from Gouania ulmifolia[J]. Planta Med, 2007, 73(5): 499–501. DOI:10.1055/s-2007-967166 |
| [15] | Lee S S, Shy S N, Liu K C S. Triterpenes from Paliurus hemsleyanus[J]. Phytochemistry, 1997, 46(3): 549–554. DOI:10.1016/S0031-9422(97)00313-0 |
| [16] | Suksamrarn S, Panseeta P, Kunchanawatta S, et al. Ceanothane-and lupane-type triterpenes with antiplasmodial and antimycobacterial activities from Ziziphus cambodiana[J]. Chem Pharm Bull, 2006, 54(4): 535–537. DOI:10.1248/cpb.54.535 |
| [17] | Lee S S, Lin B F, Liu K C S. Three triterpene esters from Zizyphus jujuba[J]. Phytochemistry, 1996, 43(4): 847–851. DOI:10.1016/0031-9422(96)00379-2 |
| [18] | Yoshikawa K, Kimura Y, Kondo E, et al. A lupane-triterpene and a 3(2→1) abeolupane glucoside from Hovenia trichocarea[J]. Phytochemistry, 1998, 49(7): 2057–2060. DOI:10.1016/S0031-9422(98)00409-9 |
| [19] | Shao Z Y, Zhu D Y. Two new triterpene esters from Daphniphyllum oldhami[J]. Chin Chem Lett, 2002, 13(12): 1181–1184. |
| [20] | 李万华, 李琴, 栗巧云, 等. 皂角刺中5个白桦脂酸型三萜的分离及抗菌[J]. 西北大学学报:自然科学版, 2008, 38(6):937–942. |
 2017, Vol. 48
2017, Vol. 48


