2. 天津药物研究院, 天津 300193
2. Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China
黄精为百合科(Liliaceae)黄精属Polygonatum Mill.多年生草本植物,全球有60余种,主要分布于北温带和北亚热带,我国有31种,广泛分布于除南方热带以外的广大地区[1]。《中国药典》2015年版记载黄精为滇黄精P. kingianum Coll. et Hemsl.、黄精P. sibiricum Red.或多花黄精P. cyrtonema Hua的干燥根茎;甘、平;归脾、肺、肾经;具有补气养阴、健脾、润肺、益肾的作用;用于脾胃气虚、体倦乏力、胃阴不足、口干食少、肺虚燥咳、劳嗽咳血、精血不足、腰膝酸软等。黄精在抗衰老、调节免疫力、调血脂、改善记忆力、抗肿瘤、抗菌等方面显示出潜在的药用价值[2-3]。黄精是中国传统的中药材,在民间又是一种使用面非常广的药食同源植物,尤以安徽省九华山区域地藏黄精(多花黄精)应用最优。随着对黄精药理作用、化学成分及临床研究的逐步深入,黄精属植物的活性部位及有效成分的研究也为新药研究开发所重视。本文对黄精资源、化学成分、主要药理活性进行综述。在此基础上,比较黄精、滇黄精和多花黄精中的主要化学成分的差异性,建议开展黄精质量标准和质量标志物研究,选择质优的黄精进行黄精多糖、甾体皂苷和异黄酮类化合物的定性、定量分析,为定量标准的制定提供科学数据。
1 资源分布黄精主产于河北、北京、内蒙古、陕西等省区;多花黄精主产于安徽、贵州、湖南、浙江等省;滇黄精主产于贵州、云南、广西等省区。姜形黄精的原植物为多花黄精,鸡头黄精的原植物为黄精,而大黄精(又名碟形黄精)的原植物为滇黄精。三者中以姜形黄精质量最佳。
2 化学成分黄精含有多种化学成分,主要包括多糖、甾体皂苷、三萜、生物碱、木脂素、黄酮、植物甾醇及挥发油等,其中多糖和甾体皂苷类成分在黄精中量较大,为其主要药效成分。
2.1 甾体皂苷甾体皂苷类是黄精属植物的特征性成分,也是主要活性成分之一,黄精中的甾体皂苷主要有薯蓣皂苷元、毛地黄糖苷、菝葜皂苷元等[4],但黄精皂苷的量较低,陈立娜等[5]采用HPLC测定黄精薯蓣皂苷元的量,发现质量分数仅在0.01%~0.05%,酸水解前后均含有薯蓣皂苷元。黄精中含有多种甾体皂苷类成分[6],目前对该类成分的文献报道多集中于黄精和滇黄精,多花黄精中也含有大量的甾体皂苷类成分[7-8],前体苷元多为螺甾烷醇型和异螺甾烷醇型,其他苷元均是由这2种类型衍生而来[9],其结构骨架见图 1。从滇黄精和黄精中分离得到20多种甾体皂苷单体化合物[9-10],如呋喃甾烷类皂苷(黄精皂苷A,sibiricoside A)、螺旋甾烷类皂苷(黄精皂苷B,sibiricosde B),以及新巴拉次薯蓣皂苷元A-3-O-β-石蒜四糖苷及其甲基原型同系物。张洁[11]从滇黄精中分离并鉴定出10种新的化学成分滇黄精E、(25S)-滇黄精苷E[(25S)-kinginaoside E]、(25S)-滇黄精苷C [(25S)-kinginaoside C]、(25S)-滇黄精苷D[(25S)-kinginaoside D]、(25R, 22)-羟基-弯蕊开口箭苷C [(25R, 22)-hydroxyrlwattinoside C]、(25S)-滇黄精苷F [(25S)-kinginaoside F]、(25S)-滇黄精苷G[(25S)-kinginaoside G]、(25S)-pratioside D1、(25S)-5-烯-螺甾-12-酮、(25S)-滇黄精苷A [(25S)-kinginaoside A],另发现其含有滇黄精苷C、D(kinginaoside C、D);从黄精根茎中分离得到4个新的甾体皂苷类化合物新西伯利亚蓼苷A~D(neosibiricoside A~D)及2个已知的甾体皂苷类化合物PO-2、PO-3。此外,从卷叶黄精Polygonatum cirrhifolium (Wall.) Royle中分离得到非洲龙血树皂苷和薯蓣皂苷、薯蓣皂苷元[12]。Yu等[13]从多花黄精中分离到2个新的甾体皂苷类化合物滇黄精苷J、K(kinginaoside J、K)和一个已知的甾体皂苷类化合物daucosterol。目前共从黄精、滇黄精和多花黄精中分离得到75种甾体皂苷类化合物,按照苷元的骨架类型不同可分为16种(图 1)。黄精皂苷常见的糖基有葡萄糖、半乳糖、鼠李糖、阿拉伯糖、木糖和岩藻糖(图 2)。目前从黄精、滇黄精和多花黄精中确定的75个甾体皂苷类化合物见表 1。其中黄精有34个化合物,滇黄精有32个化合物,多花黄精有9个化合物。
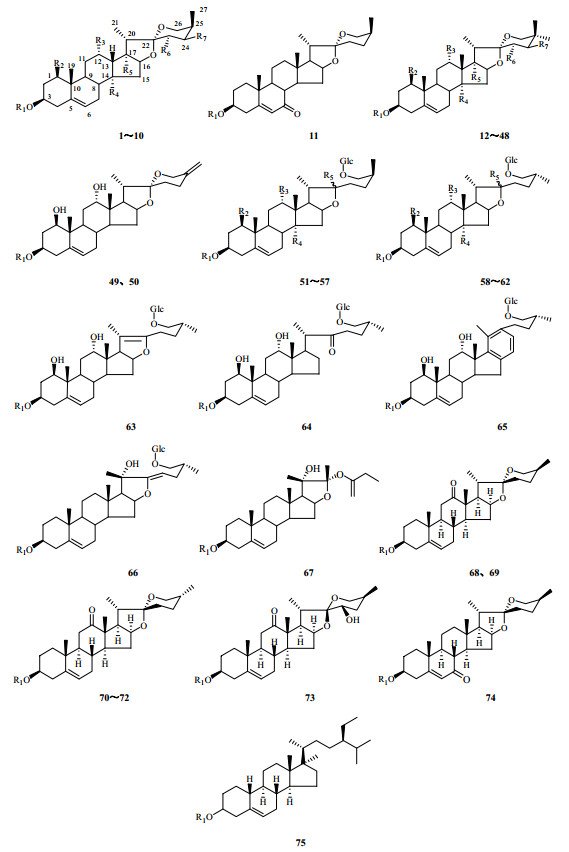
|
图 1 黄精、滇黄精和多花黄精中甾体皂苷元的结构骨架 Fig.1 Structural skeletons of steroid sapogenin in P. sibiricum, P. kingianum, and P. cyrtomema |
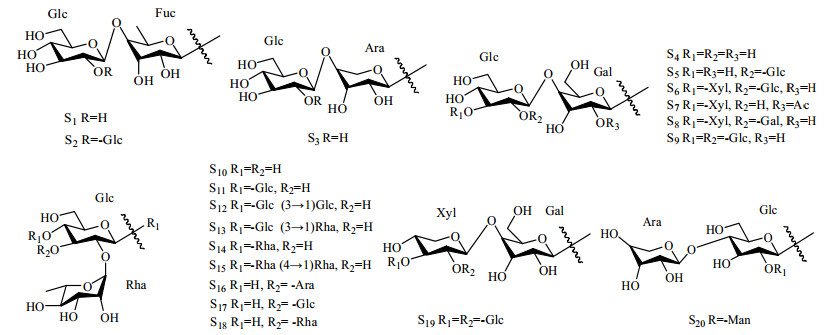
|
图 2 黄精、滇黄精和多花黄精中甾体皂苷的主要糖基类型 Fig.2 Sugar moity skeletons of steroid sapogenin in P. sibiricum, P. kingianum, and P. cyrtomema |
|
|
表 1 黄精、滇黄精和多花黄精中甾体皂苷类化合物 Table 1 Steroid sapogenin in P. sibiricum, P. kingianum, and P. cyrtomema |
2.2 三萜皂苷类
目前从黄精和滇黄精中共分离得到12个三萜皂苷类化学成分,分别为2个乌苏酸型五环三萜皂苷积雪草苷和羟基积雪草苷[14],7个齐墩果烷型五环三萜皂苷3β-羟基-(3→1)-葡萄糖-(4→1)-葡萄糖-齐墩果烷、3β-羟基-(3→1)-葡萄糖-(4→1)-葡萄糖-齐墩果酸、3β-羟基-(3→1)-葡萄糖-(4→1)-葡萄糖-(28→1)-阿拉伯糖-(2→1)-阿拉伯糖-齐墩果酸等[15],3个达玛烷型四环三萜皂苷伪人参皂苷F11[16]、人参皂苷Rc[17]和人参皂苷Rb1[13]。
2.3 黄酮类和蒽醌类黄精的另一种特征性成分是高异黄酮类,即母核结构比异黄酮多1个碳原子,自然界发现的较少,仅在少数植物中含有。目前从滇黄精、黄精和多花黄精中分离得到该类成分有4个,即为高异黄酮4′, 5, 7-三羟基-6, 8-二甲基高异黄酮[16]、disporopsin[18]和(3R)-5, 7-dihydroxy-8-methyl-3-(2′-hydroxy-4′-methoxy-benzyl)-chroman-4-one[19]、2, 4, 5, 7-四羟基-高异黄酮(2, 4, 5, 7-tetrallydorxy-homoisoflvanaone)[11];还分离得到了2个二氢黄酮新甘草苷[20]和甘草素[21],2个查耳酮异甘草素[20]和新异甘草苷[21],4个异黄酮类4′, 7-二羟基-3′-甲氧基异黄酮[21]、2′, 7-二羟基-3′, 4′-二甲氧基异黄烷、2′, 7-二羟基-3′, 4′-二甲氧基异黄烷苷[20]、鸢尾苷[22],以及(6aR, 11aR)-10-羟基-3, 9-二甲氧基紫檀烷[20]。多花黄精叶中含有牡荆素木糖苷和5, 4′-二羟基黄酮苷;其根茎中含有吖啶-2-羧酸、毛地黄精苷以及多种蒽醌类化合物[23]。Chopin等[24]从多花黄精新鲜叶子中首次分离得到2个碳苷类黄酮:8-C-芹菜素吡喃半乳糖苷及6-C-吡喃半乳糖8-C-芹菜素吡喃阿拉伯糖苷,同时从该植物还得到6-O-β-D-glucosylrhaminoside-5, 7, 4′-trihydoxyflavone和6-O-β-D-glucosylrhaminoside-7-O-glucoside-5, 4′-dihydoxyflvaone。高颖等[25]从新鲜黄精中分离鉴定出大豆脑苷II、芹菜素-7-O-β-D-葡萄糖苷、山柰酚、杨梅素、(6R, 9R)-长寿花糖苷、鹅掌楸苷。Nakata等[26]从日本黄精P. falcatum中分离得到1种金黄色的色素polygonaquinone。Huang等[27]从短筒黄精P. altelobatum的根茎分离到2个新的1, 4-苯醌同系物黄精醌A和B。
2.4 生物碱类黄精属植物中所含生物碱量较低,目前发现种类较少,从滇黄精和黄精中共分离得到5个生物碱类化合物,主要为吲哚嗪类生物碱,分别为polygonatine A、polygonatine B[28]、kinganone[29]、N-trans-p-coumaroyloctopamine[21]和腺苷[30],从滇黄精中分离得到3-丁氧甲基-5, 6, 7, 8-四氢-8-吲哚哩嗪酮[31]。
2.5 木脂素类从黄精中分离鉴定出4个木脂素类化合物[10],分别为右旋丁香脂素、右旋丁香脂素-O-β-D-吡喃葡萄糖苷和右旋松脂醇-O-β-D-吡喃葡萄糖基-(6→1)-β-D-吡喃葡萄糖苷,另分离出1种混合物,该混合物为几种黄精神经鞘苷混合物,其中该同系物母核部分化学结构中,酚羟基的存在可能使得黄精中的木脂素类成分具有更强的生物活性,而从其他属植物中分离到的木脂素类化合物多具有强毒性[10]。
2.6 植物甾醇类从黄精和滇黄精中发现2个甾醇类化合物(22S)-cholest-5-ene-1, 3, 16, 22-tetrol-1-O-α-L-rhamnopyranosyl-16-O-β-D-glucopyranoside[32]、棕榈酸-3β-谷甾醇[21]。从黄精、滇黄精、卷叶黄精[33-34]中均鉴定出胡萝卜苷[20-21]、β-谷甾醇[20-21]。
2.7 多糖类王晓丹等[35]采用改进的硫酸-苯酚法,比较了泰山、安徽、浙江的黄精多糖的量,结果表明泰山黄精多糖量最高。黄精中的多糖成分量为4.47%~21.34%,从黄精中分离得到3种由葡萄糖和果糖组成的低聚糖[36]及2个中性多糖PSW-1a和PSW1b-2[37],还从黄精中分离得到多糖PSPI[38]和3个由葡萄糖、甘露糖和半乳糖醛酸(6:26:1)组成的多糖类成分PKP Ⅰ~Ⅲ[39]。另外从多花黄精中分离得到由葡萄糖、半乳糖组成的黄精多糖PCPs-1、PCPs-2、PCPs-3[40],研究表明不同产地的黄精多糖的量有差异,安徽九华山黄精多糖量高达17.79%,贵州产为13.19%,湖南产仅为8.25%[41]。
2.8 挥发油采用水蒸气蒸馏法结合气相色谱与质谱联用分析法从黄精中提取并鉴定出的挥发性成分约有51种,其中包括酸类(26.32%)、烯烃(25.83%)、醛类(5.83%)、醇类(1.09%)和酯类(0.66%)成分;从多花黄精中鉴定出11种挥发性成分,主要包括芳香烃(28.69%)、烯烃(23.25%)、醛类(10.09%)和烷烃(8.99%)[42]。余红等[43]采用水蒸气蒸馏法提取采自安徽九华山地区多花黄精的挥发油,利用气相色谱-质谱联用技术对其化学成分进行了分析,共鉴定出16个化合物,占总挥发油的95.97%。
2.9 氨基酸和金属元素黄精中含有多种氨基酸,其中游离氨基酸中苏氨酸和丙氨酸较为丰富[44],另外还含有赖氨酸、谷氨酸、亮氨酸、异亮氨酸、甘氨酸、酪氨酸、脯氨酸等[45]。多花黄精中含有天门冬氨酸、高丝氨酸和二氨基丁酸等氨基酸。黄精根茎中未检出胱氨酸、半胱氨酸、鸟氨酸等氨基酸[36]。
2.10 其他类从黄精中分离得到正丁基-β-D-吡喃果糖苷、正丁基-β-D-呋喃果糖苷、正丁基-α-D-呋喃果糖苷、4-羟甲基糠醛和水杨酸[21]。另外黄精还含有Fe、Zn、Sr等18种微量元素及K、Mg、P等常量元素[46]。
3 药理作用 3.1 抗氧化和抗衰老作用公惠玲等[47]研究表明黄精多糖在剂量为0.5、1 g/kg时可明显提高模型组小鼠血清和肝脏总超氧化物歧化酶(T-SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性,降低丙二醛(MDA)的量。刘中申等[48]实验证明黄精会使小鼠肝脏中SOD活性明显提高(P<0.01),减轻自由基及其代谢产物对机体的损伤,减少因自由基反应所引起的脂类过氧化而对生物膜结构功能造成损害。陈淑清[49]实验证明黄精水煎剂能使小鼠心肌和脑组织中乳酸脱氢酶活性明显提高。王爱梅等[50]实验证明黄精可以减少衰老小鼠脑组织中MDA的产生,从而减少脑组织中氧自由基的产生,增强清除氧自由基的能力,提高机体抗氧化的能力,并能明显提高脑细胞Na+, K+-ATP酶及Ca2+-ATP酶的活性,防止细胞内Ca2+超载从而起到抗衰老的作用。赵红霞等[51]研究表明黄精多糖对老龄大鼠醋酸α-萘酯酯酶(ANAE)染色活性淋巴细胞百分率,红细胞、晶体核、晶体皮质SOD活性,心脏过氧化脂质(LPO)量和脑中B型单胺氧化酶(MAO-B)活性均有明显改善作用。李超彦等[52]采用顺铂致肝损伤模型,发现黄精多糖各剂量组(10、20、40 mg/kg)均可降低模型动物血清丙氨酸转氨酶(ALT)活性及MDA量,同时使天冬氨酸转氨酶(AST)、SOD及GSH-Px活性显著升高。
有研究[53]表明人类端粒酶逆转录蛋白的成功重组显示端粒酶和端粒缩短与细胞衰老存在着密切的联系。李友元等[54]通过实验动物模型,探讨衰老小鼠组织端粒酶活性表达的变化及黄精多糖对端粒表达的干预作用,结果表明黄精多糖在抗衰老方面有着独特的作用。赵红霞等[55]研究表明黄精多糖是一种良好的抗衰老剂。陈金水等[56]实验表明小鼠ig黄精口服液显示具有抗衰老作用。此外,黄精粗多糖可显著降低由溴苯所致肝损伤小鼠肝组织中MDA量,并增加小鼠肝组织中GSH-Px量,且呈剂量依赖关系[57]。
夏晓凯等[58]研究了黄精多糖的体外抗氧化作用,黄精能抑制自发的和诱导的脂质过氧化产物MDA的生成,对氧自由基具有直接清除作用。研究表明,黄精多糖可使脂多糖所致人脐静脉内皮细胞SOD水平显著增加,MDA水平明显降低,提示黄精多糖可通过抗氧化作用减轻内皮细胞损伤,保护脂多糖所致人脐静脉内皮细胞损伤[59-60]。黄精多糖能增强小鼠脑组织抗氧化能力,影响其自由基的代谢[61-62]。
黄精提取物对大强度耐力训练大鼠心肌线粒体抗氧化能力以及ATP酶活性的影响研究发现,黄精提取物可以提高大鼠Mn-SOD、GSH-Px、CAT活性,降低MDA和H2O2的量,说明其对消除运动产生的自由基和提高机体的抗氧化能力有积极的作用;黄精提取物能提高大强度耐力训练大鼠心肌线粒体内Na+-ATPase和Ca2+-ATPase的活性,提示其具有线粒体保护作用。证明了黄精具有抗自由基氧化、阻止膜的脂质过氧化和保护心肌线粒体结构完整的作用[63]。
黄精多糖可以降低阴虚模型小鼠血浆中的cAMP量及cAMP/cGMP值,表明黄精多糖具有明显的滋阴抗衰老作用[64-65]。
3.2 抑制老年痴呆和改善学习记忆研究[66-67]发现经黄精多糖干预后的痴呆小鼠海马CA1区线粒体密度增加,线粒体变形程度减轻,提示其具有防治老年痴呆的作用。黄精多糖同样能明显改善APP转基因小鼠模型核固缩现象,降低β-淀粉样蛋白(Aβ)沉积所产生的神经毒作用。给血管性痴呆模型大鼠以10%黄精口服液持续给药,结果表明黄精口服液具有重塑突触结构与功能,改善血管性痴呆大鼠学习记忆能力的作用[68-69]。黄芳等[70]研究表明,黄精多糖能显著改善老龄大鼠学习记忆及记忆再现能力,降低错误次数。
孙隆儒等[71]采用跳台法和避暗法对黄精改善学习记忆的作用进行了研究,结果黄精的乙醇提取物(1.0 g/kg)对东莨菪碱所致小鼠记忆获得障碍有明显改善作用,当质量浓度为0.25 g/kg时也可以使小鼠避暗错误次数明显减少;黄精总皂苷(0.4 g/kg)对东莨菪碱所致小鼠记忆获得障碍有明显改善作用。
3.3 降血糖作用Xie等[72]以α-葡萄糖苷酶为靶标,实验表明黄精多糖对α-葡萄糖苷酶具有很强的抑制作用。高英等[73]认为黄精多糖降血糖作用可能是通过抑制α-葡萄糖苷酶的活性实现的。
陈兴荣等[74]研究发现滇黄精提取物对外源性葡萄糖所致高血糖小鼠血糖水平有一定降低作用,显著降低四氧嘧啶性糖尿病小鼠的血糖水平。冯桂玲等[75]研究发现在黄精多糖作用下葡萄糖苷酶活性受到显著抑制,黄精乙醇提取物及其水煎剂可显著降低高脂血症大鼠的血清总胆固醇及三酰甘油水平。李友元等[76]研究发现黄精多糖可显著降低实验性糖尿病鼠血糖和血清糖化血红蛋白浓度,并能显著升高血浆胰岛素及C肽水平。公惠玲等[77]研究表明黄精多糖能够降低链脲佐菌素诱导的糖尿病大鼠血糖,提高胰岛素表达,其机制可能与其抑制胰岛素细胞凋亡、下调caspase-3表达有关。沃兴德等[78]研究表明黄精浸膏或甲醇提取物对正常小鼠、兔以及由链脲霉素诱发血糖升高的小鼠和兔均有降血糖作用。王建新[79]以链脲佐菌素(STZ)致糖尿病小鼠模型为研究对象,结果黄精能明显降低其血糖含量及血清中TC、TG的量。
张炜[80]研究表明黄精多糖能降低糖尿病大鼠的血糖水平,减轻多饮多尿症状,增加大鼠体质量,改善肾脏肥大指数和尿微量白蛋白(mAlb)、血肌酐(SCr)、尿素氮(BUN)水平,黄精多糖还可改善糖尿病肾病症状,保护肾脏。实验证实[81-82]黄精水提液通过增强II型糖尿病胰岛素抵抗大鼠GLUT基因表达,而起到降低血糖的作用。吴粲荣等[83]通过实验证实,黄精多糖可以有效调节老年糖尿病小鼠脑组织糖基化终产物受体(RAGE)mRNA表达,进而提示其具有降低血糖的作用。
3.4 抗动脉粥样硬化作用张庭廷等[84]通过实验证实黄精多糖可降低小鼠血中总胆固醇(TC)、三酰甘油(TG)量,对实验性高脂血症小鼠具有明显的预防和治疗作用。张融瑞[85]研究表明,黄精水煎剂和乙醇提取物拌和饲料饲喂高脂血症大鼠,能显著降低其血清总胆固醇及三酰甘油的量。李友元等[86-91]研究发现黄精多糖能下调实验性兔动脉粥样硬化血管内膜血管细胞黏附分子-1(VCAM-1)的高表达,抑制炎性细胞对内皮细胞的黏附,阻止血管内皮炎症反应的发生、发展。研究表明黄精多糖可以明显地降低动脉粥样硬化家兔血清白细胞介素-6和C-反应蛋白的水平,提示其通过有效地阻止血管内皮炎症反应的发生、发展,而发挥抗动脉粥样硬化的作用。
3.5 扩张血管作用傅晓骏等[92]观察发现中药制黄精水煎剂可降低慢性肾衰小鼠血清中血管内皮素(ET)、血管紧张素Ⅰ(AT-Ⅰ)和血管紧张素Ⅱ(AT-Ⅱ)的量,抑制血管收缩,降低血管阻力,增加肾血管有效血流量。研究表明黄精多糖能降低运动下小鼠脑组织中诱导型一氧化氮合酶(iNOS)活性[93],并提高内皮型一氧化氮合酶(eNOS)活性,从而改善毛细血管张力,增强了血管血流量。黄精能增强心肌收缩力,扩张冠脉,增加冠脉血流量[94]。
3.6 对神经系统的作用胡国柱等[95]研究发现缺氧前加入黄精多糖PSP可以通过上调缺氧神经细胞Bcl-2表达、下调Bax表达和提高Bcl-2/Bax值以避免缺氧的神经细胞凋亡。陈娟等[96]研究发现黄精多糖能明显改善帕金森病(PD)模型大鼠向左侧的旋转行为,并能促进黑质纹状体多巴胺(DA)神经元再生。文珠等[97]研究发现不同浓度的黄精多糖对体外培养的缺氧性神经细胞发挥着不同的作用。
3.7 抗抑郁作用研究[98-100]发现黄精皂苷(100、200、400 mg/kg)能纠正抑郁模型小鼠的自主活动和学习记忆能力。黄精多糖可以改善慢性应激抑郁模型小鼠的抑郁行为,提高脑内5-羟色胺(5-HT)水平。徐维平等[101]研究证明黄精总皂苷能明显升高抑郁模型大鼠胸腺、脾脏指数及血清免疫球蛋白(IgA、IgG、IgM)和IL-2的量,可增强慢性应激抑郁模型大鼠的免疫功能。
3.8 抗骨质疏松作用Zeng等[102]研究发现黄精多糖能够上调大鼠骨形成蛋白(BMP)和碱性成纤维细胞生长因子(bFGF)的表达,并能抑制骨钙素(BGP)、骨碱性磷酸酶(BALP)、酸性磷酸酶(TRAP)和肿瘤坏死因子-α(TNF-α)的表达,具有预防骨质疏松症的作用。采用骨髓间充质干细胞骨向分化细胞为模型,发现在分化过程中黄精多糖诱导组的碱胜磷酸酶(ALP)、BGP分泌显著增加,抑制骨髓间充质干细胞的增殖,促进其分化,缓解骨质疏松症状,还能降低骨质疏松性骨折大鼠白细胞介素-1(IL-1)和白细胞介素-6(IL-6)的表达,促进大鼠骨折的愈合[103-108]。
3.9 免疫调节作用王红玲等[109]采用花环实验法对哮喘儿童进行红细胞C3b受体花环率及免疫复合物(IC)花环率检测。实验表明黄精多糖直接作用于红细胞,增强红细胞膜C3b受体活性,使红细胞免疫黏附功能增强,并且呈现量效关系。傅圣斌等[110]ip环磷酰胺建立小鼠免疫抑制模型,测定低剂量、高剂量黄精多糖对模型小鼠的免疫器官质量、血清溶血素和腹腔巨噬细胞吞噬功能的影响。黄精多糖显著提高腹腔巨噬细胞吞噬率和吞噬指数,可明显改善环磷酰胺致免疫抑制小鼠的免疫功能。
薄芯等[111]和朱模波等[112]发现黄精可提高受环磷酞胺处理小鼠的骨髓造血机能,使白细胞和红细胞数上升、骨髓嗜多染红细胞微核率下降,提高巨噬细胞的功能。
3.10 强心作用Hirai等[113]研究证实黄精的甲醇提取物具有强心作用,可增加大鼠左心房的压力,同时又能够有效抑制cAMP的活性,其强心作用是通过激活交感神经而刺激β-肾上腺素受体而引起的。许苏旸[114]研究证实对一次性大强度跑台运动引起心肌微小损伤的运动员进行研究,发现口服黄精多糖肠溶胶丸(1 g/d)可显著抑制糖原磷酸化酶的增加,降低血浆内皮素水平,提示黄精多糖有减轻心肌微结构损伤、调节心脏内分泌的作用。有研究发现0.15%黄精醇制剂可使离体蟾蛛心脏收缩力增强,但对心率无明显影响,而0.4%黄精液则使离体兔心心率加快[115]。有泽宗久[116]研究显示黄精甲醇冷浸物的氯仿萃取部分能较强地抑制血管紧张素转化酶的活性而具有降压作用。
3.11 抗菌和抗病毒作用研究表明,黄精对多种细菌和真菌均具有抑制作用。黄骏[117]发现黄精醇提取水溶液(质量分数>2%)对多种真菌具有抑制作用,如堇色毛癣菌、红色表皮癣菌等,其水抽出物对石膏样毛癣菌和考夫曼-沃尔夫氏表皮癣菌有抑制作用。苏伟等[118]研究表明黄精对抗酸杆菌及致病性皮肤真菌有抑制作用,以黄精为主治疗由皮肤真菌所致手、足癣,甲癣,白癣等多种癣症,疗效显著。胡骄阳等[119]发现多花黄精石油醚提取物在质量浓度为5.0 g/L时对苹果炭疽病菌的菌丝抑制率达到70%以上。郑春艳等[120]发现黄精多糖对大多数细菌、放线菌和单细胞真菌均具有明显的抑制作用。邵春源[121]研究发现黄精煎液(1:30)对伤寒杆菌、金黄色葡萄球菌、结核杆菌、耐酸杆菌等有抑制作用。吕小迅等[122]发现黄精对多种病原微生物均有抑制作用,黄精水提液在体外对伤寒杆菌、金黄色葡萄球菌有较强的抑制作用,对多种致病真菌亦有抑制作用。汪滢等[123]从多花黄精中分离得到一株其抗菌活性的菌株zjqy610,其发酵液醋酸乙酯粗提物能强烈抑制多种供试植物病原真菌,如灰葡萄孢、西瓜炭疽病菌、泻根亚隔孢壳及核盘菌。
李凯[124]研究表明0.8%黄精多糖滴眼液治疗单纯疱疹病毒性角膜炎具有较好的临床疗效,并推测其机制为增强免疫和多靶点抗病毒的综合作用。段华等[125]从黄精中分别提取到2种小分子粗多糖(PD、PP),用离子交换、凝胶色谱提纯得到这两种粗多糖的纯化产物(RPD、RPP),用吡啶-氯磺酸法分别制取到这两种粗多糖的硫酸酯衍生物(PDS、RPS)。结果表明PD、RPD均有一定的抗病毒活性,PDS、PPS的抗病毒活性与PD、RPD相比有显著性差异,其最低抗病毒有效浓度比PD、RPD低10倍。
3.12 抗肿瘤作用孙晓娟等[126]研究表明黄精多糖给药48 h后,体外人食管癌Eca-109细胞、人胃癌HGC-27细胞、人直肠癌HCT-8细胞S期百分比率显著升高,提示肿瘤细胞可能被阻滞于S期而加速凋亡。体外实验结果[127]表明黄精多糖对人宫颈癌HeLa细胞、人乳腺癌MDA-MB-435细胞、人白血病HL-60细胞及人肺癌H14细胞,均具有显著的抑制作用。
张锋等[128]发现黄精多糖PSP能够促进正常小鼠、S180荷瘤小鼠、亚硝基肌(MNNG)诱癌大鼠脾细胞产生整合素连接激酶(ILK),增强天然杀伤细胞(NKC)与细胞溶解性T淋巴细胞(CTL)活性。黄精凝集素具有一定的抗肿瘤活性,黄精的抗肿瘤作用主要是通过2种途径:一是活性氧介导的p38-p53途径,这一途径能诱导癌细胞程序化死亡;另一途径是线粒体膜诱导的细胞自吞噬作用,这2种途径关系非常复杂,共同发挥作用[9, 129]。
3.13 其他作用黄精多糖还具有治疗家兔干眼症结膜的作用,且疗效优于无环鸟苷[130-131]。俞之杰[132]体外实验显示黄精可以增强纤溶酶的活性,促进纤维蛋白的溶解。
4 质量标志物的预测分析黄精为多基原药材,且所含化学成分复杂多样。《中国药典》2015年版仅规定了黄精多糖的含量限度,其测定方法的专属性不强,仅以多糖为质量控制指标,难以反映黄精的质量特点。中药质量标志物是存在于中药材和中药产品(饮片、中药煎剂、中药提取物、中成药制剂等)中固有的或加工制备过程中形成的、与中药的功能属性密切相关的化学物质,作为反映中药安全性和有效性的标示性物质进行质量控制[133-137]。因此,通过文献分析,对质量标志物进行预测,有利于建立黄精药材科学的质量控制方法。
4.1 基于原植物亲缘学及化学成分特有性证据的质量标志物预测分析[9]黄精来源于百合科黄精属多种植物,黄精属Polygonatum Mill.全世界60余种,广布于北温带,主要分布于东喜马拉雅至横断山脉地区。我国有31种,占世界种类的2/3左右,有许多特有种,是该属植物的分布中心和分化中心。黄精属在“属”一级上的分类特征比较清晰,与同“科”和同“族”的近缘类群均容易区分,是公认的比较自然的属。因此,属内各成员之间的亲缘关系和演化路线相对较为清晰。该属分为2个组,即Sect. Polygonatum和Sect. Verticillata。前者包括苞叶系、互叶系和短筒系;后者包括独花系、点花系、对叶系、滇黄精系和轮叶系。
黄精含有多种化学成分,包括多糖、甾体皂苷、三萜、生物碱、木脂素、黄酮、植物甾醇等,其中多糖和甾体皂苷类成分在黄精中的量较大,为其主要药效成分。
甾体皂苷也是百合科植物的重要化学标志物(chemical marker)。甾体皂苷是黄精属植物的主要次生代谢产物,也是该属药用植物的主要生理活性物质。迄今已从该属植物中分离得到100余种甾体皂苷类成分,黄精属植物中螺甾烷型甾体皂苷通常在C-3位羟基上连接糖链,为单糖链配糖体(monodesmoside)。呋喃甾烷型通常还在C-26位羟基上配糖化,形成双糖链配糖体(bisdesmoside)。呋喃甾烷型配糖体是与其对应的螺甾烷型皂苷生物合成的前体。黄精属植物C-27甾体皂苷具有分子多样性,甾体皂苷元随氧化程度不同,形成多样的结构,迄今发现的黄精属植物甾体皂苷元分子的氧化程度最高为五级氧化水平(图 3)。在不同的氧化水平上,通过不同位置的氧化反应,形成了若干多氧取代的化合物,构成了黄精属植物甾体皂苷元丰富的分子多样性。而甾体皂苷元的氧化水平以及糖链结构的多样化还是分子进化的标志,多羟基C-27甾体皂苷元从低氧化水平到高氧化水平的分子进化,不仅构成了丰富的分子多样性,而且与植物的亲缘关系和系统演化显示相关性,为黄精属植物的种系演化和分类系统提供了重要的信息。按生源途径和分子进化的规律,处于一级氧化水平的薯蓣皂苷元和约莫皂苷元是黄精属植物甾体皂苷分子进化的前体,在该属中是比较原始的次生代谢产物,薯蓣皂苷元的配糖体是黄精属植物的共有成分。因此,通过对黄精属植物的种系演化、亲缘关系以及皂苷类成分的差异和特有性分析,可作为质量标志物确定的重要证据和可行路径。
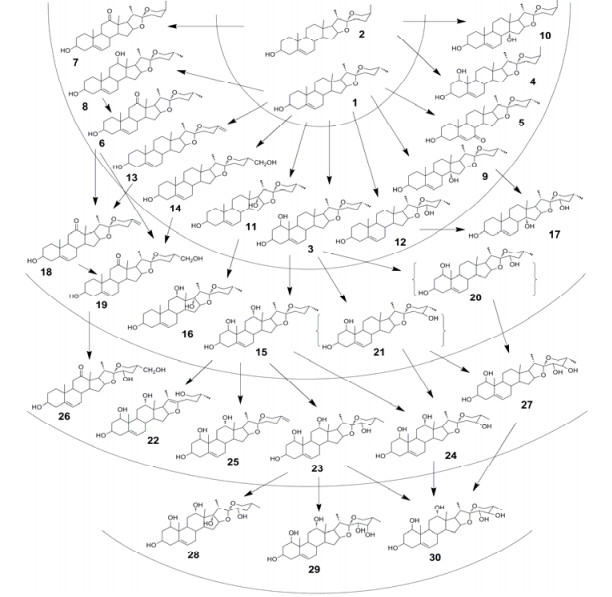
|
图 3 黄精属植物中甾体皂苷元的氧化水平与可能的生物合成途径 Fig.3 Oxidation level and possible biosynthesis pathway of steroidal sapogenins in genus Polygonatum |
《中国药典》2015年版收载滇黄精P. kingianum、黄精P. sibiricum或多花黄精P. cyrtonema 3种植物作为中药黄精的原植物。其中,多花黄精隶属互叶系,该系约11种,主产于我国华东至东北,个别种类分布到西南地区,是国产黄精属的主要类群之一。多花黄精主要甾体皂苷均为薯蓣皂苷元的配糖体。仅有少数微量皂苷的苷元具C-1或C-14羟基取代,属二级氧化水平。互叶系甾体皂苷的C-3位糖链基本为典型的四糖基糖链,末端有时为葡萄糖基,有时则为三糖基糖链。个别化合物在C-1位上配糖化。按分子进化的规律,与其他系的甾体皂苷成分比较,互叶系应为黄精属中比较原始的类群。
滇黄精系仅有滇黄精一种。滇黄精的甾体皂苷元以C-1或C-12位氧化为特征。糖基部分为三糖或二糖的糖链,有时内侧为岩藻糖基。结合该植物仅见于我国西南部的地理分布格局,提示以二级氧化水平为特征的、单一种的滇黄精系应是黄精属中比较原始而特化的类型。
黄精隶属轮叶系,该系约11个种,也是国产黄精属的主要类群之一。轮叶系的甾体皂苷表现出较显著的分子多样性。黄精的甾体皂苷元氧化取代频繁,属于高氧化水平及其过渡类型,并出现双糖链的甾体配糖体。同时,内侧糖基的类型增多,除D-半乳吡喃糖基外,还有以L-岩藻吡喃糖基和L-阿拉伯吡喃糖基,以及结构更加稳定的D-吡喃葡萄糖基。显然,轮叶系应是黄精属中比较进化的类群。
综上分析,皂苷类成分的差异和特有性分析,可作为黄精质量标志物确定的重要证据和可行路径。
4.2 基于化学成分与有效性相关证据的质量标志物预测分析质量标志物是评价和控制中药有效性的主要指标,因此必须与有效性密切相关。通过文献分析发现黄精含有多糖、甾体皂苷、三萜、生物碱、木脂素、黄酮、植物甾醇及挥发油等多种成分,按照质量标志物的定义和要求,可从以下3方面与有效性进行相关分析,已进一步确定质量标志物。
4.2.1 成分与传统功效的相关性传统功效(功能主治)是中药有效性的概括,也是临床用药的依据。黄精始载于《名医别录》,《中国药典》2015年版收载黄精具有补气养阴、健脾、润肺、益肾的作用,用于脾胃气虚、体倦乏力、胃阴不足、口干食少、肺虚燥咳、劳嗽咳血、精血不足、腰膝酸软等。黄精多糖具有广泛的抗氧化、抗衰老、保肝、增强免疫功能和改善记忆等作用;黄精总皂苷具有改善记忆、抗衰老和调节免疫的作用。与黄精的传统功效一致,以上两类成分是黄精传统功效的主要药效物质基础,也应是质量标志物的主要选择。
4.2.2 成分与传统药性的相关性中药的性味归经是中药的基本属性,也是临症治法、遣药组方的重要依据,因此,也应作为质量标志物确定的依据之一。黄精性味甘、平,归脾、肺、肾经。根据中药药性理论,“甘味”的物质基础首先应具有甘味的味觉特征;同时,还应具有“甘味”的功能属性。有报道对常用中药的化学成分进行分析发现,甘味药的化学成分多以糖类、蛋白质、氨基酸类为主;现代化学研究表明,糖类、皂苷、脂肪、维生素、蛋白质、甾醇及氨基酸等是甘味中药甘味的主要来源。根据以上分析,黄精中的多糖类和甾体皂苷类成分应是其“性味”的主要物质基础,也应是质量标志物的主要选择。
4.2.3 成分与新的药效用途的相关性黄精常用于治疗糖尿病的复方药物中,如以黄精为主要原料的降糖甲片、参精止渴丸(降糖丸)、渴乐宁胶囊等中成药用于治疗气阴两虚型糖尿病。研究发现黄精多糖可改善糖脂代谢,具有降血糖作用,是治疗糖尿病的药效物质基础,也应是质量标志物的主要选择。
4.3 基于化学成分可测性的质量标志物预测分析化学成分的可测性也是质量标志物确定的重要依据。多糖和甾体皂苷类成分是黄精质量标志物的主要选择。多糖类成分结构复杂,分离纯化和结构鉴定难度大,不同基原黄精多糖结构特异性研究报道很少,不同多糖与活性相关性的构-效关系不清,且目前缺少特异性、专属性的定量测定方法。《中国药典》2015年版已规定了黄精多糖的测定方法和限度要求。黄精口服后甾体皂苷类成分大多被水解成次级苷或苷元吸收入血发挥生物效应,因此,可将总皂苷、不同类型的苷元或特征性甾体皂苷成分作为质量控制指标。甾体皂苷结构中不具共轭体系,无紫外吸收,紫外区末端测定条件苛刻,可考虑蒸发光散射检测器。
综合分析,黄精中的多糖和皂苷类成分与其有效性密切相关,是其可能的主要药效物质基础,可作为质量标志物进行选择,宜进一步聚焦其所含甾体皂苷类成分化学物质组的深入研究,探寻不同基原黄精的差异,建立专属性的测定方法,提高质量评价和质量控制的科学性。
5 结语黄精作为著名的补益中药,具有广泛的生理活性,其多方面的药用价值具有广阔的开发利用前景。黄精为多基原中药,除《中国药典》收载的黄精、滇黄精和多花黄精外,还有多种同属植物也在不同省区作为黄精入药。同时,黄精药材大多来源于野生资源,近些年来,由于过度采挖造成黄精药材产量下降。因此,如何建立科学、合理的质量评价方法,对多基原黄精的质量进行全面准确地评价并指导黄精资源的合理利用,对于黄精产业的健康发展具有重要的现实意义
本文在对黄精化学成分和药理作用研究现状综述的基础上,基于中药质量标志物的核心概念,根据黄精属植物的亲缘关系以及甾体皂苷类成分的化学亲缘学和生源途径分析,并结合化学成分与有效性相关证据,对黄精质量标志物的筛选和确定进行了文献分析和论证,提出了中药质量标志物分析的可行路径和可参照的模式方法。
| [1] | 中国科学院中国植物志编辑委员会. 中国植物志(第15卷)[M]. 北京: 科学出版社, 2000. |
| [2] | 陈哗, 孙晓生. 黄精的药理研究进展[J]. 中药新药与临床药理, 2010, 21(3):328–330. |
| [3] | 张洁, 马百平, 杨云, 等. 黄精属植物甾体皂苷类成分及药理活性研究进展[J]. 中国药学杂志, 2006, 41(5):330–332. |
| [4] | 徐德平, 孙蜻, 齐斌, 等. 黄精中三萜皂苷的提取分离与结构鉴定[J]. 中草药, 2006, 37(10):1470–1472. |
| [5] | 陈立娜, 高艳坤, 都述虎. 黄精质量标准的研究[J]. 中药材, 2006, 29(12):1367–1369. |
| [6] | Son K H, Do J C, Kang S S. Steroidal saponins from the rhizomes of Polygonatum sibiricum[J]. J Nat Prod, 1990, 53(2): 333–339. DOI:10.1021/np50068a010 |
| [7] | 范书珍, 陈存武, 王林. 多花黄精总皂苷的提取研究[J]. 皖西学院学报, 2005, 21(5):39–41. |
| [8] | Ma K, Huang X F, Kong L Y. Steroidal saponins from Polygonatum cyrtonema[J]. Chem Nat Compd, 2013, 49(5): 888–891. DOI:10.1007/s10600-013-0770-2 |
| [9] | 杨崇仁, 张影, 王东, 等. 黄精属植物甾体皂苷的分子进化及其化学分类学意义[J]. 云南植物研究, 2007, 29(5):591–600. |
| [10] | 孙隆儒, 李铣. 黄精化学成分的研究(Ⅱ)[J]. 中草药, 2001, 32(7):586–588. |
| [11] | 张洁.滇黄精化学成分的研究[D].郑州:河南中医学院, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10471-2006168853.htm |
| [12] | 李娟丽.卷叶黄精化学成分及其生物活性的研究[D].杨凌:西北农林科技大学, 2007. |
| [13] | Yu H S, Ma B P, Song X B, et al. Two new steroidal saponins from the processed Polygonatum kingianum[J]. Helv Chim Acta, 2010, 93(6): 1086–1092. DOI:10.1002/hlca.v93:6 |
| [14] | 王彩霞, 徐德平. 黄精中乌苏酸型皂有的分离与结构鉴定[J]. 食品与生物技术学报, 2008, 27(3):33–36. |
| [15] | 徐德平, 孙婿, 齐斌, 等. 黄精中三萜皂苷的提取分离与结构鉴定[J]. 中草药, 2006, 37(10):1470–1472. |
| [16] | 马百平, 张洁, 康利平, 等. 滇黄精中一个三萜皂苷的NMR研究[J]. 天然产物研究与开发, 2007, 19(1):7–10. |
| [17] | Yu H S, Ma B P, Kang L P, et al. Saponins from the processed rhizomes of Polygonatum kingianum[J]. Chem Pharm Bull, 2009, 57(9): 1011–1014. DOI:10.1248/cpb.57.1011 |
| [18] | 康利平, 张洁, 余和水, 等.滇黄精化学成分的研究[A]//第七届全国天然有机化学学术研讨会论文集[C].成都:中国化学会, 2008. |
| [19] | Gan L S, Chen J J, Shi M F, et al. A new homoisoflavanone from the rhizomes of Polygonatum cyrtonema[J]. Nat Prod Commun, 2013, 8(5): 597–598. |
| [20] | 李晓, 来国防, 王易芬, 等. 滇黄精的化学成分研究(Ⅱ)[J]. 中草药, 2008, 39(6):825–828. |
| [21] | 王易芬, 穆天慧, 陈纪军, 等. 滇黄精化学成分研究[J]. 中国中药杂志, 2003, 28(6):524–527. |
| [22] | 张普照.黄精采收加工技术及其化学成分研究[D].杨凌:西北农林科技大学, 2006. |
| [23] | 郑虎占, 董泽宏, 佘靖, 等. 中药现代研究与应用(第5卷)[M]. 北京: 学苑出版社, 1998. |
| [24] | Chopin J, Dellamonica G, Benson E, et al. C-galactosylflavones from Polygonatum multiflorum[J]. Phytochemistry, 1977, 16(12): 199. |
| [25] | 高颖, 戚楚露, 张磊, 等. 黄精新鲜药材的化学成分[J]. 药学与临床研究, 2015(4):365–367. |
| [26] | Nakata H, Sasaki K, Morimoto I, et al. The structure of polygonaquinone[J]. Tetrahedron, 1964, 20(10): 2319–2323. DOI:10.1016/S0040-4020(01)97620-3 |
| [27] | Huang P L, Can K H, Wu R R, et al. Benzoquinones, a homoisoflavanone and other constituents from Paltelobatum[J]. Phytochemistry, 1997, 44(7): 1369–1373. DOI:10.1016/S0031-9422(96)00652-8 |
| [28] | Sun L R, Li X, Wang S X. Two new alkaloids from the rhizome of Polygonatum sibiricum[J]. J Asian Nat Prod Res, 2005, 7(2): 127–130. DOI:10.1080/10286020310001625157 |
| [29] | Wang Y F, Lu C H, Lai G F, et al. A new indolizinone from Polygonatum kingianum[J]. Planta Med, 2003, 69(11): 1066–1068. DOI:10.1055/s-2003-45160 |
| [30] | Son K H, Do J C, Kang S S. Isolation of adenosine fromthe rhizomes of Polygonatum sibiricum[J]. Arch Pharm Res, 1991, 14(2): 193–194. DOI:10.1007/BF02892028 |
| [31] | 朱艳玲.两种药用植物的化学成分研究[D].昆明:昆明医学院, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10678-2008117809.htm |
| [32] | Ahn M J, Cho H, Lee M K, et al. A bisdesmosidic cholestane glycoside from the rhizomes of Polygonatum sibiricum[J]. Nat Prod Sci, 2011, 17(3): 183–188. |
| [33] | 王冬梅, 朱玮, 李娟丽. 卷叶黄精根茎的化学成分及抗菌活性研究[J]. 四川大学学报:自然科学版, 2007, 44(4):918–921. |
| [34] | 童红, 申刚. 黄精药材中黄精多糖的含量测定[J]. 中国药业, 2007, 18(9):20–21. |
| [35] | 王晓丹, 田芳, 史桂云, 等. 不同产地黄精中多糖含量的比较[J]. 泰山医学院学报, 2008, 29(9):657–658. |
| [36] | 杨明河, 于德全. 黄精多糖和低聚糖的研究[J]. 药学通报, 1980, 15(7):44. |
| [37] | Liu L, Qun D, Dong X T, et al. Strucutral investigation of two neutral polysaccharises isolated from rhizome of Polygonatum sibiricum[J]. Carbohydr Polym, 2007, 70(3): 304–309. DOI:10.1016/j.carbpol.2007.04.012 |
| [38] | 方圆, 王彩霞, 徐德平. 黄精多糖的分离及结构鉴定[J]. 食品工业与发酵, 2010, 36(8):79–82. |
| [39] | 吴群绒, 胡盛, 杨光忠, 等. 滇黄精多糖I的分离纯化及结构研究[J]. 林产化学与工业, 2005, 25(2):80–82. |
| [40] | 王聪.多花黄精多糖提取分离、分子量测定及其粗多糖的初步药效研究[D].成都:成都中医药大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10633-1013111742.htm |
| [41] | 祝义伟, 祝利, 陈秋生, 等.黄精的化学成分、药理作用及其产品开发[A]//第六届全国中西医结合营养学术会议论文资料汇编[C].重庆:中国中西医结合学会营养专业委员会, 2015. |
| [42] | 王进, 岳永德, 汤锋, 等. 气质联用法对黄精炮制前后挥发性成分的分析[J]. 中国中药杂志, 2011, 36(16):2187–2191. |
| [43] | 余红, 张小平, 邓明强, 等. 多花黄精挥发油GC-MS分析及其生物活性研究[J]. 中国实验方剂学杂志, 2008, 14(5):4–6. |
| [44] | 王冬梅, 朱炜, 张存莉, 等. 黄精化学成分及其生物活性[J]. 西北林学院学报, 2006, 21(2):142–153. |
| [45] | 王婷, 苗明三. 黄精的化学、药理及临床应用特点分析[J]. 中医学报, 2015, 30(5):714–715, 718. |
| [46] | 王曙东, 宋炳生, 金亚丽, 等. 黄精根茎及须根中微量元素及氨基酸的分析[J]. 中成药, 2001, 23(5):369–370. |
| [47] | 公惠玲, 尹艳艳, 李卫平, 等. 黄精多糖对四氧嘧啶诱导的糖尿病小鼠血糖和抗氧化作用的影响[J]. 安徽医科大学学报, 2008, 43(5):538–540. |
| [48] | 刘中申, 李占伟. 黄精对小鼠超氧化物岐化酶褐心肌脂褐素的影响[J]. 中医药学报, 1990(3):44–45. |
| [49] | 陈淑清. 当归、枸杞、黄精、黄芪、褐竹荪总皂苷的实验研究:对小鼠羟脯酸含量耐缺氧和抗疲劳作用的影响[J]. 中药药理与临床, 1990, 6(3):28. |
| [50] | 王爱梅, 周建辉, 欧阳静萍. 黄精对D-半乳糖所致衰老小鼠的抗衰老作用研究[J]. 长春中医药大学学报, 2008, 24(2):137–138. |
| [51] | 赵红霞, 蒙义文. 黄精多糖对果蝇寿命的影响[J]. 应用与环境生物学报, 1995, 1(1):74–77. |
| [52] | 李超彦, 周媛媛, 王福青, 等. 黄精多糖对顺铂致肝损害大鼠肝功能的保护及抗氧化指标的影响[J]. 中国实验方剂学杂志, 2013, 19(16):229–231. |
| [53] | Bodnar G, Ouellette M, Frolkis M, et al. Extension of life-span by introduction of telanerase inm noanal hmnan cells[J]. Science, 1998, 279(16): 349–352. |
| [54] | 李友元, 邓洪波, 王蓉, 等. 衰老小鼠组织端粒酶活性变化及黄精多糖的干预作用[J]. 医学临床, 2005, 22(7):894–895. |
| [55] | 赵红霞, 蒙义文, 曾庆华. 黄精多糖对老龄人鼠衰老生理生化指标的影响[J]. 应用与环境生物学报, 1996, 2(4):356–360. |
| [56] | 陈金水, 陈松苍, 王耀华. 黄精口服液对剧烈运动小鼠氧自由基代谢及肌酸激酶影响[J]. 中医研究, 1996, 9(4):6–8. |
| [57] | 石娟, 赵煌. 黄精粗多糖抗疲劳抗氧化作用的研究[J]. 时珍国医国药, 2011, 22(6):1409–1410. |
| [58] | 夏晓凯, 张庭廷, 陈传平. 黄精多糖的体外抗氧化作用研究Ⅲ[J]. 湖南中医杂志, 2006, 22(4):90–96. |
| [59] | 陈广, 严士海. 黄精多糖对过氧化氢致血管内皮细胞损伤的保护作用[J]. 时珍国医国药, 2011, 22(3):623–624. |
| [60] | 倪文澎, 朱营营, 王海丹, 等. 黄精多糖对脂多糖诱导人脐静脉内皮细胞损伤的保护机制研究[J]. 中华中医药学刊, 2012, 30(12):2644–2648. |
| [61] | 王玉勤, 吴晓岚, 张广新, 等. 黄精多糖对大鼠抗氧化作用的实验研究[J]. 中国现代医生, 2011, 49(5):6–11. |
| [62] | 王玉勤, 于晓婷, 吴晓岚, 等. 黄精多糖对力竭小鼠脑组织自由基代谢影响[J]. 中国公共卫生, 2014, 30(9):1165–1167. |
| [63] | 毛雁, 马兰军, 吕永安, 等. 黄精提取物对人强度耐力训练人鼠心肌线粒体抗氧化能力及ATP酶活性影响的实验研究[J]. 四川中医, 2008, 26(2):15–17. |
| [64] | 薛春苗, 任汉阳, 薛润苗, 等. 黄精粗多糖对温热药致阴虚模型小鼠抗氧化作用的实验研究[J]. 河南中医, 2006, 26(3):24–26. |
| [65] | 任汉阳, 薛春苗, 张瑜, 等. 黄精粗多糖对温热药致阴虚模型小鼠滋阴作用的实验研究[J]. 山东中医杂志, 2005, 24(1):36–37. |
| [66] | 吴石星.黄精多糖对AD大鼠学习记忆能力和海马细胞凋亡的影响[D].长沙:中南大学, 2008. |
| [67] | 成威, 田伟, 李友元, 等. 黄精多糖对APP转基因小鼠海马CA1区突触结构的影响[J]. 中国实验方剂学杂志, 2010, 16(10):165–167. |
| [68] | 赵小贞, 王玮, 康仲涵, 等. 黄精口服液对血管性痴呆大鼠学习记忆与海马突触可塑性的影响[J]. 神经解剖学杂志, 2005, 21(2):147–153. |
| [69] | 易玉新, 吴石星, 叶茂盛, 等. Aβ1-42海马注射对大鼠海马细胞的影响及黄精多糖的干预研究[J]. 中南大学学报:医学版, 2014, 39(4):344–348. |
| [70] | 黄芳, 陈桃林, 蒙义文. 黄精多糖对老龄大鼠记忆获得和记忆再现的影响[J]. 应用与环境生物学报, 1999, 5(1):36–39. |
| [71] | 孙隆儒, 李铣, 郭月英, 等. 黄精改善学习记忆障碍等作用的研究[J]. 沈阳药科大学学报, 2001, 18(4):286–289. |
| [72] | Xie W, Du L. Diabetes is an inflammatory disease:evidence from traditional Chinese medicines[J]. Diabetes Obes Metab, 2011, 13(4): 289–301. DOI:10.1111/j.1463-1326.2010.01336.x |
| [73] | 高英, 叶小利, 李学刚, 等. 黄精多糖的提取及其对α-葡萄糖苷酶抑制作用[J]. 中成药, 2010, 32(12):2133–2137. |
| [74] | 陈兴荣, 赖泳, 王成军. 滇黄精对诱导性高血糖小鼠影响的实验研究[J]. 时珍国医国药, 2010, 21(12):3163–3164. |
| [75] | 冯桂玲, 尤昭玲, 尤昭玲. 补肾健脾法辅治卵巢低反应经验总结[J]. 中华中医药学刊, 2012, 30(11):2379–2381. |
| [76] | 李友元, 邓洪波, 张萍, 等. 黄精多糖对糖尿病模型小鼠糖代谢的影响[J]. 中国临床康复, 2005, 9(27):90–91. |
| [77] | 公惠玲, 李卫平, 尹艳艳, 等. 黄精多糖对链脲菌素糖尿病大鼠降血糖作用及其机制探讨[J]. 中国中药杂志, 2009, 34(9):1149–1154. |
| [78] | 沃兴德, 楼兰花. 补气药对正常小白鼠血浆核脾组织cAMP、cCMP含量的影响[J]. 浙江中医杂志, 1984, 19(5):232–233. |
| [79] | 王建新. 黄精降糖降脂作用的实验研究[J]. 中国中医药现代远程教育, 2009, 7(1):93–94. |
| [80] | 张炜.黄精多糖对糖尿病肾病大鼠的治疗作用及机制研究[D].杭州:浙江大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10335-1011187117.htm |
| [81] | 董琦, 董凯, 张春军. 黄精对2型糖尿病胰岛素抵抗大鼠葡萄糖转运蛋白-4基因表达的影响[J]. 新乡医学院学报, 2012, 29(7):493–495. |
| [82] | Kato A, Miura T, Yano H, et al. Suppressive effects of polygonati rhizoma on hepatic; glucose output GLUT2 mRNA expression and its protein content in rat liver[J]. Endar, 1994, 41(2): 139–144. |
| [83] | 吴粲荣, 李友元, 邓洪波, 等. 黄精多糖对老年糖尿病小鼠脑组织糖基化终产物受体mRNA表达的影响[J]. 中华老年医学杂志, 2004, 23(11):817–819. |
| [84] | 张庭廷, 夏晓凯, 陈传平, 等. 黄精多糖的生物活性研究[J]. 中国实验方剂学杂志, 2006, 12(7):42–45. |
| [85] | 张融瑞. 黄精的几种不同溶剂提取物对大鼠高脂血症的作用[J]. 江苏中医, 1998(7):411. |
| [86] | 李友元, 张萍, 邓洪波, 等. 动脉粥样硬化家兔VCAM-1表达及黄精多糖对其表达的影响[J]. 医学临床研究, 2005, 22(9):1287–1288. |
| [87] | 李友元, 肖洒. 黄精多糖调脂作用的实验研究[J]. 中华老年心脑血管病杂志, 2002, 4(6):434. |
| [88] | 李友元, 邓洪波, 向大雄, 等. 黄精多糖的降血脂及抗动脉粥样硬化作用[J]. 中国动脉硬化杂志, 2005, 13(4):429–431. |
| [89] | 吴粲荣, 李友元, 土小清, 等. 黄精多糖对脂肪组织分泌的生物活性物质致肝细胞HepG2分泌C反应蛋白的影响[J]. 中华医学杂志, 2004, 84(17):1447–1448. |
| [90] | 吴粲荣, 李友元, 肖洒. 黄精多糖调脂作用的实验研究[J]. 中国新药杂志, 2003, 12(2):108–110. |
| [91] | 张萍, 刘丹, 李友元. 黄精多糖对动脉粥样硬化家兔血清IL-6及CRP的影响[J]. 医学临床研究, 2006, 23(7):1100–1101. |
| [92] | 傅晓骏, 傅志慧. 中药制黄精对慢性肾衰人鼠血液动力学的影响[J]. 中华中医药学刊, 2012, 30(10):2161–2163. |
| [93] | 叶素英, 周艳阳, 叶绍凡. 黄精多糖对人强度训练人鼠血红蛋白、乳酸及脑组织抗氧化能力、一氧化氮体系的影响[J]. 中国老年学杂志, 2014, 3(4):6706–6708. |
| [94] | 吴粲荣, 李友元, 肖洒.黄精多糖的用途:中国, CN1494913[P].2002-05-12. |
| [95] | 胡国柱, 聂荣庆, 肖移生, 等. 黄精多糖对新生人鼠人脑皮层神经细胞缺氧性凋亡的影响[J]. 中药药理与临床, 2005, 21(4):37–38. |
| [96] | 陈娟, 李友元, 田伟, 等. 黄精多糖对帕金森病大鼠脑组织中PPAR-r表达的影响[J]. 现代生物医学进展, 2010, 10(5):814–817. |
| [97] | 文珠, 肖移生, 唐宁, 等. 黄精多糖对神经细胞的毒性及抗缺氧性坏死和凋亡作用研究[J]. 中药药理与临床, 2006, 22(22):29–31. |
| [98] | 耿甄彦, 徐维平, 魏伟, 等. 黄精皂苷对抑郁模型小鼠行为及脑内单胺类神经递质的影响[J]. 中国新药杂志, 2009, 18(11):1023–1026. |
| [99] | 黄莺, 徐维平, 魏伟, 等. 黄精皂苷对慢性轻度不可预见性应激抑郁模型大鼠行为学及血清中微量元素的影响[J]. 安徽医科大学学报, 2012, 47(3):286–289. |
| [100] | 陈辰, 徐维平, 魏伟. 黄精多糖对慢性应激抑郁小鼠模型行为学及脑内5-HT的影响[J]. 山东医药, 2009, 49(4):39–41. |
| [101] | 徐维平, 祝凌丽, 魏伟, 等. 黄精总皂苷对慢性应激性抑郁模型大鼠免疫功能的影响[J]. 中国临床保健杂志, 2011, 14(1):59–61. |
| [102] | Zeng G F, Zhang Z Y, Lu L, et al. Protective effects of Polygonatum sibiricum polysaccharide on ovariectomy-induced bone loss in rats[J]. J Ethnopharmacol, 2011, 136(1): 224–229. DOI:10.1016/j.jep.2011.04.049 |
| [103] | 曾高峰, 宗少晖, 邹斌, 等. 黄精多糖对小鼠骨髓问充质干细胞向成骨细胞分化中ALP和BGP表达的影响[J]. 中国骨质疏松杂志, 2014, 20(7):779–783. |
| [104] | 傅淑平, 张荣华. 不同浓度梓醇对SD大鼠骨髓间充质干细胞增殖及骨向分化的影响[J]. 时珍国医国药, 2012, 23(10):2398–2400. |
| [105] | Zen G F, Zong S H, Zhang Z Y, et al. Effects of Polygonatum polysaccharide on the expression ofinterleukin-1 and 6 in rats with osteoporotic fracture[J]. Chin J Tissue Eng Res, 2012, 16(2): 220–222. |
| [106] | Zen G F, Zong S H, Zhang Z Y, et al. Effects of polygonatum polysaccharide on bone metabolism cytokines in osteoporotic frac; turerats[J]. J Clin Rehabil Tissue Eng Res, 2011, 15(33): 6199–201. |
| [107] | 胡微煦, 文珠, 戎吉平, 等. 黄精多糖干预长春新碱诱导的骨髓间质细胞生长抑制及凋亡[J]. 中药药理临床, 2012, 28(6):79–82. |
| [108] | 文珠, 胡国柱, 俞火, 等. 黄精多糖干预长春新碱抑制骨髓基质细胞增殖的研究[J]. 中华中医药杂志, 2011, 26(7):1630–1632. |
| [109] | 王红玲, 张渝侯, 洪艳, 等. 黄精对哮喘儿红细胞免疫功能影响的体外验研究[J]. 中国当代儿科杂志, 2002, 4(3):233–235. |
| [110] | 傅圣斌, 钱建鸿, 陈乐意, 等. 黄精多糖的提取及其对小鼠免疫活性的影响[J]. 中国食品学报, 2013, 13(1):68–72. |
| [111] | 薄芯, 董历平. 黄精、党参核绿茶减轻环磷酞胺毒副反应初探[J]. 中医研究, 1997, 10(3):20–22. |
| [112] | 朱模波, 土慧贤, 焦炳忠, 等. 黄精调节免疫及防治肿瘤作用的实验研究[J]. 中国中医药科技, 1994, 1(6):31–33. |
| [113] | Hirai N, Miura T, Moriyasu M, et al. Cardiotonic activity of the rhizome of Polygonatum sibircum in rats[J]. Biol Pharm Bull, 1997, 20(12): 1271–1273. DOI:10.1248/bpb.20.1271 |
| [114] | 许苏旸.黄精多糖对大强度运动后人体心肌微损伤及心脏内分泌功能的影响[D].成都:成都体育学院, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10653-1012510021.htm |
| [115] | 四军大冠心病药理研究小组. 黄精对冠脉流量等药理作用的初步观察[J]. 四川中草药通讯, 1974(2):24. |
| [116] | 有泽宗久. 生药中ACE抑制活性成分的研究[J]. 国外医学:中医中药分册, 1984(6):31. |
| [117] | 黄骏. 黄精首乌醋治疗足癣55例[J]. 新中医, 1977, 40(2):6. |
| [118] | 苏伟, 赵利, 刘建涛, 等. 黄精多糖抑菌及抗氧化性能研究[J]. 食品科学, 2007, 28(8):55–57. |
| [119] | 胡骄阳, 汤锋, 操海群, 等. 多花黄精提取物对水果采后病原菌的抑菌活性研究[J]. 植物保护, 2012, 38(6):31–34. |
| [120] | 郑春艳, 汪好芬, 张庭廷. 黄精多糖的抑菌和抗炎作用研究[J]. 安徽师范大学学报:自然科学版, 2010, 33(3):272–275. |
| [121] | 邵春源. 中药黄精对豚鼠实验性结核病的疗效初步观察报告[J]. 浙江医学, 1962, 10(4):3–10. |
| [122] | 吕小迅, 周玉珍, 林圣远, 等. 黄签黄精联合抗真菌实验研究[J]. 中国皮肤性病学杂志, 1996, 10(2):80. |
| [123] | 汪滢, 工国平, 王丽薇, 等. 一株多花黄精内生真菌的鉴别及其抗菌代谢产物[J]. 微生物学报, 2010, 50(8):1036–1043. |
| [124] | 李凯.黄精多糖滴眼液治疗单纯疱疹性角膜炎的临床研究[D].南京:南京中医药大学, 2003. |
| [125] | 段华, 王保奇, 张跃文. 黄精多糖对肝癌H22移植瘤小鼠的抑瘤作用及机制研究[J]. 中药新药与临床药理, 2014, 25(1):5–7. |
| [126] | 孙晓娟.黄精、巴戟天、白芷有效成分体外抗肿瘤作用的研究[D].郑州:郑州大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10459-1012352007.htm |
| [127] | Cai J, Lium J, Wag Z, et al. Apoptosis induced by dioscin in Hela cells[J]. Biol Pharm Bull, 2002, 25(2): 193–196. DOI:10.1248/bpb.25.193 |
| [128] | 张峰, 高群, 孔令雷, 等. 黄精多糖抗肿瘤作用的实验研究[J]. 中国实用医药, 2007, 21(2):95–96. |
| [129] | Wang S Y, Yu Q J, Bao J K, et al. Palygonatum cyrtonema lectin, a potential antineoplastic drug targeting programmed cell death pathways[J]. Biochem Biophys Res Commun, 2011, 406(4): 497–500. DOI:10.1016/j.bbrc.2011.02.049 |
| [130] | 孙化萍, 罗旭升, 曾庆华. 0.8%黄精多糖滴眼液对干眼症的实验研究[J]. 中国中医眼科杂志, 2004, 14(2):67–69. |
| [131] | 孙化萍, 于晓林, 罗旭升, 等. 黄精多糖滴眼液对实验性干眼症结膜的影响[J]. 中国中医眼科杂志, 2005, 15(2):80–82. |
| [132] | 俞之杰. 21种中药对体外纤维蛋白溶解作用的观察[J]. 中西医结合杂志, 1986, 6(8):484. |
| [133] | 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker):中药产品质量控制的新概念[J]. 中草药, 2016, 47(9):1443–1457. |
| [134] | 刘昌孝. 从中药资源-质量-质量标志物认识中药产业的健康发展[J]. 中草药, 2016, 47(18):3149–3154. |
| [135] | 张铁军, 许浚, 韩彦琪, 等. 中药质量标志物(Q-marker)研究:延胡索质量评价及质量标准研究[J]. 中草药, 2016, 47(9):1458–1467. |
| [136] | 张铁军, 许浚, 申秀萍, 等. 基于中药质量标志物(Q-Marker)的元胡止痛滴丸的"性-效-物"三元关系和作用机制研究[J]. 中草药, 2016, 47(13):2199–2211. |
| [137] | 熊亮, 彭成. 基于中药质量标志物(Q-Marker)的基本条件研究益母草和赶黄草的Q-Marker[J]. 中草药, 2016, 47(13):2212–2220. |
 2017, Vol. 48
2017, Vol. 48


