茄属Solanum L. 为被子植物门,茄科(Solanaceae)植物,草本,多为亚灌木,灌木至小乔木,有时为藤本。全世界有2 000余种,分布于热带及亚热带,少数达到温带地区,主产于南美洲的热带,我国有39种,14变种[1]。其中茄S. melongena L. 和马铃薯S. tuberosum L. 为很重要的经济作物,部分可入药。但有些植物有毒,如发芽的马铃薯[2]。
近年来,茄属植物因其重要的食用和药用价值,日益受到关注,也逐渐成为研究热点。研究表明,茄属植物中含有生物碱类、黄酮类、甾类、萜类以及香豆素类、有机酸类等化学成分。许多茄属植物有清热、解毒、活血、消肿、化瘀的功效,对疔疮、痈肿、跌打损伤、慢性气管炎、急性肾炎、风湿性关节炎、白带过多、水肿、淋病等都有一定的疗效[3]。本文对1996年至今国内外对茄属植物的化学成分及生物活性的研究进展进行综述,以期为该属植物的开发利用提供相关参考。
1 化学成分 1.1 生物碱类化合物茄属植物中生物碱类成分丰富,结构复杂多样,主要包括有机胺类生物碱(Ⅰ):苯丙素类、苯丙酰胺类等;甾体类生物碱(Ⅲ):胆甾烷类等,该类生物碱按骨架又可分为胆甾烷类生物碱和异胆甾烷类生物碱(其主要区别在于五元环与六元环异位);吡咯生物碱(Ⅲ)以及其他类型的生物碱类成分。1996年,Kim等[4]在S. umbelliferum Eschsch. 中发现了2个新的天然产物(26、27)。2007年,Yoshikawa等[5]在S. lycocarpum A. St. -Hil. 果实中分离出2个新的甾体生物碱(22、23),并发现其具有抗糖尿病的作用。2011年,Torres等[6]在S. capaniforme Roem. & Schult. 的叶子中分离得到了7个化合物,其中包括3个新的生物碱类化合物(54、55、77)。2013年,Torres等[7]又在该植物的叶子中分离出8个新的龙葵次碱烷类甾体生物碱(55~62)。茄属植物中的生物碱类化合物见表 1和图 1。
茄属植物中生物碱类成分丰富,结构复杂多样,主要包括有机胺类生物碱(Ⅰ):苯丙素类、苯丙酰胺类等;甾体类生物碱(Ⅲ):胆甾烷类等,该类生物碱按骨架又可分为胆甾烷类生物碱和异胆甾烷类生物碱(其主要区别在于五元环与六元环异位);吡咯生物碱(Ⅲ)以及其他类型的生物碱类成分。1996年,Kim等[4]在S. umbelliferum Eschsch. 中发现了2个新的天然产物(26、27)。2007年,Yoshikawa等[5]在S. lycocarpum A. St. -Hil. 果实中分离出2个新的甾体生物碱(22、23),并发现其具有抗糖尿病的作用。2011年,Torres等[6]在S. capaniforme Roem. & Schult. 的叶子中分离得到了7个化合物,其中包括3个新的生物碱类化合物(54、55、77)。2013年,Torres等[7]又在该植物的叶子中分离出8个新的龙葵次碱烷类甾体生物碱(55~62)。茄属植物中的生物碱类化合物见表 1和图 1。| 表 1 茄属植物中的生物碱类化合物 Table 1 Alkaloid compounds from plants of Solanum L. |
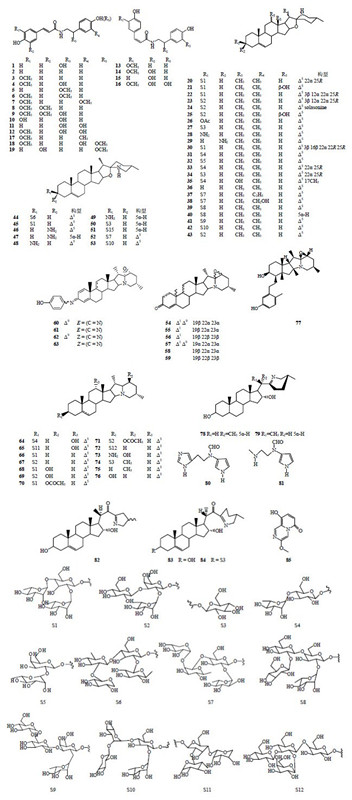 | 图 1 茄属植物中的生物碱类化合物的结构Fig.1 Structures of alkaloid compounds from plants of Solanum L. |
黄酮类化合物在茄属植物中作为一种活性成分也广泛存在,如白英[10]、疏刺茄S. nienkui Merr.[36, 37]、水茄[38]等中已发现黄酮类成分。茄属中的黄酮类成分以山柰酚(kaempferol)、芦丁(rutin)、槲皮素(quercetin)居多,且按照结构可分为黄酮类(Ⅰ)、黄酮醇类(Ⅰ)、异黄酮类(Ⅲ)、花色素类(Ⅳ)以及其他类型。2010年,Ohtsuki等[39]在假烟叶树S. verbascifolium L. 的叶子中发现了1个新的黄酮苷类化合物(86)。2011年,Lu等[38]首次在龙葵中分离出芦丁(98)、山柰酚(102)、槲皮素(100)以及异槲皮素(isoquercetin,101)。2012年,吴丹等[37]在疏刺茄中分离出5个黄酮类化合物(96、100、102、117、122)。这些化合物均为首次从该植物中分离得到,其中化合物117是首次从茄科(Solanaceae)植物中分离得到。茄属植物中的黄酮类化合物见表 2和图 2。
| 表 2 茄属植物中的黄酮类化合物 Table 2 Flavonoid compounds from plants of Solanum L. |
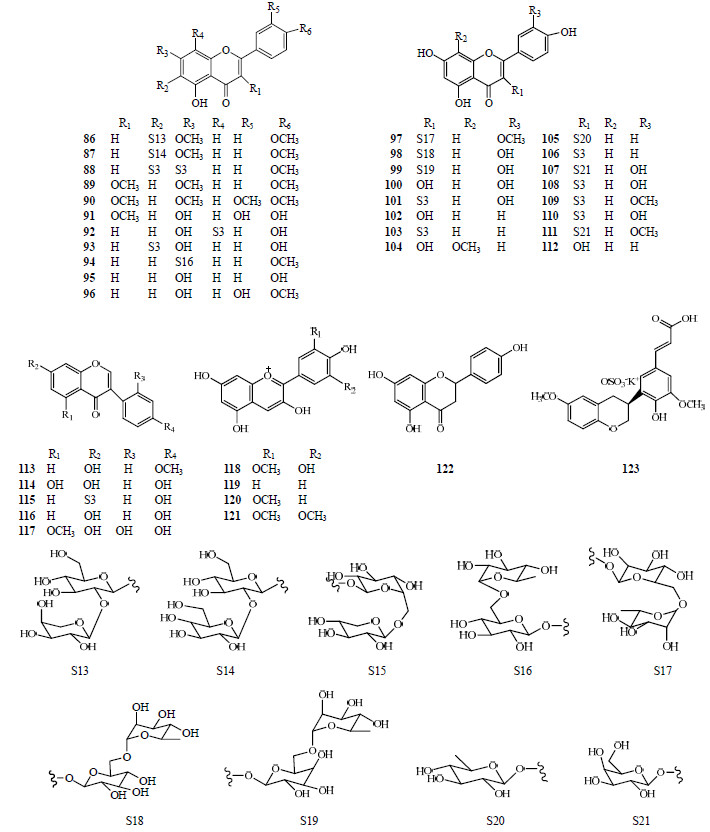 | 图 2 茄属植物中的黄酮类化合物结构Fig.2 Structures of flavonoid compounds from plants of Solanum L. |
茄属植物中的甾类成分更是丰富,多是以成苷形式存在,且以甾体皂苷类型为主。按骨架分为螺甾类(Ⅰ),包括螺甾烷类(C-25为S构型)、螺甾烯类、异螺甾烷类(C-25为R构型);呋甾烷类(Ⅲ,F环为开链衍生物);变形螺甾烷类(Ⅲ,F环为五元四氢呋喃环);C-21甾类(Ⅳ,母核含有21个碳原子,如孕甾烷类);还有植物甾醇类(Ⅴ,17位侧链为含有9~10个碳原子的脂肪烃)。Li等[52]在水茄的果实中分离出5个新的具有细胞毒活性的甾体苷类化合物(236~238、264、265)。2009年,Lu等[53]在水茄的地上部分中分离得到了2个新的C-22甾体苷类化合物(287、288)。Chang等[54]在紫花茄的地上部分分离鉴定了12个甾类化合物,有4个是具有独特结构的新化合物(164~167),其中indioside L含有罕见的1,4-2-烯-3-酮结构。有学者在S. abutiloides的果实中发现了abutiloides系列化合物,以及在S. macaonense Dunal中发现了macaosides系列化合物。茄属植物中的甾类化合物日益丰富。茄属植物中的甾类化合物见表 3和图 3。
| 表 3 茄属植物中的甾类化合物 Table 3 Steroidal compounds from plants of Solanum L. |
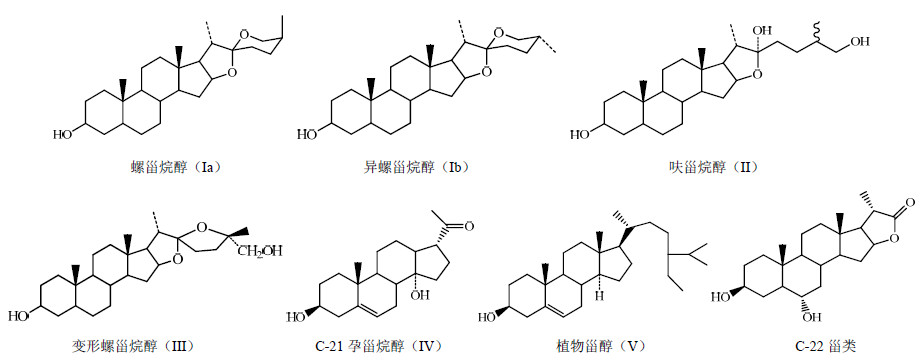 | 图 3 茄属植物中甾类化合物的结构类型Fig.3 Structure types of steroidal compounds from plants of Solanum L. |
茄属植物中除了以上3种成分以外还包含其他类型的化合物,如萜类化合物[81, 82]、有机酸[10, 44]及其衍生物[83]、香豆素类[77, 84]、木脂素[77]、苯丙素类[85]等。2013年,Li等[82]在白英中发现了2个新的桉烷型倍半萜类化合物solajiangxin F和G,并发现其具有细胞毒活性。同年,Yao等[86]在白英中发现了3个新的倍半萜类化合物solajiangxin A~C。Herrera-Salgado等[87]在S. lanceolatum Cav. 中分离出2个系列的新的肌醇衍生的糖脂类似物lanceolitol A1~A7和B1~B7。
2 生物活性茄属植物是茄科中一类重要的植物,常作为民间草药广泛使用。该属下多种植物早在《本草纲目》《新修本草》等古籍中就有记载,具有悠久的药用历史。如龙葵,《本草纲目》中介绍其苦、微甘,滑,寒,无毒;主治去热少睡、小便不通、坠伤、背痈等。
2.1 肝保护作用2008年,Lin等[88]研究发现龙葵水提取物(SNE)能够逆转CCl4诱导的氧化肝损伤大鼠的肝纤维化组织学特点和血清中天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、碱性磷酸酶及总胆红素水平。这种保护能力部分是由于其调节解毒酶和抗氧化酶的作用(抑制自由基的产生和随后的肝损伤)。Hsieh等[89]研究表明在硫代乙酰胺(TAA)诱导的小鼠肝损伤中,血浆ALT活性和总胆红素浓度增加,经过SNE治疗后降低了血浆ALT活性和总胆红素水平,且通过抑制转化生长因子(TGF-β1)分泌减慢肝纤维化。
2.2 肾保护作用Hussain等[90]发现黄果茄果实提取物对庆大霉素引起的肾毒性和肾功能不全大鼠有保护作用。其作用机制可能为黄果茄果实提取物作为一种有效的自由基清除剂作用于肾脏,保护其不受庆大霉素的毒性作用。Kumar等[91]进行了龙葵全草提取液对庆大霉素诱导的肾细胞损伤的体外研究。通过台盼蓝拒染试验和MTT法评估线粒体脱氢酶活性实验得出:庆大霉素的细胞毒性明显被抑制且龙葵全草提取液也表现出显著的潜在羟基自由基清除能力,从而表现出细胞保护活性。
2.3 胃保护作用Mesia-Vela等[92]通过研究S. paniculatum的不同部分的水提物对小鼠(幽门结扎)胃酸分泌的抑制作用,发现其根、茎和花的水提物抑制小鼠胃酸分泌,叶的水提物不影响胃酸的分泌,而果实的水提取物刺激胃酸分泌。总的来说这一结果验证了民间使用S. paniculatum来治疗胃病的科学性。Jainu等[93]研究了龙葵的抗溃疡和促进溃疡愈合的作用。实验证明,SNE在高剂量时具有显著的抗冷束缚应激(CRU)、吲哚美辛(ID)、幽门结扎(PL)以及乙醇引起的大鼠胃溃疡的活性,与奥美拉唑相比具有相同或更高的治疗效果。其作用机制可能是通过抑制H+, K+-ATP酶活性,减少胃酸分泌从而起到抗胃溃疡作用;进一步研究表明SNE同样具有促进胃溃疡伤口愈合的作用。
2.4 抗肿瘤作用Wang等[94]研究发现SNE在小鼠体内外均可抑制黑色素瘤细胞(B16-F1)的转移和侵袭,其机制可能是使蛋白激酶失活。Li等[95]研究发现SNE能通过调节小鼠免疫能力和诱导细胞凋亡抑制宫颈癌细胞的生长。Son等[96]研究了龙葵的成熟果实对乳腺癌(MCF)的作用。实验证明,龙葵的成熟果实乙醇提取物可抑制MCF-7细胞的增殖,诱导其凋亡。此提取物是羟基自由基、1,1-二苯-2-苦基肼(DPPH)自由基清除剂,可以作为抗氧化剂和防癌物质。Nzaramba等[97]研究发现S. jamesii Torr. 块茎提取物在体外对人体结肠癌和前列腺癌具有细胞毒性和抗增殖活性。研究表明,该提取物可显著降低结肠癌细胞HT-29和前列腺癌细胞的增殖率,且抑制前列腺癌细胞增殖所需的浓度较高。
2.5 抗氧化活性自由基是机体氧化反应中产生的有害物质,具有强氧化性,可损害机体的组织和细胞,进而引起慢性疾病和衰老效应。茄属植物的抗氧化活性主要源于其中含有的酚类化合物且其作用机制主要是抑制自由基的产生和清除自由基。Chellaram等[98]研究了马铃薯中酚类物质的量,并对其抗氧化能力进行了分析。研究表明,DPPH自由基清除活性实验表明,酚类物质是马铃薯产生抗自由基活性的主要物质。Jeong等[99]研究了龙葵中的露那辛(lunasin)多肽可阻断芬顿反应,抑制羟基自由基的产生,保护DNA免受氧化性损伤。Pihlanto等[100]研究发现,从马铃薯块茎中分离出来的蛋白质具有抑制血管紧张素转换酶(ACE)活性和自由基清除的能力。研究结果表明:其水解物的ACE抑制能力较高,且所有的样品均表现出较低的自由基清除活性。Oszmianski等[101]研究了S. scabrum Mill. 和S. burbankii Bitter的浆果中的酚类化合物及其抗氧化活性,实验证明,前者含有更多的酚类化合物且具有更高的抗氧化活性。
2.6 抗真菌、抗病毒活性Javed等[102]研究发现龙葵种子的氯仿提取物可降低丙型肝炎病毒(HCV)NS3蛋白酶的表达且呈剂量依赖的关系。Harikrishnan等[103]发现龙葵提取物可增强斑节对虾免疫反应和抵抗疾病的能力。龙葵提取物在0.1%和1.0%剂量下可作为免疫增强剂,抵抗哈维氏弧菌。
2.7 调血脂、降血糖活性Elekofehinti等[104]研究了S. anguivi(African eggplant)果实中的皂苷对四氧嘧啶诱导的糖尿病大鼠的作用,研究结果表明该果实中的皂苷可以显著地降低血糖及调节血脂水平,并可用于糖尿病的预防和治疗。Poongothai等[105]进行了龙葵叶水提物在四氧嘧啶诱导的糖尿病大鼠中潜在的抗糖尿病和调血脂作用的评价研究。结果表明,龙葵叶水提物治疗组的糖尿病大鼠血糖水平与糖尿病对照组相比显著降低,且血脂水平得到显著控制。
2.8 其他作用茄属植物的生物活性还有灭螺[106]、抗炎[61, 68, 107]、抗惊厥[108]等。Lee等[61]从S. macaonense中分离得到了8个新的螺甾皂苷和10个新的呋甾皂苷,并进行了体外抗中性粒细胞炎症实验,其中化合物193、201、202表现出显著的抑制超氧阴离子的产生和弹性蛋白酶的释放的能力,从而表现出抗炎活性,而macaoside A、D只抑制弹性蛋白酶的释放,192只抑制超氧阴离子的产生。Emmanuel等[108]研究了S. trilobatum L. 的抗炎活性。通过实验研究证明,澳洲茄胺、β-谷甾醇以及S. trilobatum的甲醇提取物对角叉菜胶诱导的大鼠爪水肿均具有抗炎活性(炎症反应显著减少),且S. trilobatum的甲醇提取物的抗炎效果接近于保泰松。
3 毒性茄属植物中毒表现为胃肠刺激和中枢神经系统的抑制反应。张海华[2]报道了食用马铃薯引起龙葵素中毒20例分析。分析结果表明,吃极少量的龙葵素(solanine)对人体不一定有明显的害处,多食(约200 mg)可发生龙葵素中毒。龙葵素具有腐蚀性,对胃肠道黏膜具有强刺激作用,轻者可出现恶心、呕吐、腹痛、腹泻等症状;重者血压下降;严重者出现抽搐、休克、昏迷甚至死亡。Vireque等[106]研究了S. lycocarpum对雄性小鼠和大鼠生殖系统的毒性。结果表明,该植物对小鼠可能存在抗雄激素作用,但对于大鼠在实验中给予剂量条件下无明显的抗生育作用。
4 结语茄属植物常作为我国的传统中药材而广泛使用,各省均出产,其物种在全世界也都有分布。茄属植物对于人类来说是非常重要的一类植物,提供给人类多种食物和药物。茄属植物品种繁多,化学成分复杂,一般都含有不同量的生物碱,具有一定的毒性。近年来其丰富的化学成分与多样的生物活性引起了众多学者的研究热情,国内外学者对其不断探索,已取得相当可观的研究成果,为今后的研究奠定了深厚的基础。
| [1] | 中国科学院植物研究所. 中国植物志(第67卷第1分册)[M]. 北京:科学出版社, 1978. |
| [2] | 张海华. 食用马铃薯引起龙葵素中毒20例分析[J]. 右江医学, 2012, 40(2):250-252. |
| [3] | 谢纲, 李冲. 茄属植物化学成分和生物活性[J]. 国外医药:植物药分册, 2006, 21(2):63-65. |
| [4] | Kim Y C, Che Q M, Gunatilaka A A L, et al. Bioactive steroidal alkaloids from Solanum umbelliferum[J]. J Nat Prod, 1996, 59(3):283-285. |
| [5] | Yoshikawa M, Nakamura S, Ozaki K, et al. Structures of steroidal alkaloid oligoglycosides, robeneosides and B, and antidiabetogenic constituents from the Brazilian medicinal plant Solanum lycocarpum[J]. J Nat Prod, 2007, 70(2):210-214. |
| [6] | Torres M C M, Pinto F C L, Braz-Filho R, et al. Antiophidic solanidane steroidal alkaloids from Solanum campaniforme[J]. J Nat Prod, 2011, 74(10):2168-2173. |
| [7] | Torres M C M, Jorge R J B, Ximenes R M, et al. Solanidane and iminosolanidane alkaloids from Solanum campaniforme[J]. Phytochemistry, 2013, 96(12):457-464. |
| [8] | Sun J, Huo H X, Zhang J, et al. Phenylpropanoid amides from the roots of Solanum melongena L. (Solanaceae)[J]. Biochem Syst Ecol, 2015, 58:265-269. |
| [9] | 舒伟虎, 周光雄, 叶文才. 水茄的化学成分研究[J]. 中草药, 2011, 42(3):424-427. |
| [10] | 任燕, 沈莉, 戴胜军. 白英中的黄酮及酰胺类化合物[J]. 中国中药杂志, 2009, 34(6):721-723. |
| [11] | Yen C T, Lee C L, Chang F R, et al. Indiosides G-K:Steroidal glycosides with cytotoxic and anti-inflammatory activities from Solanum violaceum[J]. J Nat Prod, 2012, 75(4):636-643. |
| [12] | Liu X, Luo J, Kong L. Phenylethyl cinnamides as potential alpha-glucosidase inhibitors from the roots of Solanum melongena[J]. Nat Prod Commun, 2011, 6(6):851-853. |
| [13] | 谢纲, 段文达, 陶保全, 等. 青杞的化学成分研究[J]. 天然产物研究与开发, 2008, 20(4):627-629. |
| [14] | 赵莹. 两种茄属植物化学成分分离、微生物转化及生物活性研究[D]. 济南:山东大学, 2010. |
| [15] | Wanyonyi A W, Chhabra S C, Mkoji G, et al. Bioactive steroidal alkaloid glycosides from Solanum aculeastrum[J]. Phytochemistry, 2002, 59(1):79-84. |
| [16] | Nakamura S, Hongo M, Sugimoto S, et al. Steroidal saponins and pseudoalkaloid oligoglycoside from Brazilian natural medicine, "fruta do lobo" (fruit of Solanum lycocarpum)[J]. Phytochemistry, 2008, 69(7):1565-1572. |
| [17] | Lu Y Y, Luo J G, Kong L Y. Steroidal alkaloid saponins and steroidal saponins from Solanum surattense[J]. Phytochemistry, 2011, 72(7):668-673. |
| [18] | Manase M J, Mitaine-Offer A C, Pertuit D, et al. Solanum incanum and S. heteracanthum as sources of biologically active steroid glycosides:Confirmation of their synonymy[J]. Fitoterapia, 2012, 83(6):1115-1119. |
| [19] | Usubillaga A, Aziz I, Tettamanzi M C, et al. Steroidal alkaloids from Solanum sycophanta[J]. Phytochemistry, 1997, 44(3):537-543. |
| [20] | Ripperger H, Porzel A. Steroidal alkaloid glycosides from Solanum suaveolens[J]. Phytochemistry, 1997, 46(7):1279-1282. |
| [21] | Ding X, Zhu F S, Yang Y, et al. Purification, antitumor activity in vitro of steroidal glycoalkaloids from black nightshade (Solanum nigrum L.)[J]. Food Chem, 2013, 141(2):1181-1186. |
| [22] | Lorey S, Porzel A, Ripperger H. Steroid alkaloid glycosides from Solanum coccineum[J]. Phytochemistry, 1996, 41(6):1633-1635. |
| [23] | Maxwell A, Seepersaud M, Pingal R, et al. Two 3α-aminospirosolane steroidal alkaloids from Solanum triste[J]. J Nat Prod, 1996, 59(2):200-201. |
| [24] | Maxwell A, Pingal R, Reynolds W F, et al. 3-Aminospirosolane alkaloids from Solanum arboreum[J]. Phytochemistry, 1996, 43(4):913-915. |
| [25] | Ripperger H. 22,26-Epiminocholestane alkaloids with unusual (20R)-configurations from Solanum species[J]. Phytochemistry, 1996, 41(6):1629-1631. |
| [26] | Maxwell A, Pingal R, Reynolds W F, et al. Two steroidal glycoalkaloids from Solanum arboreum[J]. Phytochemistry, 1996, 42(2):543-545. |
| [27] | Nawaz H, Ahmed E, Sharif A, et al. Two new steroidal glycosides from Solanum surattense[J]. Chem Nat Compd, 2014, 49(6):1091-1094. |
| [28] | Mweetwa A M, Hunter D, Poe R, et al. Steroidal glycoalkaloids in Solanum chacoense[J]. Phytochemistry, 2012, 75(3):32-40. |
| [29] | Wang S, Panter K E, Gaffield W, et al. Effects of steroidal glycoalkaloids from potatoes (Solanum tuberosum) on in vitro bovine embryo development[J]. Anim Reprod Sci, 2005, 85(3):243-250. |
| [30] | Coelho R M, De Souza M C, Sarragiotto M H. Steroidal alkaloid glycosides from Solanum orbignianum[J]. Phytochemistry, 1998, 49(3):893-897. |
| [31] | Al-Rehaily A J, Ahmad M S, Mustafa J, et al. Solanopubamine, a rare steroidal alkaloid from Solanum schimperianum:synthesis of some new alkyl and acyl derivatives, their anticancer and antimicrobial evaluation[J]. J Saudi Chem Soc, 2013, 17(1):67-76. |
| [32] | Nikolic N C, Stankovic M Z. Solanidine hydrolytic extraction and separation from the potato (Solanum tuberosum L.) vines by using solid-liquid-liquid systems[J]. J Agric Food Chem, 2003, 51(7):1845-1849. |
| [33] | El Sayed K A, Hamann M T, Abd El-Rahman H A, et al. New pyrrole alkaloids from Solanum sodomaeum[J]. J Nat Prod, 1998, 61(6):848-850. |
| [34] | Ripperger H. Steroidal alkaloids from roots of Solanum spirale[J]. Phytochemistry, 1996, 43(3):705-707. |
| [35] | Cheng F, Li X, Wang J Z. A new alkaloid from Solanum cathayanum[J]. Chin Chem Lett, 2008, 19(1):68-70. |
| [36] | 吴丹, 陈光英, 韩长日, 等. 疏刺茄的化学成分研究[A]//第十届全国药用植物及植物药学术研讨会论文集[C]. 昆明:中国植物学会, 2011. |
| [37] | 吴丹, 陈光英, 韩长日, 等. 疏刺茄的化学成分研究(I)[J]. 中草药, 2012, 43(6):1068-1070. |
| [38] | Lu Y Y, Luo J G, Kong L Y. Chemical constituents from Solanum torvum[J]. Chin J Nat Med, 2011, 9(1):30-32. |
| [39] | Ohtsuki T, Miyagawa T, Koyano T, et al. Isolation and structure elucidation of flavonoid glycosides from Solanum verbascifolium[J]. Phytochem Lett, 2010, 3(2):88-92. |
| [40] | Al-Oqail M, Hassan W H B, Ahmad M S, et al. Phytochemical and biological studies of Solanum schimperianum Hochst[J]. Saudi Pharm J, 2012, 20(4):371-379. |
| [41] | Rashed K, Sahuc M E, Deloison G, et al. Potent antiviral activity of Solanum rantonnetii and the isolated compounds against hepatitis C virus in vitro[J]. J Funct Foods, 2014, 11:185-191. |
| [42] | 杨丽, 冯锋, 高源. 白英的化学成分研究[J]. 中国中药杂志, 2009, 34(14):1805-1808. |
| [43] | Abdel-Sattar E, Farag M A, Mahrous E A. Chemical constituents from Solanum glabratum Dunal var. sepicula[J]. Records Nat Prod, 2015, 9(1):94-104. |
| [44] | Júnior G M V, da Rocha C Q, de Souza Rodrigues T, et al. New steroidal saponins and antiulcer activity from Solanum paniculatum L.[J]. Food Chem, 2015, 186:160-167. |
| [45] | 纪耀华, 孙莹, 惠春. 茄茎中化学成分研究[J]. 时珍国医国药, 2009, 20(10):2431-2432. |
| [46] | 孙立新, 李凤荣, 王承军, 等. 白英化学成分的分离与鉴定[J]. 沈阳药科大学学报, 2008, 25(5):364-366. |
| [47] | 郝丽娟, 王珊, 朱晶晶, 等. 刺萼龙葵化学成分研究[J]. 中国中药杂志, 2014, 39(11):2034-2048. |
| [48] | 舒伟虎, 张英, 叶文才. 水茄中的苷类化学成分[J]. 暨南大学学报:自然科学版, 2011, 32(5):493-497. |
| [49] | 汪云松, 李祖强, 杨靖华, 等. 刺天茄化学成分研究[J]. 云南大学学报:自然科学版, 1998, 20(S3):396-398. |
| [50] | Eichhorn S, Winterhalter P. Anthocyanins from pigmented potato (Solanum tuberosum L.) varieties[J]. Food Res Int, 2005, 38(8):943-948. |
| [51] | Arthan D, Svasti J, Kittakoop P, et al. Antiviral isoflavonoid sulfate and steroidal glycosides from the fruits of Solanum torvum[J]. Phytochemistry, 2002, 59(4):459-463. |
| [52] | Li J S, Zhang L, Huang C, et al. Five new cyotoxic steroidal glycosides from the fruits of Solanum torvum[J]. Fitoterapia, 2014, 93:209-215. |
| [53] | Lu Y Y, Luo J G, Huang X F, et al. Four new steroidal glycosides from Solanum torvum and their cytotoxic activities[J]. Steroids, 2009, 74(1):95-101. |
| [54] | Chang F R, Yen C T, El-Shazly M, et al. Spirostanoids with 1,4-dien-3-one or 3β,7α-diol-5,6-ene moieties from Solanum violaceum[J]. Bioorg Med Chem Lett, 2013, 23(9):2738-2742. |
| [55] | Yahara S, Yamashita T, Nozawa N, et al. Steroidal glycosides from Solanum torvum[J]. Phytochemistry, 1996, 43(5):1069-1074. |
| [56] | Lee C L, Hwang T L, He W J, et al. Anti-neutrophilic inflammatory steroidal glycosides from Solanum torvum[J]. Phytochemistry, 2013, 95:315-321. |
| [57] | Colmenares A P, Rojas L B, Mitaine-Offer A C, et al. Steroidal saponins from the fruits of Solanum torvum[J]. Phytochemistry, 2013, 86:137-143. |
| [58] | 尹海龙, 李建, 董俊兴. 白英的化学成分研究(II)[J]. 军事医学. 2013, 37(4):279-282. |
| [59] | López M L, Vommaro R, Zalis M, et al. Induction of cell death on Plasmodium falciparum asexual blood stages by Solanum nudum steroids[J]. Parasitol Int, 2010, 59(2):217-225. |
| [60] | Saez J, Cardona W, Espinal D, et al. Five new steroids from Solanum nudum[J]. Tetrahedron, 1998, 54(36):10771-10778. |
| [61] | Lee C L, Hwang T L, Yang J C, et al. Anti-Inflammatory spirostanol and furostanol saponins from Solanum macaonense[J]. J Nat Prod, 2014, 77(8):1770-1783. |
| [62] | Zamilpa A, Tortoriello J, Navarro V, et al. Five new steroidal saponins from Solanum chrysotrichum leaves and their antimycotic activity[J]. J Nat Prod, 2002, 65(12):1815-1819. |
| [63] | Honbu T, Ikeda T, Zhu X H, et al. New steroidal glycosides from the fruits of Solanum anguivi[J]. J Nat Prod, 2002, 65(12):1918-1920. |
| [64] | Yahara S, Nakamura T, Someya Y, et al. Steroidal glycosides, indiosides A-E, from Solanum indicum[J]. Phytochemistry, 1996, 43(6):1319-1323. |
| [65] | Aguilar-Santamaría L, Herrera-Arellano A, Zamilpa A, et al. Toxicology, genotoxicity, and cytotoxicity of three extracts of Solanum chrysotrichum[J]. J Ethnopharmacol, 2013, 150(1):275-279. |
| [66] | González M, Zamilpa A, Marquina S, et al. Antimycotic spirostanol saponins from Solanum hispidum leaves and their structure-activity relationships[J]. J Nat Prod, 2004, 67(6):938-941. |
| [67] | Zhou X L, He X J, Wang G H, et al. Steroidal saponins from Solanum nigrum[J]. J Nat Prod, 2006, 69:1158-1163. |
| [68] | Ferreira F, Soulé S, Vazquez A, et al. Steroid saponins from Solanum laxum[J]. Phytochemistry, 1996, 42(5):1409-1416. |
| [69] | Ferro E A, Alvarenga N L, Ibarrola D A, et al. A new steroidal saponin from Solanum sisymbriifolium roots[J]. Fitoterapia, 2005, 76(6):577-579. |
| [70] | Putalun W, Xuan L J, Tanaka H, et al. Solakhasoside, a novel steroidal saponin from Solanum khasianum[J]. J Nat Prod, 1999, 62(1):181-183. |
| [71] | Tagawa C, Okawa M, Ikeda T, et al. Homo-cholestane glycosides from Solanum aethiopicum[J]. Tetrahedron Lett, 2003, 44(26):4839-4841. |
| [72] | 周新兰, 何祥久, 周光雄, 等. 龙葵全草皂苷类化学成分研究[J]. 中草药, 2006, 37(11):1618-1621. |
| [73] | Yoshimitsu H, Nishida M, Nohara T. Steroidal glycosides from the fruits of Solanum abutiloides[J]. Phytochemistry, 2003, 64(8):1361-1366. |
| [74] | Zhou X L, He X J, Zhou G X, et al. Pregnane glycosides from Solanum nigrum[J]. J Asian Nat Prod Res, 2007, 9(6):517-523. |
| [75] | 赵莹, 刘飞, 娄红祥. 龙葵化学成分研究[J]. 中药材, 2010, 33(4):555-556. |
| [76] | Zhu X H, Takagi M, Ikeda T, et al. Withanolide-type steroids from Solanum cilistum[J]. Phytochemistry, 2001, 56(7):741-745. |
| [77] | Chakravarty A K, Mukhopadhyay S, Saha S, et al. A neolignan and sterols in fruits of Solanum sisymbrifolium[J]. Phytochemistry, 1996, 41(3):935-939. |
| [78] | Pabón A, Deharo E, Blair S. Plasmodium falciparum:Solanum nudum SN-1 steroid antiplasmodial activity when combined with antimalarial drugs[J]. Exp Parasitol, 2011, 127(1):222-227. |
| [79] | Tian R H, Ohmura E, Matsui M, et al. Abutiloside A, a 26-acylamino-3β,16α-dihydroxy-5α-cholesta-22-one glycoside from Solanum abutiloides[J]. Phytochemistry, 1997, 44(4):723-726. |
| [80] | Yoshimitsu H, Nishida M, Nohara T. Cholestane glycosides from Solanum abutiloides. III[J]. Chem Pharm Bull (Tokyo), 2000, 48(4):556-558. |
| [81] | Yao F, Song Q L, Zhang L, et al. Three new cytotoxic sesquiterpenoids from Solanum lyratum[J]. Phytochem Lett, 2013, 6(3):453-456. |
| [82] | Li G S, Yao F, Zhang L, et al. Two new cytotoxic sesquiterpenoids from Solanum lyratum[J]. Chin Chem Lett, 2013, 24(11):1030-1032. |
| [83] | Wu S B, Meyer R S, Whitaker B D, et al. Antioxidant glucosylated caffeoylquinic acid derivatives in the invasive tropical soda apple, Solanum viarum[J]. J Nat Prod, 2012, 75(12):2246-2250. |
| [84] | Yin H L, Li J H, Li J, et al. Four new coumarinolignoids from seeds of Solanum indicum[J]. Fitoterapia, 2013, 84:360-365. |
| [85] | 李杰辉, 尹海龙, 董俊兴, 丁茄苯丙素类化学成分研究[J]. 军事医学, 2013, 37(2):130-134. |
| [86] | Yao F, Song Q L, Zhang L, et al. Solajiangxins A-C, three new cytotoxic sesquiterpenoids from Solanum lyratum[J]. Fitoterapia, 2013, 89:200-204. |
| [87] | Herrera-Salgado Y, Garduño-Ramírez M L, Vázquez L, et al. Myo-inositol-derived glycolipids with antiinflammatory activity from Solanum lanceolatum[J]. J Nat Prod, 2005, 68(7):1031-1036. |
| [88] | Lin H M, Tseng H C, Wang C J, et al. Hepatoprotective effects of Solanum nigrum Linn extract against CCl4-iduced oxidative damage in rats[J]. Chem Biol Int, 2008, 171(3):283-293. |
| [89] | Hsieh C C, Fang H L, Lina W C. Inhibitory effect of Solanum nigrum on thioacetamide-induced liver fibrosis in mice[J]. J Ethnopharmacol, 2008, 119(1):117-121. |
| [90] | Hussain T, Gupta R K, Sweety K, et al. Nephroprotective activity of Solanum xanthocarpum fruit extract against gentamicin-induced nephrotoxicity and renal dysfunction in experimental rodents[J]. Asian Pac J Trop Med, 2012, 5(9):686-691. |
| [91] | Kumar V P, Shashidhara S, Kumar M M, et al. Cytoprotective role of Solanum nigrum against gentamicin-induced kidney cell (Vero cells) damage in vitro[J]. Fitoterapia, 2001, 72(5):481-486. |
| [92] | Mesia-Vela S, Santos M T, Souccar C, et al. Solanum paniculatum L. (Jurubeba):Potent inhibitor of gastric acid secretion in mice[J]. Phytomedicine, 2002, 9(6):508-514. |
| [93] | Jainu M, Devi C S S. Antiulcerogenic and ulcer healing effects of Solanum nigrum (L.) on experimental ulcer models:possible mechanism for the inhibition of acid formation[J]. J Ethnopharmacol, 2006, 104(1):156-163. |
| [94] | Wang H C, Wu D H, Chang Y C, et al. Solanum nigrum Linn. water extract inhibits metastasis in mouse melanoma cells in vitro and in vivo[J]. J Agric Food Chem, 2010, 58(22):11913-11923. |
| [95] | Li J, Li Q W, Feng T, et al. Aqueous extract of Solanum nigrum inhibit growth of cervical carcinoma (U14) via modulating immune response of tumor bearing mice and inducing apoptosis of tumor cells[J]. Fitoterapia, 2008, 79(7):548-556. |
| [96] | Son Y O, Kim J, Lim J C, et al. Ripe fruits of Solanum nigrum L. inhibits cell growth and induces apoptosis in MCF-7 cells[J]. Food Chem Tox, 2003, 41(10):1421-1428. |
| [97] | Nzaramba M N, Reddivari L, Bamberg J B, et al. Antiproliferative activity and cytotoxicity of Solanum jamesii tuber extracts on human colon and prostate cancer cells in vitro[J]. J Agric Food Chem, 2009, 57(18):8308-8315. |
| [98] | Chellaram C, Parthasarathy V, Praveen M M, et al. Analysis of phenolic content and antioxidant capacity of potato, Solanum Tuberosum L. from Tamilnadu Region, India[J]. APCBEE Procedia, 2014, 8:105-108. |
| [99] | Jeong J B, Ben O, Jeong H J. Lunasin peptide purified from Solanum nigrum L. protects DNA from oxidative damage by suppressing the generation of hydroxyl radical via blocking fenton reaction[J]. Cancer Lett, 2010, 293(1):58-64. |
| [100] | Pihlanto A, Akkanen S, Korhonen H J. ACE-inhibitory and antioxidant properties of potato (Solanum tuberosum)[J]. Food Chem, 2008, 109(1):104-112. |
| [101] | Oszmianski J, Kolniak-Ostek J, Wojdylo A. Characterization of phenolic compounds and antioxidant activity of Solanum scabrum and Solanum burbankii Berries[J]. J Agric Food Chem, 2014, 62(7):1512-1519. |
| [102] | Javed T, Ashfaq U A, Riaz S, et al. In vitro antiviral activity of Solanum nigrum against Hepatitis C virus[J]. Virol J, 2011, 8(1):1. |
| [103] | Harikrishnan R, Balasundaram C, Jawahar S, et al. Solanum nigrum enhancement of the immune response and disease resistance of tiger shrimp, Penaeus monodon against Vibrio harveyi[J]. Aquaculture, 2011, 318(1):67-73. |
| [104] | Elekofehinti O O, Kamdem J P, Kade I J, et al. Hypoglycemic, antiperoxidative and antihyperlipidemic effects of saponins from Solanum anguivi Lam. fruits in alloxan-induced diabetic rats[J]. South Afr J Bot, 2013, 88:56-61. |
| [105] | Poongothai K, Ahmed K, Ponmurugan P, et al. Assessment of antidiabetic and antihyperlipidemic potential of Solanum nigrum and Musa paradisiaca in alloxan induced diabetic rats[J]. J Pharmacy Res, 2010, 3(9):2203-2205. |
| [106] | Vireque A A, de P Reis J E, de O Guerra M. Evaluation of the toxicity of Solanum lycocarpum in the reproductive system of male mice and rats[J]. J Ethnopharmacol, 2000, 73(1):283-287. |
| [107] | Rawani A, Ghosh A, Chandra G. Laboratory evaluation of molluscicidal & mosquito larvicidal activities of leaves of Solanum nigrum L.[J]. Indian J Med Res, 2014, 140(2):285-295. |
| [108] | Emmanuel S, Ignacimuthu S, Perumalsamy R, et al. Antiinflammatory activity of Solanum trilobatum[J]. Fitoterapia, 2006, 77(7):611-612. |
| [109] | Son H L, Yen P T H. Preliminary phytochemical screening, acute oral toxicity and anticonvulsant activity of the berries of Solanum nigrum Linn.[J]. Trop J Pharm Res, 2014, 13(6):907-912. |
 2016, Vol. 47
2016, Vol. 47


