连翘Forsythiae Fructus是木犀科(Oleaceae)植物连翘Forsythia suspensa (Thunb.) Vahl的干燥果实,味苦,性微寒,具有清热解毒、散结消肿之功效[1]。连翘主产于山西、河南、陕西等地,山西是连翘的道地产区,资源丰富,而且不同产地连翘药材在产量、质量、有效成分种类和量等有一定差异[2]。近年来,RAPD技术广泛应用于中药材的鉴定分析等研究中[3, 4, 5, 6, 7, 8, 9],但应用RAPD技术研究连翘药用植物遗传多样性的工作很少见文献报道。本研究以14批不同产地连翘药材,以山西道地产区为主要研究对象,运用RAPD技术分析不同产地连翘的遗传多样性,并进行聚类分析,建立其特征性的DNA指纹图谱,为连翘的道地性、繁育栽培、遗传育种和GAP种植等提供理论依据和方法措施。
1 材料和方法 1.1 材料 1.1.1 药材样品连翘新鲜果实在2012年7~8月采集于山西、陕西、河北及河南产地,经山西中医学院中药鉴定教研室裴香萍副教授鉴定均为连翘Forsythia suspensa (Thunb.) Vahl(-76 ℃冷存)[10],见表 1。
|
|
表 1 14批连翘药材的来源 Table 1 Sources of 14 batches of Forsythiae Fructus |
随机引物(Sangon),Taq酶(TaKaRa),dNTP(TaKaRa),AgaroseVI(BBI),CTAB(Amresco),PVP(Amresco),EDTA-Na2(BBI),Tris(BBI),β-巯基乙醇(BBI),其余试剂均为分析纯。
1.1.3 仪器设备TC-XP型基因扩增仪(杭州博日科技有限公司);BIOSpectrumAC凝胶成像系统(美国UVP);EPPENDORF BioPhotometer核酸蛋白测定仪(德国Eppendorf);BIO-RAD电泳仪;Sigma3K-30型高速冷冻离心机(德国Sartorius);LMQ.R-3260B立式灭菌器(山东新华医疗器械股份有限公司);PHS-3C数显酸度计(上海宇隆仪器有限公司);数显恒温水浴锅(上海申腾生物技术有限公司)。
1.2 方法 1.2.1 DNA提取与检测采用本实验室建立的DNA提取方法[10]。取冷存的连翘药材,迅速加入液氮研磨成细粉,精取30 mg置于2.0 mL EP管中,分别加入1 mL的Tris-HCl(1.0 mol/L)、NaCl(5.0 mol/L)、EDTA-Na2(0.5 mol/L)、β-巯基乙醇、PVP-40T与dH2O混合制备的预冷提取液1,65 ℃水浴10 min,离心10 min(10 000 r/min),去除上清液,直到上清 液不黏稠为止;再分别加入1 mL Tris-HCl(1.0 mol/L)、NaCl(5.0 mol/L)、EDTA-Na2(0.5 mol/L)、PVP-40T、CTAB、β-巯基乙醇、抗坏血酸、硫酸氢钠与dH2O制备的提取液2,65 ℃水浴1 h,每隔20 min轻摇1次;取出加入异戊醇-氯仿(1∶24)700 μL,离心10 min(10 000 r/min),取上清液于干净的EP管中,重复此方法,直到两液面无沉淀,迅速加入提前预冷的异丙醇500 μL、95%乙醇500 μL与NaCl溶液100 μL,轻摇混匀后放置冰箱中1 h(-20 ℃),12 000 r/min离心20 min,去除上清液,用75%乙醇反复洗涤3次(12 000 r/min,离心5 min),放置于超净台,直到乙醇完全风干,100 μL TE溶解用于电泳检测及核酸蛋白测定仪检测其浓度,挑选出条带清晰可见的,于冰箱中保存备用(-76 ℃)。
1.2.2 PCR扩增与引物筛选1 μL LDNA原液、0.5 μmol/L Primer、5 U Taq、10×buffer、110 μmol/L dNTP、2.5 mmol/L MgCl2混合而成的15 μL反应体系进行扩增。采用本实验室所建立的扩增反应程序[10]:94 ℃预变性5 min,94 ℃变性1 min,36 ℃退火105 s,72 ℃延伸90 s,40个循环,72 ℃延伸5 min,4 ℃降温10 min。其产物用1.0%琼脂糖凝胶电泳进行分离,凝胶成像系统拍照并分析。
RAPD随机引物选用上海Sangon生产的10个碱基随机引物(S81~S125),共计45个引物。每个引物以不同产地连翘DNA为模板进行RAPD引物筛选,产物以1.0%琼脂糖凝胶电泳检测,筛选出扩增条带多、稳定、清晰及多态性好的引物共11条,见表 2。
|
|
表 2 RAPD引物序列和扩增结果 Table 2 Sequences of RAPD primers and amplification results |
统计筛选出的11条RAPD随机引物扩增出的清晰可读条带,将每个条带看做是一个遗传位点,用数字“1” “0”表示扩增片段的有无,所得数据用NTSYS-pc2.1软件计算材料间的遗传相似系数,应用UPGMA法进行聚类分析。
2 结果与分析 2.1 不同产地连翘DNA指纹图谱构建与多态性分析从45条随机引物中共筛选出11条适合于14批连翘药材的RAPD随机引物,以筛选出的11条引物对14批连翘药材进行RAPD扩增,其扩增结果见图 1。用11条RAPD引物扩增14批连翘药材,共获得80条谱带,平均每个引物扩增出7.27条谱带,其中多态性谱带67条,多态性条带比率为83.8%,表明供试的14批连翘药材遗传多样性比较丰富,是连翘药材遗传多样性与亲缘关系的一种有效分子标记,见表 2。利用筛选出的11条引物扩增的多态性指纹位点数据,建立起不同产地连翘药材的DNA指纹数据库,进行14批不同来源连翘药材的鉴别分析。

|
图 1 11条引物对14批连翘药材的扩增图谱 Fig. 1 Fourteen batches of Forsythiae Fructus RAPD patterns amplified by 11 primers |
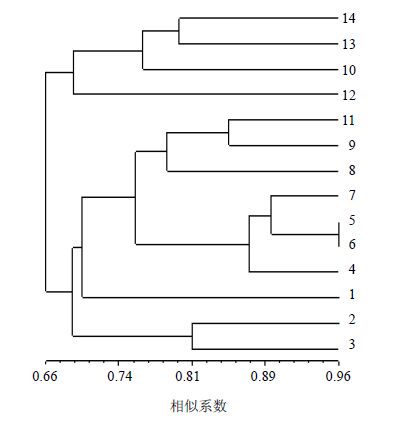
基于RAPD扩增谱带,用UPGMA聚类分析方法对14批次连翘药材进行聚类分析。从聚类结果看,说明14批连翘药材间的遗传多样性比较丰富,结果见表 3和图 2。
|
图 2 14 批连翘药材的UPGMA 聚类图 Fig. 2 Dendrogram of cluster of 14 batches of Forsythiae Fructus analyzed by UPGMA |
|
|
表 3 14批连翘药材的遗传相似系数 Table 3 Genetic similarity of 14 batches of Forsythiae Fructus |
药材间的遗传相似系数(genetic similarity,GS)越小,表明亲缘关系越远,14批不同产地连翘药材间的GS在0.487 5~0.962 5,遗传距离(GD=1-GS)在0.037 5~0.512 5,其中5号与6号样品GS为0.962 5,说明这2个批次亲缘关系最近;6号与12号样品GS为0.487 5,说明两者的亲缘关系最远。
2.2.2 聚类分析在遗传相似系数0.672处划分,可将14批连翘药材分成2大类,其中第1类10批连翘药材来源于山西,说明遗传亲缘关系较密切;第2类4批连翘药材来源于河北、河南、陕西,与第1类山西连翘药材亲缘关系远、遗传差异性大。在遗传相似系数0.74处划分,可将14批连翘药材分成5大类,具有比较明显的来源地分布特征,河北涉县独聚一类,可明显区分其他产地,河南与陕西有2个分支也可区分,说明不同来源地连翘药材遗传分化比较明显;而全部来源于山西连翘药材又分为3大类,分类为左权、太原及其余7批山西连翘药材,左权与太原连翘药材可明显区别于其他山西产地药材,而其余7批连翘药材又有明显的分支,可见同产于晋南的连翘药材遗传分化相对也明显。
3 讨论RAPD分子标记技术广泛应用于中药来源及品质的鉴定,具有方便快速、DNA需要量少、显性遗传等优点,但也存在扩增条带稳定性差、重复性低等问题[11]。为了保证实验的精确性,本实验严格控制反应条件的标准性,每个引物多次重复,统计稳定出现、重复性高的条带并进行遗传分析,获得可靠的实验数据,最终得出能真实反映各来源连翘药材的遗传特征。
顾华等[12]研究发现山西连翘栽培的品系间在DNA水平上存在明显的多样性变异,而且DNA分子多样性差异与化学指标成分量差异有关,表明连翘的遗传基础可能对化学指标成分的形成和积累有显著的影响,运用RAPD技术进行连翘药材道地性研究具有可行性。本研究运用RAPD标记技术对14批不同产地连翘药材进行遗传多样性分析并构建指纹图谱,GS在0.487 5~0.962 5,结果显示不同产地药材间的遗传多样性比较丰富。实验结果表明山西产地连翘亲缘关系相对较近,且能与河南、河北、陕西产地连翘药材进行区分,但其遗传特征又有分支并出现遗传关系的相对分化。筛选出的11条RAPD随机引物基本可以区分不同省份或不同市区产地的连翘药材,其构建的指纹图谱可用于不同产地连翘药材的分类和鉴定。若要鉴定大范围来源的连翘药材时,可能会出现同一引物在不同来源中扩增出相同谱带的现象,对此要结合不同分子标记和增加引物数等方法来区分不同来源连翘药材。这些结果为进一步研究山西连翘药材遗传信息与活性成分、生物效应之间的相关性奠定基础,进而建立体现山西连翘“道地性”特色的品质评价新方法。
| [1] | 中国药典[S]. 一部. 2010. |
| [2] | 支旭然, 苑霖, 生宁, 等. HPLC-MS/MS法测定不同采收期连翘叶中9种成分[J]. 中草药, 2013, 44(22):3231-3235. |
| [3] | 周佐斌, 葛刚. 中药材道地性的DNA分子鉴别[J]. 江西科学, 2008, 26(3):507-510. |
| [4] | 杨飞, 张敏彭, 兴扬. 金银花五个品系的RAPD分析及DNA指纹图谱的建立[J]. 武汉植物学研究, 2007, 25(3):235-238. |
| [5] | 严奉坤, 许兴, 杨亚亚, 等. 同一品种不同产地宁夏枸杞DNA指纹图谱特征研究[J]. 海峡药学, 2007, 18(10):2385-2386. |
| [6] | 陈刚, 刘津, 马志刚, 等. 甘肃枸杞属植物的RAPD分析[J]. 安徽农业科学, 2013, 41(4):1459-1461. |
| [7] | 刘文生, 朱建明, 何斌, 等. 中药材厚朴的随机扩增多态性DNA指纹图谱研究[J]. 中药材, 2004, 27(3):164-168. |
| [8] | 卢家仕, 卜朝阳, 吕维莉, 等. 不同产地石斛属种质资源的ISSR遗传多样性分析[J]. 中草药, 2013, 44(1):96-100. |
| [9] | 徐朝晖, 杨松松, 康廷国. 同种不同产地牛蒡子DNA指纹图谱特征研究[J]. 中药材, 2001, 32(6):541-542. |
| [10] | 吴婷, 米丽华, 张淑蓉. 不同产地连翘新鲜果实DNA提取方法和质量评价研究[J]. 世界中西医结合杂志, 2014, 9(7):720-722. |
| [11] | 魏瑜. RAPD技术在中药材道地性鉴定中的应用[J]. 海峡药学, 2008, 20(10):148-150. |
| [12] | 顾华, 盖玲, 周铜水, 等. 中药材连翘道地性的分子生物学探讨[J]. 复旦学报, 2002, 41(6):664-668. |
 2016, Vol. 47
2016, Vol. 47


