2. 湖南中医药大学第一附属医院神经内科, 湖南 长沙 410007
2. Department of Neurology, The First Affiliated Hospital of Hunan University of Traditional Chinese Medicine, Changsha 410007, China
缺血性脑卒中具有高发病率、高致残率、高致死率及高复发率等特点,严重威胁中老年人的生命健康,目前仍然缺乏安全、高效的治疗措施,因此,研究本病的防治具有重大的医学和社会意义。一方面,近年来,通过移植具有自我增殖、多向分化特点的间充质干细胞治疗缺血性脑卒中在实验研究中取得了一定进展,而来源广泛、含量丰富、低免疫原性的人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)更是引起了广泛关注[1];另一方面,长期临床实践和研究观察证明,传统中医药可显著改善脑卒中后遗症、提高患者生活质量,有望为本病的脑保护治疗开辟新的途径[2]。因此,本研究通过建立大鼠大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型,采用中药肾脑复元汤(SFD)联合hUC-MSCs移植,从神经营养因子表达等方面探究其对缺血性脑卒中的神经保护作用及机制,以寻求一种可靠有效的治疗方式。
1 材料 1.1 动物健康雄性SPF级SD大鼠,体质量(280±20)g,购自斯莱克景达实验动物公司,许可证号SYXK(湘)2011-0003,饲养于湖南中医药大学SPF级实验动物中心。
1.2 hUC-MSCs足月平产健康胎儿脐带从湖南中医药大学第一附属医院妇产科获得,实验经过医院伦理委员会批准,并与产妇及配偶签署脐带捐赠知情同意书。
1.3 药物及主要试剂SFD药材组成:熟地黄10 g、山茱萸10 g、山药15 g、黄芪30 g、红景天20 g、牡丹皮10 g、当归尾10 g、赤芍10 g、地龙10 g、丹参10 g、川芎10 g,以上药材均购自湖南中医药大学第一附属医院,并经该院药剂科刘红宇副主任药师鉴定,分别为玄参科植物地黄Rehmannia glutinosa Libosch. 的干燥块根、山茱萸科植物山茱萸Cornus officinalis Sieb. et Zucc. 的干燥成熟果实、薯蓣科植物薯蓣Dioscorea opposita Thunb. 干燥根茎、豆科植物膜荚黄芪Astragalus membranaceus (Fisch.) Bunge的干燥根、景天科植物红景天Rhodiola crenulata (Hook. f. et Thoms.) H. Ohba的干燥全草、毛茛科植物牡丹Paeonia suffruticosa Andr. 的干燥根皮、伞形科植物当归Angelica sinensis (Oliv.) Diels的干燥根、毛茛科植物川赤芍Paeonia veitchii Lynch. 的干燥根、巨蚓科动物通俗环毛蚓Pheretima vulgaris Chen. 的干燥体、唇形科植物丹参Salvia miltiorrhiza Bge. 的干燥根、伞形科植物川芎Ligusticum chuanxiong Hort. 的干燥根茎。
DMEM/F12、青/链霉素、胰蛋白酶、PBS(美国Hyclone公司);胎牛血清、干细胞成骨、成脂分化培养基(美国Gibico公司);FITC、PerCP、AlexaFluor、Qdot标记的CD90、CD34、CD73、CD105抗体(美国BD公司);茜素红、油红O(美国Sigma公司);兔抗大鼠脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)试剂盒(武汉博士德生物公司)。
1.4 主要仪器细胞培养箱(美国Thermo公司);倒置显微镜(日本Olympus公司);流式细胞仪(美国Becton Dickinson公司);石蜡切片机(德国Leica公司)。
2 方法 2.1 SFD的制备SFD复方由湖南中医药大学第一附属医院药剂科按比例水煎浓缩后制成口服液100 mL,并建立“一测多评”的质量控制方法[3],其主要药效成分为黄芪甲苷≥0.12 mg/mL、丹皮酚≥0.3 mg/mL、芍药苷≥0.21 mg/mL、丹参酮IIA≥0.02 mg/mL、川芎嗪≥0.4 mg/mL。
2.2 hUC-MSCs的培养和鉴定[4]2.2.1 hUC-MSCs原代培养
无菌采集脐带,用装有DMEM/F12的50 mL离心管运输,在超净台内将脐带的羊膜及血管分离,剩下的华通胶组织剪碎至2~3 mm3大小,平铺在T25培养瓶内;向培养瓶中滴加少量完全培养液(15%胎牛血清、84% DMEM/F12、1%青/链霉素)至浸润组织块即可;每天观察组织块,隔3~4 d半量换液1次,7~10 d可以观察到细胞从组织块边缘游离出来,细胞达到80%~90%融合度即可进行传代。
2.2.2 表面分子鉴定取一瓶90%融合度的第3代细胞,弃去培养液,PBS清洗2次,加入0.25%胰酶进行消化,2 min后加入2 mL完全培养基终止消化,1 000 r/min离心4 min;弃上清,加入100 μL PBS及5 μL抗体(CD90、CD34、CD73、CD105抗体),重悬细胞,避光室温孵育25 min;1 mL PBS洗2遍,100 μL PBS重悬细胞,流式细胞仪检测分析。
2.2.3 分化鉴定取第4代细胞,弃培养基,PBS洗2次,0.25%胰酶消化2 min后吹打、重悬,按每孔5×104个细胞的浓度接种到24孔板中,37 ℃、5% CO2、饱和湿度培养过夜;将培养液更换成成骨、成脂诱导培养基,每隔3 d全量换液1次,共诱导培养21 d;诱导结束后,弃培养液,PBS洗2次,每孔加入4%多聚甲醛1 mL固定30 min;弃固定液,PBS洗2次,分别采用茜素红和油红O对诱导分化的细胞进行染色,倒置显微镜下观察染色情况并拍照。
2.3 大鼠MCAO模型的制备采用改良Zea Longa法制备大鼠MCAO模型[5],2 h后拔除线栓,造成脑缺血后再灌注,假手术组只分离血管而不插入线栓;造模后采用Zea Longa 5分制神经功能评分初步评价造模情况[5],分值在1~3分者入组。
2.4 hUC-MSCs移植取第3~7代细胞,胰酶消化2 min后以PBS重悬,调整密度为2×106/mL,以1 mL EP管分装细胞悬液,每管0.5 mL;大鼠尾部用酒精擦拭后,以1 mL注射器穿刺尾静脉,回抽见血后将细胞悬液缓慢注射入尾静脉,完成后再缓慢补推0.5 mL PBS。
2.5 大鼠分组及给药将所有大鼠随机分为假手术组、模型组、SFD组、hUC-MSCs组、联合组(SFD+hUC-MSCs)。根据处死时间点随机分为造模后4、8、15 d 3个时相组,每组6只。造模24 h后,hUC-MSCs组及联合组大鼠尾iv移植1×106个hUC-MSCs,其余各组分别尾iv 1 mL PBS。造模后24 h开始给药,SFD组及联合组ig SFD,给药体积10 mL/kg,每天1次,直至处死。假手术组、模型组、hUC-MSCs组ig等体积的蒸馏水。前期研究证明,SFD剂量因素对MCAO大鼠疗效的影响差异不显著[6, 7],故本实验中选用临床使用中药剂量换算大鼠给药剂量,即根据70 kg成人每天服145 g生药进行换算,换算后ig SFD的生药量为11.6 g/kg,使用时蒸馏水稀释SFD口服液至给药体积。
2.6 指标检测 2.6.1 神经功能缺损评分各组大鼠在造模前24 h、造模后2 h、处死前采用改良大鼠神经功能缺损评分量表(modified-neurological severity scores,m-NSS)[8]进行评分:从肢体运动、感觉功能、平衡能力及生理反射对大鼠各项神经功能进行等级评分测定,正常记0分,异常者根据量表及严重程度记1~6分,总分为18分,分值越高表示神经功能损害越严重。
2.6.2 脑组织样本取材及处理10%水合氯醛ip麻醉大鼠,生理盐水灌注,冰块上断头取脑,在端脑的正中做冠状切开,前端置于4%多聚甲醛内固定,常规脱水、透明、浸蜡、包埋;后端取缺血侧海马及顶叶皮质,用锡箔纸包裹置于液氮中冻存,备用。
2.6.3 HE染色取脑组织蜡块,在前囱后1.0~1.5 mm区域做冠状切片,厚5 μm。二甲苯和无水乙醇脱蜡,苏木精染色10 min后自来水浸洗,1%伊红复染3 min,梯度乙醇脱水,二甲苯透明后封片。光镜下,观察各组大鼠缺血侧海马区神经细胞组织形态学特征。
2.6.4 免疫组化脑组织切片常规脱蜡、水化,3% H2O2孵育10 min,PBS冲洗3次,每次2 min,湿盒中滴加1∶100稀释的一抗(BDNF、bFGF),37 ℃孵育2 h后,分别滴加聚合物辅助剂和辣根酶标记二抗,37 ℃孵育30 min,DAB显色,常规脱水、透明及封片。每组每个指标检测6张切片,分别选取缺血侧海马区5个互不重叠的视野,采用IPP 6.0软件进行图像分析,测定阳性细胞的平均吸光度(A)值,取5个视野平均值纳入。A值高,则细胞阳性染色(胞浆内见棕黄色颗粒)强度高。
2.6.5 Wersternblotting检测 取出冻存的脑组织,加入细胞裂解液,超声匀浆10 min,13 000 r/min离心5 min,取上清,BCA法蛋白定量。95℃水浴5 min,取上清制备50 μg蛋白样品。电泳后转NC膜,加入一抗(BDNF、bFGF、GAPDH),37 ℃孵育2 h;TBST洗膜3次,分别加入辣根酶标记二抗,37 ℃孵育1 h,TBST洗膜,ECL显色。使用凝胶成像仪拍照,采用ImageJ软件进行灰度值分析。
2.7 统计学处理数据以表示,采用SPSS 19.0软件进行统计学分析。计量资料采用t检验进行两组间比较,多组比较采用单因素方差分析。
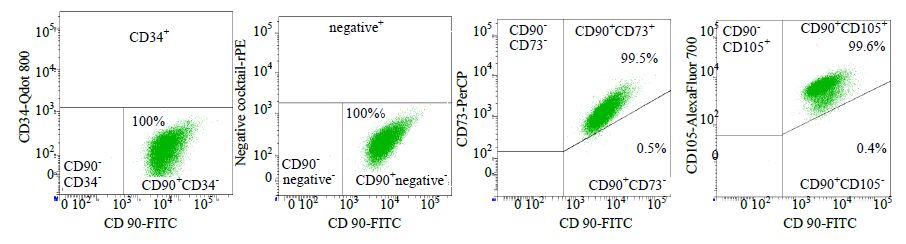
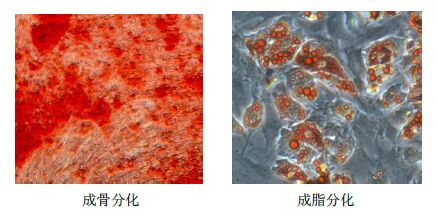
3 结果 3.1 hUC-MSCs的培养和鉴定组织块法培养hUC-MSCs至第10天后,镜下可见大量梭形成纤维样细胞从组织块边缘游出,贴壁生长,大小均一,传代后呈漩涡样或簇状生长,结果见图 1。流式细胞仪鉴定细胞表面分子,可见hUC-MSCs高表达间充质干细胞抗原CD90、CD105、CD73,不表达造血干细胞标志性抗原CD34,结果见图 2。经过诱导培养后,可向成骨、成脂分化,结果见图 3。细胞培养及鉴定结果符合国际细胞疗法协会关于间充质干细胞的鉴定标准[9]。

|
图 1 HUC-MSCs细胞形态 Fig. 1 Cell morphology of HUC-MSCs |
|
图 2 hUC-MSCs的表面分子鉴定 Fig. 2 Surface molecule identification of hUC-MSCs |
|
图 3 hUC-MSCs的分化鉴定 Fig. 3 Differentiation identification of hUC-MSCs |
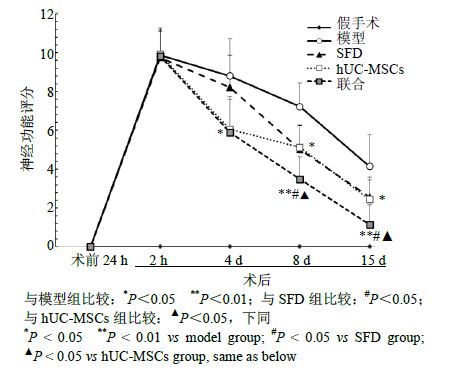
hUC-MSCs组和联合组(第4、8、15天)神经功能评分均明显低于模型组(P<0.01、0.05);联合组在第8、15天评分较SFD组及hUC-MSCs组显著降低(P<0.05)。结果见图 4。
|
图 4 各组神经功能缺损分值比较 (x±s,n = 6) Fig. 4 Comparison on NSS in each group (x±s,n = 6) |
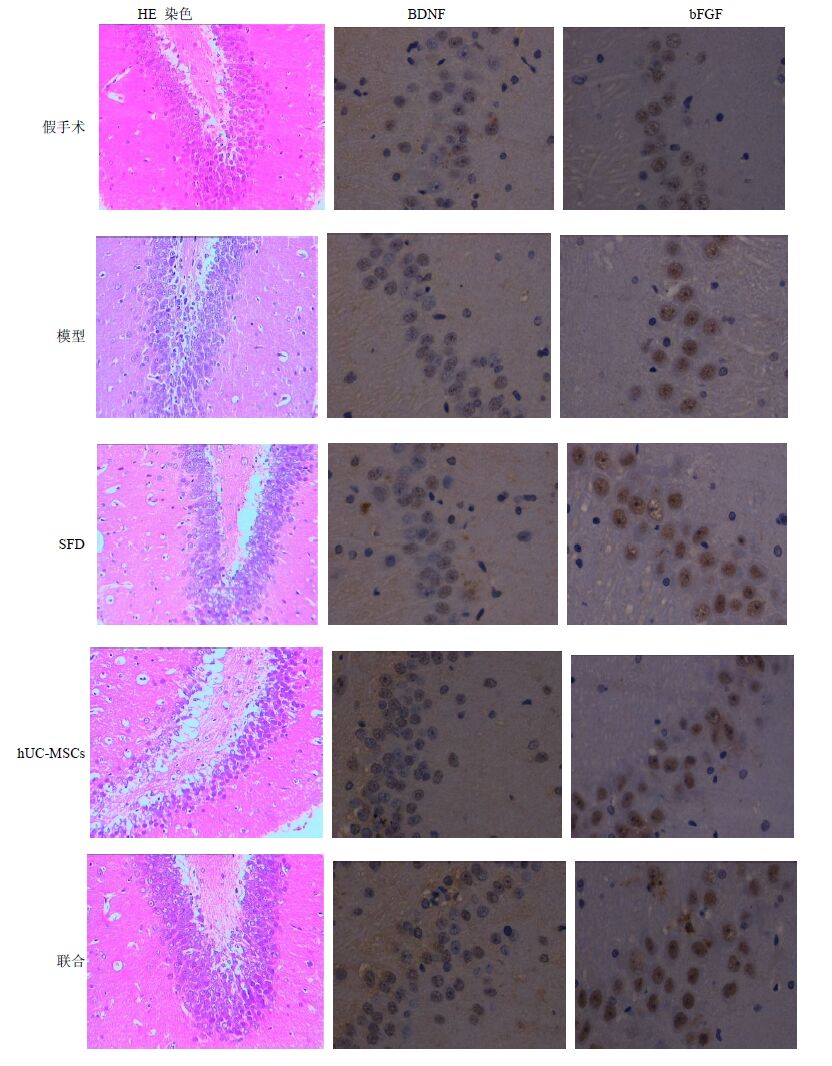
光镜下对缺血海马区脑组织进行形态学观察,各时间点假手术组细胞轮廓正常,排列紧密,胞核居中;脑缺血后4、8 d,造模各组可见梗死区或者钙化病灶,胞核固缩或出现空泡,细胞结构散乱、部分细胞轮廓不清;但SFD组、hUC-MSCs组和联合组细胞坏死较模型组减轻;第15天时,各组细胞排列有序、轮廓较清晰,但模型组仍可见少量坏死细胞。第8天HE染色结果见图 5。
|
图 5 第8天时海马区细胞病理染色 Fig. 5 Pathological staining of hippocampus on day 8 |
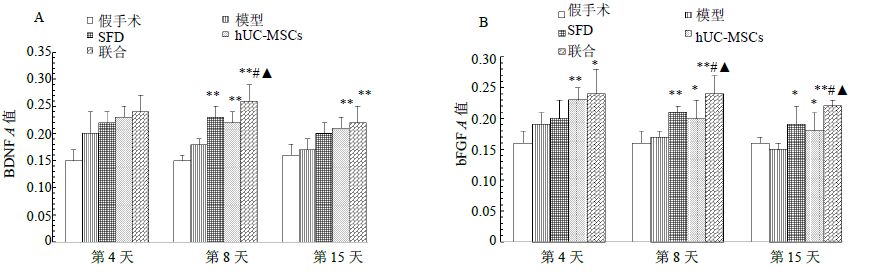
假手术组BDNF及bFGF A值在各时间点差异不显著;与模型组比较,SFD组(第8天)、hUC-MSCs组及联合组(第8、15天)BDNF A值明显升高(P<0.01),SFD组(第8、15天)、hUC-MSCs组及联合组(第4、8、15天)bFGF A值明显升高(P<0.05、0.01);联合组在第8天BDNF A值较SFD组及hUC-MSCs组明显升高(P<0.05),第8、15天bFGF A值较SFD组及hUC- MSCs组明显升高(P<0.05)。BDNF、bFGF第8天免疫组化结果见图 5,第4、8、15天A值结果见图 6。
|
图 6 各组BDNF (A)、bFGF (B) A值比较 (x±s,n = 6) Fig. 6 Comparison on A values of BDNF (A) and bFGF (B) in each group (x±s,n = 6) |
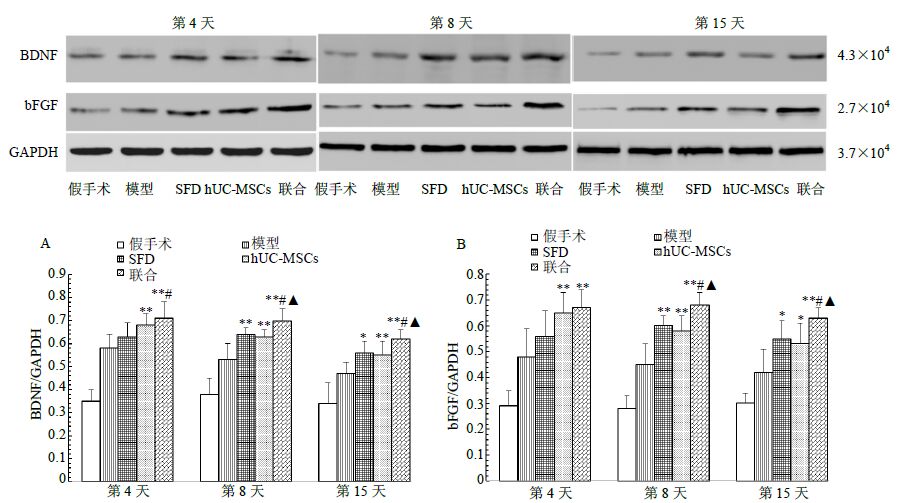
假手术组BDNF、bFGF蛋白表达在各时间点无明显变化;与模型组比较,SFD组(第8、15天)、hUC-MSCs组及联合组(第4、8、15天)BDNF及bFGF蛋白表达明显升高(P<0.05、0.01);联合组在第8、15天BDNF及bFGF蛋白表达较SFD组及hUC-MSCs组升高(P<0.05)。结果见图 7。
|
图 7 各组BDNF (A) 及bFGF (B) 蛋白表达比较 (x±s,n = 6) Fig. 7 Comparison on BDNF (A) and bFGF (B) protein expression in each group (x±s,n = 6) |
自成人脑中存在神经元再生现象被发现以来,具有移植后再生、增殖、分化修复脑组织潜能的干细胞迅速引起了科研工作者的广泛关注。人脐带间充质干细胞来源于脐带羊膜与脐带血管之间的华氏胶(Whaton’s Jelly),其来源丰富、取材方便、且不存在伦理道德争议,体外培养可向软骨细胞、脂肪细胞、神经细胞、内皮细胞等多方向分化,其免疫原性低,异体移植不会发生明显免疫排斥反应[1]。Zhang等[8]采用尾iv移植hUC-MSCs治疗脑缺血损伤大鼠,发现移植细胞可以存活、归巢到脑梗死区域,并能促进新血管生成,明显改善大鼠神经功能恢复。Lin等[9]通过皮层下移植hUC-MSCs,移植组脑内缺血区血管密度、神经营养因子表达都有显著提高,神经细胞凋亡减少,脑内炎症水肿也能得到明显缓解。更多的研究表明,hUC-MSCs修复缺血性脑损伤的根本原因在于其可通过旁分泌途径促进内源性神经营养因子、抗炎因子、抗凋亡细胞因子的合成和分泌,从而抑制缺血再灌注后炎症反应和细胞凋亡、促进血管新生和神经再生,改善脑缺血后神经功能恢复[1]。
中医理论认为,肾精化生脑髓,髓海有病,其本在肾。肾虚则脑髓失充、脉络失养、血行不畅,发为脑卒中。因此,肾虚血瘀也是本病的重要病理机制之一,治疗时,应“从肾治脑、肾脑同治”,化瘀行血同时填精补髓,精髓得充、气血冲旺则血瘀自去,如此则精盛、髓满、瘀散、络畅、窍通、肢便。根据“从肾治脑、肾脑同治”理论组方的SFD是湖南省名中医胡国恒教授经验方,临床上治疗缺血性脑卒中可明显改善患者各项神经功能,降低致残率[10],实验研究证明其可抑制脑缺血再灌注大鼠缺血区炎症反应并促进神经营养因子NGF及GDNF表达,显著改善神经功能恢复[11]。本方君药黄芪、熟地,健脾益气、补血养阴、填精益髓;臣药山药、山茱萸,益气养阴、补益肝肾、兼能涩精;佐以化瘀通络之品,牡丹皮、赤芍、红景天、当归尾,补血通络、活血祛瘀;使以地龙,引药入经、通经祛瘀,全方共奏益肾补气活血通络之功。
BDNF、bFGF同属神经营养因子家族,在脑缺血损伤修复过程中起着重要的作用。BDNF在大脑皮层及海马区水平较高,脑缺血再灌注损伤可以诱导其表达,从多个方面减少炎症损伤和细胞凋亡。BDNF可促进细胞内Ca2+结合蛋白表达、稳定Ca2+浓度,抑制NO合酶的产生、减少自由基生成,下调Bax/Bcl表达、抑制β-淀粉样蛋白介导的细胞凋亡[12];脑缺血后,BDNF还可以通过与其特异性trkB受体相结合,增加神经突触可塑性,促进轴突生长,改善脑组织修复[13]。bFGF属于FGF家族,是一种广谱的促神经生长因子和促神经细胞分裂因子,但正常情况下脑组织内水平较低[14]。脑缺血发生后,bFGF表达明显增加,其可以通过特异性提高caspase-3基因、降低Bcl-2基因的表达,促进细胞分裂、增殖和血管新生,并抑制神经元凋亡,减少再灌注损伤;另外,bFGF还能通过结合其特异性受体,激活酪氨酸激酶,增加NO释放,扩张局部血管,改善微循环和细胞代谢,拮抗脑组织缺血缺氧损伤[15]。
本实验结果显示,脑缺血发生后,BDNF、bFGF的表达均明显增高,而随着组织修复进程逐渐呈降低趋势,这与之前的文献报道相符合[13]。实验中,BDNF、bFGF表达的免疫组化和Werstern blotting检测结果不完全相同,但表达的总体趋势一致;与模型组比较,SFD与hUC-MSCs均可明显改善脑梗死后大鼠各项神经功能,减少细胞坏死,促进BDNF、bFGF的表达;但在缺血早期(第4天)hUC-MSCs的疗效更加显著,在第8、15天,二者疗效相当,说明SFD的治疗效应主要发生在恢复期,这与前期对SFD的临床观察相符合[10];与SFD组及hUC-MSCs组比较,联合组更加显著地促进神经营养因子的表达,改善大鼠脑缺血后神经功能恢复,说明SFD与hUC-MSCs联用后,治疗效应有更加显著的提高。实验中,未出现由药物引起的不良反应,也未出现任何免疫排斥反应,因此,本研究证实,SFD联合hUC-MSCs移植治疗缺血性脑卒中安全且有良好的疗效,其作用机制可能与促进脑缺血再灌注后神经营养因子BDNF及bFGF表达有关。
| [1] | Li Y, Hu G, Cheng Q. Implantation of human umbilical cord mesenchymal stem cells for ischemic stroke:perspectives and challenges[J]. Front Med, 2015, 9(1):20-29. |
| [2] | 陈薇, 胡玉英. 中医药治疗缺血性中风研究进展[J]. 中西医结合心脑血管病杂志, 2012, 10(4):474-475. |
| [3] | 王丹. 银杏健脑片质量研究[D]. 长春:吉林农业大学, 2014. |
| [4] | Latifpour M, Shakiba Y, Amidi F, et al. Differentiation of human umbilical cord matrix-derived mesenchymal stem cells into germ-like cells[J]. Avicenna J Med Biotechnol, 2014, 6(4):218-227. |
| [5] | 陈韵羽. 肾脑复元汤对局灶性脑缺血大鼠GDNF和NGF蛋白表达水平的影响[D]. 长沙:湖南中医药大学, 2014. |
| [6] | 范金花. 肾脑复元汤对缺血性脑损伤大鼠Brdu、Nestin及相关细胞因子的影响[D]. 长沙:湖南中医药大学, 2014. |
| [7] | Kuptsova K, Kvist E, Nitzsche F, et al. Combined enriched environment atipamezole treatment transiently improves sensory functions in stroke rats independent from neurogenesis and angiogenesis[J]. Rom J Morphol Embryol, 2015, 56(1):41-47. |
| [8] | Zhang L, Li Y, Zhang C, et al. Delayed administration of human umbilical tissue-derived cells improved neurological functional recovery in a rodent model of focal ischemia[J]. Stroke, 2011, 42(5):1437-1444. |
| [9] | Lin Y C, Ko T L, Shih Y H, et al. Human umbilical mesenchymal stem cells promote recovery after ischemic stroke[J]. Stroke, 2011, 42(7):2045-2053. |
| [10] | 张忠伟, 胡国恒. 肾脑复原汤治疗脑梗死恢复期肾虚血瘀证30例疗效观察[J]. 湖南中医杂志, 2014, 30(4):11-13. |
| [11] | 胡国恒, 李映辰, 邹婷, 等. 肾脑复元汤对MCAO大鼠炎症因子及神经营养因子表达的影响[J]. 中药药理与临床, 2015, 31(2):81-85. |
| [12] | 黄文, 莫雪安, 张成, 等. BDNF体外诱导骨髓间充质干细胞对脑缺血大鼠神经缺失功能的作用[J]. 广西医科大学学报, 2012, 29(6):821-824. |
| [13] | Zhang Y, Pardridge W M. Blood-brain barrier targeting of BDNF improves motor function in rats with middle cerebral artery occlusion[J]. Brain Res, 2006, 11(11):227-229. |
| [14] | Sonmez A B, Castelnuovo J. Applications of basic fibroblastic growth factor(FGF-2, bFGF) in dentistry[J]. Dent Traumatol, 2014, 30(2):107-111. |
| [15] | Cai H, Xu X, Liu Z, et al. The effects of calcitonin gene-related peptide on bFGF and AQP4 expression after focal cerebral ischemia reperfusion in rats[J]. Pharmazie, 2010, 65(4):274-278. |
 2016, Vol. 47
2016, Vol. 47


