三叶豆紫檀苷(trifolirhizin,Tri),又名红车轴草根苷、红车轴草根苷、三叶豆根苷、高丽槐素-D-葡萄糖,是豆科槐属植物苦参Sophora flavescens Ait. 的干燥根分离得到的紫檀烷类黄酮化合物,现代药理研究表明其具有抗炎、抗肿瘤等活性[1, 2]。此外,其也显示出酪氨酸酶抑制作用并能抑制小鼠B16黑素瘤细胞黑素合成,提示其可作为对紫外线敏感的皮肤的一种新型美白剂[3]。课题组研究表明Tri的水溶性、脂溶性均较差,属生物药剂学分类系统(biopharmaceutics classification system,BCS)第IV类药物,口服生物利用度低。
磷脂复合物(phospholipid complex,PC)通过提高药物亲脂性改善其生物膜透过,显著提高生物利用度及生物有效性[4, 5, 6, 7, 8],然而PC过于黏稠导致其在水中不易分散。自微乳药物传递系统(self- microemulsifying drug delivery system,SMEDDS)可改善水难溶性/脂溶性药物的溶出度,提高药物吸收的速度和程度,促进PC在水中分散,近年来成为研究热点[9, 10, 11, 12]。本研究联合采用PC与SMEDDS技术制备Tri磷脂复合物(TPC)自微乳(TPC- SMEDDS),全面解决Tri不良的溶解性和渗透性问题[13],并通过Caco-2细胞考察Tri及其制剂的跨膜转运。Tri通过制成磷脂复合物自微乳以改善吸收的研究,国内外未见相关报道。
1 仪器与材料Bruker-400型超导核磁共振光谱仪,德国布鲁克公司;Waters 2695-2996型HPLC仪,美国Waters公司;Diamonsil C18(250 mm×4.6 mm,5 μm)色谱柱,美国Dikma公司;MAT LCQ质谱仪,美国Finnigan公司;Transwell细胞培养板,丹麦NUNC公司;CO2培养箱,美国Thermo公司;Millicell-ERS跨膜电阻仪,美国Millipore公司;XDS-1倒置显微镜,重庆光电仪器总公司;台式离心机,上海安亭科学仪器厂;超净工作台,苏州净化工程设备有限公司;Milli-Q纯水机,美国Millipore公司。
硅胶(80~100、200~300目),青岛海洋化工厂;薄层色谱用硅胶板(Silica gel60F254);Tri原料药(实验室自制,批号20130812,质量分数>98%);TPC及TPC-SMEDDS(实验室自制);卵磷脂,阿拉丁工业公司,中国上海;聚氧乙烯蓖麻油(Cremphor EL40)、聚氧乙烯氢化蓖麻油(Cremphor RH40),巴斯夫,德国;丙二醇单辛酸酯(Capyrol 90)、二乙二醇单乙基醚(Transcutol HP)、辛酸癸酸聚乙二醇甘油酯(Labrasol®),嘉法狮,中国上海;聚山梨酯80、聚乙二醇(polyethylene glycol,PEG)400,天津博迪化学有限公司;蓖麻油,天津富宇精细化工有限公司;油酸乙酯,天津光复精细化工研究院;肉豆蔻酸异丙酯,国药集团化学试剂有限公司;甲醇为色谱醇,其他试剂均为分析醇。Caco-2细胞,Corning Costar,New York;DMSO,上海联硕生物科技有限公司;DMEM(Dulbecco’s Modified Eagle Media,高糖)培养基、胎牛血清、非必需氨基酸、青-链霉素、HBSS(Hank’s balanced salt solution)缓冲液、0.25%胰蛋白酶-0.02% 乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)消化液,Invitrogen Co. Grand Island. NY,美国。
2 方法与结果 2.1 Tri的制备 2.1.1 Tri的分离制备取干燥的苦参3.0 kg,80%乙醇回流提取,所得固形物加95%乙醇超声溶解,离心除残渣,上清液回收溶剂所得固形物以0.5% HCl超声溶解残留的生物碱成分,取残渣用蒸馏水多次洗涤,直至呈中性,减压干燥,即得苦参总黄酮提取物(得率为2.1%)[14]。以硅胶柱(200~300目)分离苦参总黄酮,二氯甲烷-甲醇梯度洗脱,TLC检查合并相同组分,得Fr. 1~Fr. 10共10个部分。Fr. 8部分甲醇重结晶得到白色针状晶体(2.59 g)。
2.1.2 Tri的结构鉴定白色针晶,微溶于甲醇,Molish反应呈紫色环,盐酸镁粉反应不显色,mp 140~141.5 ℃。UV光谱(MeOH)在309.5、364 nm处出现最大吸收。ESI-MS谱中,在m/z 447处可见 [M+1]+离子峰和m/z 284(M+-162葡萄糖基)碎片离子,表明相对分子质量为446,且为苷类化合物。经酸水解后,其糖部分经薄层色谱检识证明含有葡萄糖,推测其为含有葡萄糖的苷类化合物。结合1H-NMR谱及13C-NMR谱,推测其分子式为 C22H22O10,计算其不饱和度为12。1H-NMR (CD3COCD3) δ: 7.38 (1H,d,J = 9.4 Hz,H-1),6.92 (1H,s,H-7),6.78 (1H,dd,J = 9.4,2.4 Hz,H-2),6.59 (1H,d,J = 2.4 Hz,H-4),6.38 (1H,s,H-10),5.96 (1H,s,-OCH2O-),5.91 (1H,s,-O-CH2-O-),5.54 (1H,d,J = 7.6 Hz,H-11α),4.96 (1H,d,J = 7.6 Hz,H-1′),4.28 (2H,m,H-6),3.80~3.43 (7H,m,H-6α和糖上质子);13C-NMR (CD3COCD3) δ: 132.6 (C-1),111.2 (C-2),159.8 (C-3),106.2 (C-4),157.8 (C-4α),67.8 (C-6),40.6 (C-6α),119.2 (C-6β),105.2 (C-7),142.8 (C-8),148.4 (C-9),93.4 (C-10),154.8 (C-10α),79.5 (C-11α),115.8 (C-11β),101.2 (-O-CH2-O-),102.5 (C-1′),74.5 (C-2′),77.8 (C-3′),71.4 (C-4′),76.0 (C-5′),62.7 (C-6′)。以上数据与文献报道[14]的 (−)-maackiain-3- O-glucoside(三叶豆紫檀苷)数据基本一致,确定其为Tri。
2.2 TPC的制备 2.2.1 TPC的制备方法分别称取Tri和PC各10 mg置于10 mL锥形瓶中,加入5 mL丙酮,于40 ℃、50 r/min条件下恒温水浴磁力搅拌2 h,反应后将溶液置于梨形瓶中,恒温水浴40 ℃,50 r/min转速下旋转蒸发除去溶剂,真空干燥,即得。
2.2.2 TPC的评价方法评价指标采用药物复合率,测定方法为将药物与磷脂反应后溶液挥干再溶于二氯甲烷(该溶剂对药物不溶但可以溶解磷脂和PC),减压抽滤得到不溶的沉淀(即未反应的药物沉淀)干燥后称质量,按下式计算复合率。
复合率=W1/W=(W-W2)/W
W1为形成复合物的药物量,W2为未形成复合物的药物量,W为总投料量
2.2.3 正交试验优化TPC的处方以复合率为指标,按照“2.2.1”项制备步骤采用单因素考察法初步筛选TPC处方及工艺条件。反应溶剂选择了甲醇-二氯甲烷(1∶1)、甲醇、四氢呋喃、丙酮以及氯仿,结果丙酮为反应溶剂时复合率最高;分别在25~55 ℃每隔5 ℃考察反应温度的影响,结果40 ℃为宜。进一步研究发现,Tri质量浓度、反应时间、Tri与卵磷脂投料物质的量比例对复合率影响较大,故在单因素考察基础上,选择Tri与卵磷脂投料物质的量比(A)、反应物(Tri)质量浓度(B)、反应时间(C)为考察的因素,每个因素下设3个水平(表 1),按照L9(34) 表安排试验,结果进行直观分析和方差分析(表 1、2)。综合分析极差及方差分析结果,得到各因素对复合率影响的主次顺序为B>A>C,仅B因素具有显著性;优选最佳方案是A2B2C3,即Tri质量浓度为4 mg/mL,药物与卵磷脂投料物质的量比为1∶1.5,反应时间为3 h。按上述优选的处方制备3批TPC样品,测定复合率的平均值为(93.20±2.01)%,结果表明该制备工艺稳定可控。
|
|
表 1 L9(34) 正交试验设计、结果及直观分析 Table 1 Design,results,and intuitive analysis of L9(34) orthogonal test |
|
|
表 2 正交设计的方差分析 Table 2 Analysis of variance |
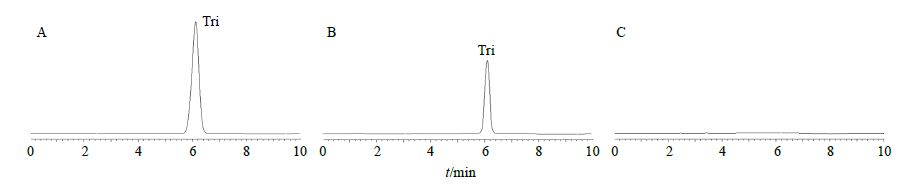
色谱条件[13]:色谱柱为Diamonsil C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-水(60∶40);检测波长为309 nm;柱温为30 ℃;进样量10 μL。该色谱条件下辅料不干扰主药的测定,HPLC图见图 1。Tri在31~310 μg/mL线性关系良好,回归方程为Y=8×106 X+37 028,R2=0.999 8。载药量测定时,取所制备的TPC-SMEDDS样品,于37 ℃恒温水浴振荡器中振荡24 h,3 000 r/min离心30 min,取上清液,用流动相稀释,经0.45 μm微孔滤膜滤过后,按上述方法测定。日内、日间精密度RSD均<2.15%,表明仪器精密度良好;稳定性试验RSD为0.72%,表明样品溶液10 h内稳定;重复性试验RSD为1.15%,表明本法重复性良好;加样回收率均>97.1%,RSD均小于2.0%。
|
图 1 Tri对照品 (A)、TPC-SMEDDS样品 (B) 和空白辅料 (C) HPLC图 Fig. 1 HPLCof Tri reference substance (A),TPC-SMEDDS sample (B),and blank accessories (C) |
制备时先将乳化剂与助乳化剂按照质量比(Km)为1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1混合,再将油相与乳化剂和助乳化剂质量之和按照1∶9~9∶1的比例混合,加入到具塞西林瓶中,37 ℃恒温水浴磁力搅拌5 min,使油相、乳化剂和助乳化剂充分混匀。
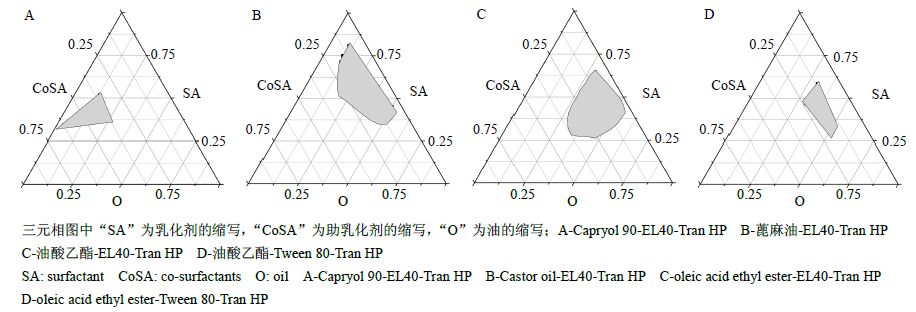
2.4.2 绘制三元相图确定空白SMEDDS自乳化区域考察了TPC在各种油相、乳化剂及助乳化剂等辅料中的溶解度,确定Tran HP为助乳化剂,蓖麻油、油酸乙酯及Capryol 90为油相,EL40、聚山梨酯(Tween)80及Labrasol为乳化剂,进一步考察不同组合的处方对自乳化效率的影响。结果油相-乳化剂-助乳化剂分别为Capryol 90-EL40-Tran HP和油酸乙酯-Tween 80-Tran HP自乳化效果较好为A级[即迅速分散乳化(时间≤1 min),形成澄清或微微泛蓝的微乳(乳滴粒径≤50 nm)];蓖麻油- EL40-Tran HP和油酸乙酯-EL40-Tran HP自乳化效果为B级[迅速分散乳化(时间≤1 min),形成蓝白色微乳(乳滴粒径为50~100 nm)]。挑选上述处方绘制三元相图。将筛选的油相、乳化剂、助乳化剂按照“2.4.1”项下制备SMEDDS。磁力搅拌下,向SMEDDS中缓慢加入10倍量去离子水,记录形成澄清或淡蓝色乳光液体的处方及比例,按油、乳化剂、助乳化剂的各自质量分数作为三元相图的一点,采用Origin 8.0软件绘制三元相图,结果见图 2。结果表明,图 2-A中Capryol 90-EL40-Tran HP和图 2-B中蓖麻油-EL40-Tran HP的自微乳区域面积较大,但实验中发现蓖麻油-EL40-Tran HP的凝胶区域较大,影响乳化效率,故选择Capryol 90-EL40- Tran HP进一步优化。
|
图 2 空白SMEDDS三元相图 Fig. 2 Ternaryphasediagramof blank SMEDDS |
采用星点设计效应面法优化自微乳处方。主要考察油相用量(X1,30%~50%)和Km值(X2)对TPC-SMEDDS的饱和载药量(Y1)、液滴尺寸多分散性指数(PDI,Y2)及粒径(Y3)的影响,进行2因素5水平的星点设计,因素水平和实验结果见表 3。
|
|
表 3 星点试验设计及测定结果 Table 3 Test results from CCD |
以Y1、Y2和Y3为因变量,采用Design Expert 8.0软件进行二次多项式回归,以拟合优度R2和置信度P作为模型判断标准,二次多项式拟合方程结果分别为Y1=−191.08+10.36+0.49 X2+0.08 X1X2-0.13 X12-0.23 X22,P=0.000 1<0.05,R2=0.957 9;Y2=6.15-0.30 X1+0.16 X2-0.004 X1X2-0.004 X12-0.001 X22,P=0.000 3<0.05,R2=0.957 0;Y3=245.31-12.18 X1+8.59 X2-0.33 X1X2+0.18 X12+0.36 X22,P=0.003 3<0.05,R2=0.839 9。分析各因素对响应值的影响,借助软件SPSS 11.0的优化功能,在最佳的效应值的前提下,通过响应面的重合叠加,选取较优的组合,3D响应面见图 3。
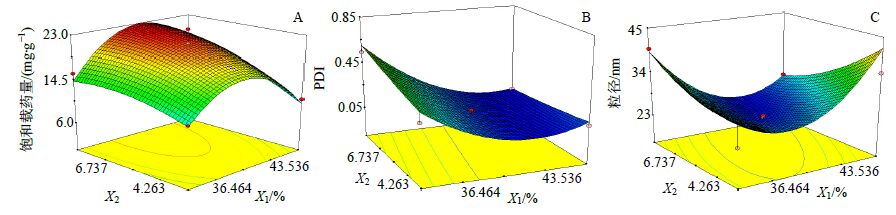
|
图 3 3D响应面图 Fig. 3 3D response surface |
由图 3-A中,油相用量居中等水平时随着Km值增大载药量Y1也增大;图 3-B中,Km值对Y2基本无影响,随着油的用量的增加Y2则减小;图 3-C中,2因素在中心点附近时Y3值较小。综合考虑3个方程,Y1、Y2、Y3权重相同,以3者的综合评分(Y)=(Y1/Y1max+Y2/Y2max+Y3/Y3max)/3为指标,采用最速下降法得油相用量X1=43.65%,Km值X2=7.58,Y预测最大值为94.932%,Y1预测最大值为21.816 3 mg/g,95%的最优值预测区间为(17.72,25.92),Y2预测最大值为0.066,95%的最优值预测区间为(0,0.23),Y3预测最大值为24.374 9 nm,95%的最优值预测区间为(12.85,35.90)。
根据优化处方,制备3批TPC-SMEDDS样品进行处方验证,分别测定饱和载药量、PDI和平均粒径,结果3批TPC-SMEDDS样品的平均饱和载药量为(21.63±0.59)mg/g,平均PDI为0.071± 0.031,平均粒径为(24.84±0.40)nm;根据最优参数及二次多项式拟合方程计算得到的饱和载药量为21.82 mg/g,PDI为0.066,粒径为24.37 nm。结果预测值和真实值之间基本无差异,表明中心复合设计法可靠。为便于制备,载药量确定为20.00 mg/g(以TPC中Tri量计算)。
2.4.4 粒径分布及Zeta电位的测定取稀释50倍的自微乳适量,用马尔文粒径仪测定自微乳的粒径和Zeta电位,记录粒径及电位,结果见图 4。TPC- SMEDDS的平均粒径为(24.84±0.40)nm,PDI为0.071±0.310,Zeta电位为(−15.42±0.62)mV。

|
图 4 粒径分布和Zeta电位图 Fig. 4 Particle size distribution and Zeta potential |
将按最佳工艺条件制备的3批TPC-SMEDDS样品于室温及4 ℃冰箱冷藏保存,分别于制备后第0、15、30、45、60天取样观察,测定电位、粒径、PDI以及载药量,考察稳定性。结果,自微乳在4 ℃条件下存放60 d,外观均匀,无絮凝和沉淀产生,Zeta电位及粒径、载药量基本不变。
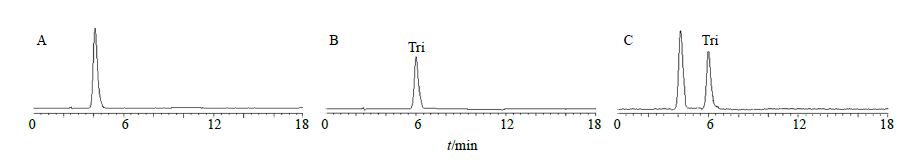
2.5 Caco-2细胞渗透性研究 2.5.1 Tri定量测定色谱条件同“2.3”项。该条件下,辅料对主药测定不产生干扰,色谱图见图 5。
|
图 5 HBSS溶液 (A)、Tri对照品 (B) 和Tri对照品+HBSS溶液 (C) 的HPLC图 Fig. 5 HPLCof HBSS (A),Tri reference substance(B),and HBSS + Tri reference substance (C) |
Tri在2.55~102.00 μg/mL线性关系良好,回归方程为Y=13.433 X+5.378,R2=0.999 5。日内和日间精密度RSD均小于3%,加样回收率在95.76%~104.87%,RSD小于2.0%,符合要求。
2.5.2 Caco-2细胞模型建立及单层验证培养基采用DMEM 13.4 mg/mL,含10%胎牛血清、1%非必须氨基酸、0.5%青霉素、0.5%链霉素,调pH至7.4。培养箱CO2浓度控制在5%,温度37 ℃。Caco-2接种(密度为1×106个/cm2)后隔天换液,14 d后每日换液,分别于6、14、21 d采用跨膜 电阻仪测定各孔跨膜电阻值(trans epithelial electrical resistance,TEER),倒置显微镜观察细胞形态。培养Caco-2细胞第6天的TEER达(325±19)Ω/cm2,第14天为(528±23)Ω/cm2、第21天为(673±27)Ω/cm2。可见,14 d时TEER值已经达到500 Ω/cm2,然而倒置显微镜观察细胞形态仍可见细胞空洞,直至21 d才完全融合形成致密均匀的细胞单层,因此选择Caco-2细胞培养21 d。第6天和第21天的细胞形态见图 6。
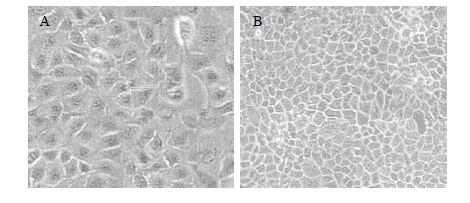
|
图 6 生长6 d (A)、21 d (B) Caco-2细胞形态 (× 200) Fig. 6 Caco-2 cell morphology on 6 (A) and 21 d (B) (× 200) |
实验前弃去Trans well板中培养液,用37 ℃的PBS溶液洗涤2次,在培养板中加入HBSS,于细胞培养箱中孵育30 min。吸取200 μL的Tri、TPC、TPC-SMEDDS待测液分别置于AP面(apical,细胞绒毛面),0.8 mL的pH 7.4的HBSS溶液置于BL面(basolateral,基底面),CO2培养箱孵育。实验开始时,先测定药物初始浓度(C0),再分别于10、20、30、45、60、90、120、180 min 从接收室吸取接收液200 μL,同时补加200 μL空白接收液。HPLC分析,计算表观渗透系数(Papp,cm/s)。
Papp=(dQ/dt)/(A×C0)
Q为累积转运量,代表化合物在接收室的总量(μmol);dQ/dt为转运速率(μmol/s);C0为化合物在供给室的初始浓度(μmol/mL);A为聚碳酯膜的表面积(cm2)
每组实验重复3次,以HBSS溶液作空白,实验结果以x±s表示。统计学处理采用SPSS 19.0中的One-way ANOVA分析,TPC、TPC-SMEDDS组分别与Tri比较(采用LSD、S-N-K检验)P<0.05,表明转运存在显著差异。实验结束时再次测量TEER,以确定细胞单层完整性,Tri、TPC及TPC- SMEDDS随时间变化在Caco-2细胞中累积吸收转运结果见图 7。

|
图 7 Caco-2细胞上的累积吸收转运 (x±s,n = 3) Fig. 7 Comulative absorption and transport rate in Caco-2 cells (x±s,n = 3) |
实验结束时TEER测量结果与实验前测量结果差异在10%以内,表明细胞单层完整性良好。测定结果表明,Tri自身的渗透性很差,Papp仅为2.45×10−7 cm/s;制成磷脂复合物后渗透性Papp为5.13×10−6 cm/s;联合采用磷脂复合物与自微乳技术后,Papp为1.847×10−5 cm/s。
3 讨论 3.1 自乳化实验条件选择本研究采用单因素考察法以自乳化效率为指标,研究了TPC-SMEDDS制剂的自乳化试验条件,如搅拌速度、稀释倍数等。结果表明,搅拌速度越快,TPC-SMEDDS乳化时间和粒径虽稍有降低,但没有显著性差异。且速度过快,亲水性表面活性剂会产生较多泡沫,故选50 r/min。随着稀释倍数的增加,乳化时间相应增加,粒径影响不大。考虑到空腹时正常成人的胃容量约50 mL,进餐后可达1.5 L,胃液体积约为口服微乳体积的50倍,故稀释倍数确定为50倍。同时考察了不同的乳化介质蒸馏水、人工胃液及人工肠液对乳化效率的影响,结果对乳化时间和乳滴的粒径无显著差异。由于制剂口服后应在胃肠道自发形成微乳,故本研究中均采用了37 ℃作为自微乳化考察温度。
3.2 自微乳中油相、乳化剂及助乳化剂的选择本研究筛选了TPC在各类油、表面活性剂以及助表面活性剂中的溶解度,结果助乳化剂Transcol HP对其溶解度明显高于其他辅料;肉豆蔻酸异丙酯对其溶解度太差,故以蓖麻油、油酸乙酯及Capryol 90为油相;RH 40黏度较大,故乳化剂选择EL40、Tween 80及Labrasol进一步开展自乳化效果研究。
3.3 Caco-2跨膜转运分析Caco-2细胞系来源于人的直肠癌,其结构和生化作用类似于人小肠上皮细胞,含有与小肠刷状上皮相关的酶系[15]。本研究基于Caco-2细胞考察了Tri、TPC、TPC-SMEDDS的Papp,结果Tri的Papp仅为2.45×10−5 cm/s,小于1×10−6 cm/s,表明Tri为小肠不良吸收的药物;制成磷脂复合物及磷脂复合物自微乳后的Papp都均明显优于原料药Tri,且与Tri比较均有显著性差异(P<0.05)。TPC、TPC- SMEDDS比较,联合磷脂复合物与自微乳2种技术的制剂比单纯磷脂复合物的技术有优越性,有显著性差异(P<0.05)。上述结果提示磷脂复合物及自微乳技术联用可以明显改善Tri的渗透系数,提高药物跨膜转运效率,提示可提高生物利用度。
| [1] | Zhou H P, Lutterodt H, Cheng Z H, et al. Antiinflammatory and antiproliferative activities of trifolirhizin, a flavonoid from Sophora flavescens roots[J]. J Agric Food Chem, 2009, 57(11):4580-4085. |
| [2] | Aratanechemuge Y, Hibasami H, Katsuzaki H, et al. Induction of apoptosis by maackiain and trifolirhizin (maackiain glycoside) isolated from sanzukon (Sophora subprostrate Chen et T. Chen) in human promyelotic leukemia HL-60 cells[J]. Oncol Rep, 2004, 12(6):1183-1188. |
| [3] | Hyun S K, Lee W H, Jeong D M, et al. Inhibitory effects of kurarinol, kuraridinol, and trifolirhizin from Sophora flavescens on tyrosinase and melanin synthesis[J]. Biol Pharm Bull, 2008, 31(1):154-158. |
| [4] | 熊阳, 盛卫国, 杜佳琦, 等. 山楂叶总黄酮磷脂复合物的研究[J]. 中草药, 2008, 39(3):353-356. |
| [5] | 童廷德, 黄蕊, 孙逊, 等. 丹酚酸B磷脂复合物自乳化药物传递系统的制备及质量评价[J]. 四川大学学报:医学版, 2013, 44(2):303-307. |
| [6] | 夏海建, 张振海, 孙娥, 等. 胶体二氧化硅固化银杏黄酮组分磷脂复合物的研究[J]. 中草药, 2014, 45(8):1078-1082. |
| [7] | 薛海萍, 高婷婷, 杨骏, 等. 红景天苷磷脂复合物的制备及表征[J]. 中草药, 2015, 46(22):3333-3337. |
| [8] | 李艳贞, 阎卉, 刘欢, 等. 长春瑞滨磷脂复合物的制备及其性质研究[J]. 现代药物与临床, 2012, 27(6):570-574. |
| [9] | 陈立江, 刘洋, 李丽, 等. 赤芍总苷自微乳化给药系统的研究[J]. 中草药, 2012, 43(6):1082-1086. |
| [10] | Kang B K, Lee J S, Chon S K, et al. Development of self-microemulsifying drug delivery system (SMEDDS) for oral bioavailability enhancement of simvastatin in beagle dogs[J]. Int J Pharm, 2004, 274(1/2):65-73. |
| [11] | 赵丹丹, 黄挺, 黄绳武. 依托泊苷过饱和自微乳化释药系统的制备工艺及质量评价研究[J]. 中草药, 2015, 46(6):822-831. |
| [12] | 轩肖玉, 王亚静, 张伟玲, 等. 芒果苷自微乳给药系统的制备及其大鼠体内药动学研究[J]. 药物评价研究, 2013, 36(3):166-170. |
| [13] | 赵慧娟, 王答其, 孙文基. 不同部位、不同产地苦参中三叶豆紫檀苷的HPLC测定[J]. 中草药, 2005, 36(9):1404-1406. |
| [14] | 张瑞菊. 苦参中黄酮类有效成分的提取、检测及相关性质的研究[D]. 济南:山东大学, 2008. |
| [15] | 邓银华, 徐康平, 章为, 等. 山豆根化学成分研究[J]. 天然产物研究与开发, 2005, 17(2):172-174. |
| [16] | Hidalgo I J, Raub T J, Borchardt R T. Characterization of the human colon carcinoma cell line (Caco-2) as a model system for intestinal epithelial permeability[J]. Gastroenterology, 1989, 96(2):736-749. |
 2016, Vol. 47
2016, Vol. 47


