中华常春藤Hedera nepalensis K. Koch,又名土鼓藤、钻天风、三角风、散骨风、风荷梨藤,是五加科常春藤属常绿攀援灌木。作为一种观赏性的植物,其分布范围广,北自甘肃东南部、陕西南部、河南、山东,南至广东、江西、福建,西自西藏波密,东至江苏、浙江的广大区域[1]。《中华本草》记载其功能主治为祛风、利湿、和血、解毒,用于风湿痹痛、瘫痪、月经不调、跌打损伤、咽喉肿痛、痈疖肿毒、肝炎[2]。
国内外对常春藤属植物的化学成分研究表明,该属植物主要含五环三萜皂苷、黄酮类、多酚类和有机酸等化合物,五环三萜皂苷中尤以常春藤皂苷和齐墩果烷型为主[3, 4, 5]。常春藤苷C和α-常春藤素是中华常春藤中主要的活性物质,近年来研究发现两者在解痉、抗肿瘤、抗氧化和改善肌肉运动方面有良好的药理活性[6, 7, 8, 9],因此,有必要对中华常春藤的化学成分进行深入的研究。超高效液相色谱与飞行时间质谱联用(UPLC/Q-TOF-MS/MS)技术作为一种新型的分析技术可以提供良好的分离效果,具有高分辨、高灵敏的定性能力和强大的结构表征能力,已广泛运用到中药药效物质基础、中药化学成分分析、代谢组学等研究领域中[10]。本研究采用UPLC/Q- TOF-MS/MS技术,鉴定了中华常春藤茎叶中43个化合物,包括三萜皂苷、黄酮苷类、苯丙素类和核苷类化合物,为进一步研究中华常春藤的化学成分及阐释其药效物质基础提供依据。
1 仪器与材料超高效液相色谱串联四级杆飞行时间质谱(AB SCIEX Triple TOF 5600+;Foster City,CA),配有电喷雾离子源(ESI)、Analyst 1.6色谱工作站和Peakview等质谱分析软件(AB SCIEX公司);岛津超高效液相色谱仪(Nexera UPLC LC-30A,日本),含在线真空脱气机,自动进样器,柱温箱,高压二元梯度泵和二极管阵列检测器;Welch C18色谱柱(100 mm×2.1 mm,1.7 μm);Sartorious BT25S型十万分之一电子分析天平(赛 多利斯公司,德国);KQ-500DE型超声波清洗器(昆山市超声仪器有限公司)。
乙腈、甲醇(色谱纯,美国Fisher公司);甲酸(色谱纯,美国TEDIA公司);水为Milli-Q系统纯化水(美国Millipore公司),其余试剂为分析纯。对照品常春藤苷C、芦丁、金丝桃苷、绿原酸、新绿原酸、隐绿原酸、秦皮乙素、秦皮甲素、熊果酸、腺苷、鸟嘌呤和木犀草苷均购自中国食品药品检定研究院,α-常春藤素和常春藤皂苷元为自制,经过HPLC-ELSD法测得质量分数大于95%。
中华常春藤茎叶于2014年9月采自湖南长沙,经南昌市食品药品检验所副主任药师吴蓓鉴定为中华常春藤Hedera nepalensis K. Koch的茎叶。
2 方法 2.1 供试品的制备称取粉碎的中华常春藤药材2 g,加甲醇50 mL,超声提取(50 kHz,300 W)30 min,滤过,残渣加甲醇50 mL,再超声提取30 min,滤过,合并滤液,减压浓缩,甲醇定容至25 mL。进样前用0.22 μm微孔滤膜滤过。
2.2 对照品溶液的配制精密称取常春藤苷C、芦丁、金丝桃苷、绿原酸、新绿原酸、隐绿原酸、秦皮乙素、秦皮甲素、熊果酸、腺苷、鸟嘌呤、木犀草苷、α-常春藤素和常春藤皂苷元对照品适量,加甲醇超声溶解、定容,于4 ℃冰箱中避光保存备用,进样前用0.22 μm微孔滤膜滤过。
2.3 质谱条件离子源为电喷雾离子化源(ESI),正负离子模式扫描;质量数扫描范围m/z 100~1 500;喷雾电压:±4 500 V,雾化气温度:600 ℃,气帘气:172.36 kPa,雾化气和辅助气:344.74 kPa;去簇电压(DP):±120 V;采用TOF-MS-IDA-MS/MS方法采集数据,TOF/MS一级预扫描和触发的二级扫描TOF/MS/MS离子累积时间分别为200、100 ms,碰撞能量(CE)为±70 eV,碰撞能量叠加(CES)为±(70±15)eV,m/z 80~1 600,触发二级的方法为IDA,多重质量亏损(MMDF)和动态背景扣除(DBS)为触发二级的条件,满足该条件的优先进行二级扫描。
2.4 液相条件色谱柱:UPLC Welch C18色谱柱(100 mm×2.1 mm,1.7 μm);流动相:以0.1%甲酸水溶液(A)-乙腈(B)进行梯度洗脱:0~1.5 min,5% B;1.5~5 min,5%~20% B;5~15 min,20%~40% B;15~30 min,40%~70% B;30~34 min,70%~90% B;34~37 min,90% B;37~40 min,90%~5% B;体积流量0.3 mL/min;进样体积5 μL。
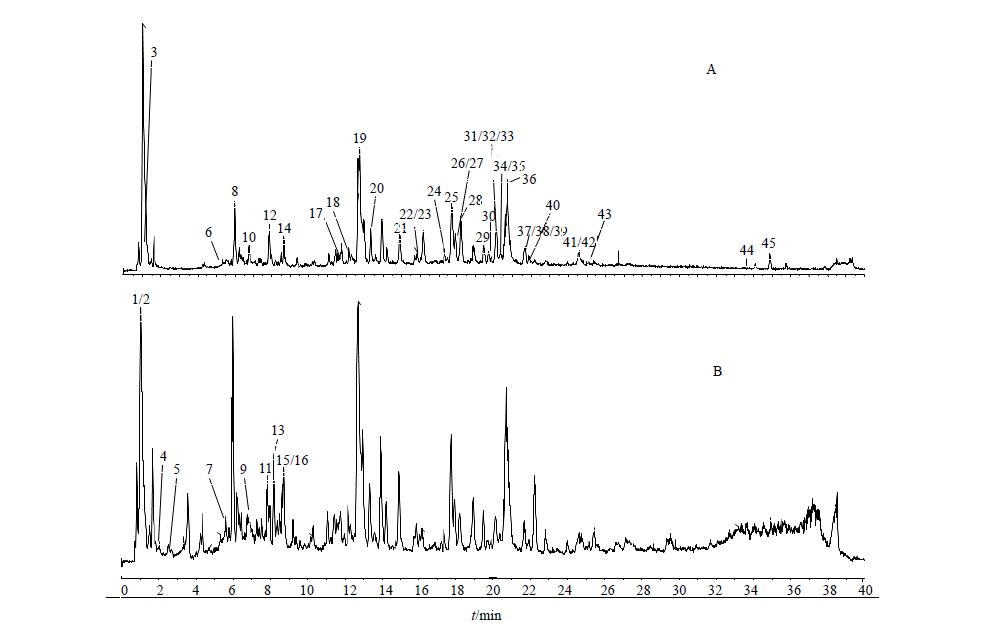
3 化合物质谱分析利用Analyst TF1.6软件对中华常春藤茎叶的甲醇提取物进行分析,通过常春藤属植物的Scifinder数据库和相关文献检索,结合Peakview软件中XIC Manager功能对目标化合物进行了鉴定和确证。利用Peakview软件中Formula finder功能,结合相关化合物的一级质谱和二级质谱,以及同位素分布和化合物裂解规律,进行未知化合物的分析与鉴别。(−) ESI-MS和(+) ESI-MS的质谱总离子流图(TIC)见图 1,已鉴定的各化学成分的保留时间、质谱信息以及相关文献数据见表 1。
|
图 1 中华常春藤茎叶UPLC/Q-TOF-MS/MS的负离子 (A) 和正离子 (B) 总离子流图 Fig. 1 Negative (A) and positive (B) UPLC/Q-TOF-MS/MS total ion flow chart of stems and leaves in H. nepalensis |
|
|
表 1 中华常春藤茎叶提取物的化学成分分析 Table 1 Analysis on chemical constituents from extract of stems and leaves in H. nepalensis |
与对照品的质谱信息匹配,鉴定了中华常春藤茎叶中的常春藤苷C、芦丁、金丝桃苷、绿原酸、新绿原酸、隐绿原酸、秦皮乙素、秦皮甲素、熊果酸、腺苷、鸟嘌呤、木犀草苷、α-常春藤素和常春藤皂苷元共14个化合物。利用Peakview软件中XIC Manager功能对目标化合物进行查找和确定,并通过Formula finder软件、相关数据库、同位素分布以及目标化合物的元素组成和裂解途径分析,鉴定了29个化合物,同时推测了2个潜在的新化合物。
3.1 常春藤皂苷类化合物的鉴定常春藤苷C和α-常春藤素是中华常春藤中活性较好的常春藤皂苷化合物。XIC Manager软件中发现C59H96O26在负离子模式下有2个保留时间,与常春藤苷C对照品质谱信息比对,鉴定样品中峰25为常春藤苷C,母离子峰m/z 1 219.615 2 [M-H]−,另外有m/z 1 073.5653、911.505 3、749.449 4、603.391 9、471.349 1碎片,分别对应[M-H-Rha]−、[M-H-Rha-Glc]−、[M-H-Rha-2Glc]−、[M-H-2R ha-2Glc]−、[M-H-2Rha-2Glc-Ara]−。m/z 1 055.539 2比m/z 1 073.565 3少18,为鼠李糖环上羟基与邻位结合脱去1分子水产生的碎片离子,峰24的母离子峰m/z 1 219.618 0,通过皂苷裂解规律推测该化合物可能为白头翁皂苷B4[17]。与α-常春藤素对照品质谱比对,鉴定峰32为α-常春藤素,母离子峰m/z 749.450 6 [M-H]−,脱去鼠李糖Rha后形成特征碎片m/z 603.393 5 [M-H-Rha]−,再脱去1分子阿拉伯糖形成m/z 471.350 3 [M-H-Rha-Ara]−。由常春藤苷C和α-常春藤素的裂解途径可知,碎片离子m/z 471.35是常春藤皂苷型化合物的特征碎片,因此鉴定峰17、19、20、21、22、27、28、29、30、34、35为常春藤皂苷类化合物。峰19、20,峰30、34为2对同分异构体,根据常春藤属植物的相关文献、化合物裂解途径和Scifinder数据库,推测峰19、20可能是以常春藤皂苷元为母核,含有2个Glc、1个Rha和1个Ara被甲酸化的新三萜皂苷类化合物,峰30、34可能是以常春藤皂苷元为母核,葡萄糖醛酸化的三萜皂苷类化合物[20, 21, 22]。
3.2 黄酮苷类化合物Yu等[26]利用HPLC同时测定了中华常春藤中包括芦丁和烟花苷在内的黄酮和三萜皂苷类成分[28]。与芦丁对照品比对,鉴定峰12为芦丁,母离子m/z609.143 0 [M-H]−,其二级碎片有m/z 301.034 3、151.002 8,m/z 301.034 3为母离子 [M-H]−脱掉鼠李糖和葡萄糖形成的特征碎片,[M-H-Rha-Gla]−碎片RDA裂解后形成m/z 151.002 8碎片。峰14母离子m/z 593.154 7 [M-H]−,脱去鼠李糖和葡萄糖后形成特征碎片m/z 285.038 9 [M-H-Rha-Gla]−,利用Peakview软件中Formula finder功能,设定测得相对分子质量和理论精确相对分子质量的偏差小于5×10−3,鉴定样品中峰13为烟花苷。金丝桃苷和木犀草苷正离子模式下响应好,与对照品质谱信息比对,鉴定峰16为木犀草苷,峰13为金丝桃苷。据芦丁和金丝桃苷对照品的碎片裂解规律,发现峰11、15中有特征碎片m/z 153、128,推测峰11、15分别为桑色素和3,3′,4′,7-四羟基黄酮[5]。
3.3 苯丙素类化合物据相关文献报道,中华常春藤中含有绿原酸[28]。绿原酸在负离子模式下有3个tR值,与对照品质谱信息比对,鉴定样品中峰8为绿原酸,峰5为新绿原酸,峰6为隐绿原酸。绿原酸二级碎片有m/z 191.055 5、179.034 5、161.021 5、135.043 4,m/z 191.055 5为母离子 [M-H]−水解后奎宁酸的分子离子峰,m/z 135.043 4为咖啡酸脱羧后的分子离子峰。秦皮甲素和秦皮乙素为香豆素类化合物,在常春藤属中首次发现,与秦皮甲素和秦皮乙素对照品质谱信息比对,鉴定样品中峰7为秦皮甲素,峰9为秦皮乙素,秦皮甲素二级碎片有m/z 179.038 3、135.042 8、123.046 0,苷键断裂形成m/z 179.038 3和m/z 135.042 8碎片,m/z 179.038 3 RDA裂解得到m/z 123.046 0碎片[12]。
3.4 核苷类化合物腺苷和鸟嘌呤为含氮化合物,在常春藤属植物的文献暂未有相关报道,但两者存在于大部分的植物和动物体内,是一种生物活性良好的内源性物质。腺苷和鸟嘌呤结构的不稳定,使得这2种化合物容易异构化。腺苷和鸟嘌呤对照品在XIC Manager软件查找中有2个tR。腺苷对照品的tR为0.99和1.85 min,植物中化合物C10H13N5O4 tR有1.00和1.82 min,且偏差小于6×10−3,峰1鉴定为腺苷,推断峰4为腺苷同分异构体,两者中碎片m/z 136均为腺苷脱去糖苷元后的碎片[10]。鸟嘌呤对照品的tR为1 .00和2.55 min,样品中C5H5N5O tR为1.01和2.52 min,样品中tR为1.01 min的二级碎片有m/z 135.030 7、110.030 4,分别对应 [M+H-NH3]+和 [M+H-NHCNH]+。根据关于鸟嘌呤的质谱报道,鉴定该峰2为鸟嘌呤,峰5为鸟嘌呤的同分异构体[10]。
3.5 齐墩果酸型类化合物熊果酸为齐墩果酸类化合物,母核相对分子质量为m/z 456,相关文献报道常春藤属植物中含有该化合物[19]。熊果酸在负离子模式下响应较好,熊果酸对照品tR为34.70 min,样品中化合物C30H48O3的tR为33.59和34.67 min,根据熊果酸对照品tR、同位素分布和二级碎片信息,鉴定峰45为熊果酸,峰44为齐墩果酸。
4 讨论 4.1 液质联用条件的优化色谱柱考察了Shim-Pack XR-C18柱、Welch C18柱和Waters-C18柱3种色谱柱,通过色谱峰以及分离度方面的考察,发现在Welch C18色谱柱条件下,化合物的峰性和分离度更好,这有利于质谱的定性分析。药材的处理本实验采用了无水乙醇、100%甲醇、80%乙醇,考察发现100%甲醇作溶剂时得到的峰数更多。流动相考察了甲醇-水、甲醇-0.1%甲酸、乙腈-水、乙腈-0.1%甲酸,流动相中加入少量的酸,能有效的改善峰形及离子化效果。甲醇和乙腈的比较研究发现,用乙腈-0.1%甲酸各个峰之间分离度较好,且大部分的峰集中在总离子流程图的中间部位,因此选用乙腈-0.1%甲酸作为流动相。为了最大程度的推测样品中的化合物,本实验采用了正、负离子2种质谱扫描模式。
4.2 样品中化合物的分析据有关文献报道,中华常春藤中含有大量的多酚、黄酮和有机酸类化合物,但该植物中并未发现,如槲皮素、儿茶酚和咖啡酸等在正负离子模式下均未找到,这有可能与药材的产地、药材处理过程以及液质条件有关,有待进一步研究确证。同时从样品总离子流图中也发现,有一些响应较好的色谱峰未能在已有数据库中找到,证明中华常春藤中还有一些未知成分,有待进一步研究开发。
本实验建立中华常春藤的UPLC-Q-TOF- MS/MS快速分析的方法,基于化合物的精确相对分子量、相关数据库和参考文献,鉴定了中华常春藤中43个化合物。为控制中华常春藤药材的质量、稳定其临床疗效及阐释其作用机制提供了科学依据;并且提示该方法也同样可用于其他中药及中药复方的多成分分析,进而为中药复方的物质基础研究提供一种简单快捷、有效可靠的分析方法。
| [1] | 中国科学院中国植物志编辑委员会. 中国植物志(第58卷)[M]. 北京:科学出版社, 1979. |
| [2] | 国家中医药管理局《中华本草》编委会. 中华本草(第15卷)[M]. 上海:上海科学技术出版社, 1999. |
| [3] | Elias R, Lanza A M D, Vidal-Ollivier E, et al. Triterpenoid saponins from the leaves of Hedera helix[J]. J Nat Prod, 1991, 54(1):98-103. |
| [4] | Trute A, Nahrstedt A. Identification and quantitative analysis of phenolic compounds from the dry extract of Hedera helix[J]. Planta Med, 1997, 63(2):177-179. |
| [5] | Jafri L, Saleem S, Ullah N, et al. In vitro assessment of antioxidant potential and determination of polyphenolic compounds of Hedera nepalensis K. Koch[J]. Arab J Chem, 2014, 5(2):1-8. |
| [6] | Sieben A, Prenner L, Sorkalla T, et al. α-Hederin, but not hederacoside C and hederagenin from Hedera helix, affects the binding behavior, dynamics, and regulation of β2-Adrenergic receptors[J]. Biochemistry, 2009, 48(15):3477-3482. |
| [7] | Mendel M, Chłopecka M, Dziekan N, et al. The effect of the whole extract of common ivy (Hedera helix) leaves and selected active substances on the motoric activity of rat isolated stomach strips[J]. J Ethnopharmacol, 2011, 134(3):796-802. |
| [8] | Rai A. The effects of alcoholic Hedera helix plant extract on ehrlich ascitic tumour cells in vitro and its antitumour activities in vivo[J]. Int J Pharm Sci Rev Res, 2011, 11(2):47-50. |
| [9] | Zeil S, Schwanebeck U, Vogelberg C. Tolerance and effect of an add-on treatment with a cough medicine containing ivy leaves dry extract on lung function in children with bronchial asthma[J]. Phytomedicine, 2014, 21(10):1216-1220. |
| [10] | 张水寒, 蔡萍, 陈林, 等. 高效液相色谱-四级杆-飞行时间串联质谱分析雪峰虫草化学成分[J]. 中草药, 2015, 46(6):817-821. |
| [11] | Abu-Reidah I M, Ali-Shtayeh M S, Jamous R M, et al. HPLC-DAD-ESI-MS/MS screening of bioactive components from Rhus coriaria L. (Sumac) fruits[J]. Food Chem, 2015, 166(1):179-191. |
| [12] | 迪丽拜尔·马木提. 毛菊苣中秦皮甲素和秦皮乙素的药代动力学及生物转化研究[D]. 乌鲁木齐:新疆医科大学, 2014. |
| [13] | 范姣姣, 文红梅, 单晨啸, 等. 基于UFLC-Q-TOF/MS技术的八月札化学成分研究[J]. 中草药, 2013, 44(23):3282-3288. |
| [14] | 郭宜城, 欧阳辉, 何明珍, 等. UPLC/Q-TOF-MS/MS鉴定西南银莲花中的皂苷类成分[J]. 中草药, 2014, 45(10):1378-1387. |
| [15] | Bedir E, Kırmızıpekmez H, Sticher O, et al. Triterpene saponins from the fruits of Hedera helix[J]. Phytochemistry, 2000, 53(8):905-909. |
| [16] | Mshvildadze V, Elias R, Faure R, et al. Triterpenoid saponins from leaves of Hedera pastuchowii[J]. Chem Pharm Bull, 2004, 52(12):1411-1415. |
| [17] | 许慧君. 白头翁质量评价与五环三萜皂苷类成分的药物代谢动力学研究[D]. 石家庄:河北医科大学, 2012. |
| [18] | Demirci B, Goppel M, Demirci F, et al. HPLC profiling and quantification of active principles in leaves of Hedera helix L.[J]. Die Pharm-An Int J Pharm Sci, 2004, 59(10):770-774. |
| [19] | Kizu H, Kitayama S, Nakatani F, et al. Studies on nepalese crude drugs. III. On the saponins of Hedera nepalensis K. Koch[J]. Chem Pharm Bull, 1985, 33(8):3324-3329. |
| [20] | Lee J M, Lee D G, Lee K H, et al. Isolation and identification of phytochemical constituents from the fruits of Acanthopanax senticosus[J]. Afr J Pharm Pharmacol, 2013, 7(6):294-301. |
| [21] | Song J, Yeo S G, Hong E H, et al. Antiviral activity of Hederasaponin B from Hedera helix against Enterovirus 71 subgenotypes C3 and C4a[J]. Biomol Therap, 2014, 22(1):41-46. |
| [22] | Tava A, Mella M, Avato P, et al. New triterpenic saponins from the aerial parts of Medicago arabica (L.) Huds[J]. J Agric Food Chem, 2009, 57(7):2826-2835. |
| [23] | Kizu H, Hirabayashi S, Suzuki M, et al. Studies on the constituents of Hedera rhombea bean. IV. on the hederagenin glycosides. (2)[J]. Chem Pharm Bull, 1985, 33(8):3473-3478. |
| [24] | Tomimori T. Triterpene glyeosides of Hedera taurie[J]. Japan J Pharmacognosy, 1987, 41(1):55-57. |
| [25] | Tung N H, Quang T H, Ngan N T T, et al. Oleanolic triterpene saponins from the roots of Panax bipinnatifidus[J]. Chem Pharm Bull, 2011, 59(11):1417-1420. |
| [26] | Saleem S, Jafri L, ul Haq I, et al. Plants Fagonia cretica L. and Hedera nepalensis K. Koch contain natural compounds with potent dipeptidyl peptidase-4(DPP-4) inhibitory activity[J]. J Ethnopharmacol, 2014, 156(8):26-32. |
| [27] | Gaillard Y, Blaise P, Darré A, et al. An unusual case of death:suffocation caused by leaves of common ivy (Hedera helix). Detection of hederacoside C, α-hederin, and hederagenin by LC-EI/MS-MS[J]. J Anal Toxicol, 2003, 27(4):257-262. |
| [28] | Yu M, Shin Y J, Kim N, et al. Determination of saponins and flavonoids in ivy leaf extracts using HPLC-DAD[J]. J Chromatogr Sci, 2015, 53(4):478-483. |
 2016, Vol. 47
2016, Vol. 47


