中国加入WTO以来,中药产品国际贸易呈稳定增长态势,中药产品出口的国家和产品数量持续提升,中药国际化进程不断推进。然而从产品结构来看,我国出口的中药产品以中药材及饮片、植物提取物等原料型产品为主,中成药产品占比很低[1]。总体而言,我国中药产品在全球植物药产品价值链体系中处于低端领域,缺乏国际竞争力[2]。笔者认为,如果中药产品出口长期维持原料型产品占据绝大比例的现状,则中药国际化只是低水平的国际化。实践中,一些中成药产品在海外也并没有获得药品身份,而是以食品补充剂等非药品的身份销售[3]。中药的国际化发展,应着重关注其药品身份的获得。
欧盟有着悠久的植物药用历史,其植物药的发展在世界范围内处于领先水平,具有较强的国际影响力。欧洲议会和理事会于2004年3月31日颁布了《传统植物药简化注册指令》(Directive 2004/24/EC),旨在结束之前各成员国对植物药产品注册管理不统一的状况,在保障药品安全的情况下,简化注册程序,促进欧盟植物药产品的统一协调发展。该指令给已经在欧盟市场销售的植物药产品设定了7年的过渡期,逾期未按照新的指令要求获得注册的产品必须退市。截止2011年4月1日,过渡期止,我国无一例中成药产品成功在欧盟通过注册。截至目前,我国也仅有地奥的“心血康胶囊”[4]和天士力的“丹参胶囊”[5]2例产品在荷兰通过了传统植物药品注册。本文旨在通过对欧盟成员国植物药产品审评现状进行分析,以期对我国中成药产品通过欧盟植物药注册提供借鉴。本文统计数据来源于欧盟药品管理局(EMA)发布的《欧盟成员国2004/24/EC指令实施情况报告》[6]。
1 欧盟植物药产品上市申请路径根据欧盟“2001/83/EC指令”(Directive 2001/83/ EC)[7],欧盟植物药产品的审评机构为欧盟药品管理局和各成员国药品主管当局2个主体。
植物药产品注册共有3种申请类型,分别是全文本(complete dossier)、良好应用(well-established use,WEU)和传统应用(traditional use registration,TUR)。3种申请类型对应着不同的审批条件。全文本申请需要满足几乎和化学新药申请等同的条件。WEU申请要求药品的活性物质在欧盟境内有10年以上药用历史、确切的疗效和一定的安全性,其非临床和临床研究报告可采用科学文献替代。TUR申请的药品需要有适于传统植物药的独特适应症,且只能获得非处方药(OTC)身份。其给药途径只能是口服、表皮或吸入,并且需要有文献或专家证据证明该药品或同类药品(corresponding product)在申请日前有30年、在欧盟境内至少15年以上的药用历史。基于药品安全、有效、质量可控的原则,审评中对3种申请类型有不同的审评要点。全文本申请对以上3要素要求都很高,WEU申请着重关注药品安全性和有效性,TUR申请着重关注药品安全性。
对于这3种申请类型,共有2条申报路径,申请人可就其产品向欧盟药品管理局或成员国药品主管当局提出申请(图 1)。这其中共有4种申请程序可以选择,分别是成员国程序(national procedure)、分散式程序(decentralised procedure)、集中式程序(centralised procedure)以及互认式程序(mutual recognition)。
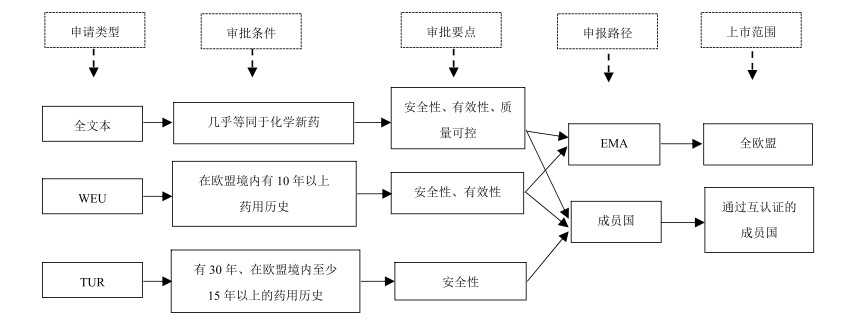
|
图 1 欧盟植物药产品上市申请路径 Fig.1 Routes for herbal medicinal products registration in EU |
如果申请人只计划在欧盟1个成员国上市其药品,此时适用成员国申报路径,在该国获得药品上市许可即可。如果申请人计划同时在欧盟数个成员国上市其药品,此时适用分散式程序。申请人需要同时将申请资料提交给各成员国药品主管当局,并指定一个参考成员国(reference member state),由该成员国开展初期评估并形成评估报告草案。其他成员国与参考成员国通过沟通最终达成一致后,申请人即可获得这些成员国的药品上市许可。如果申请人打算同时在整个欧盟范围内获得药品上市许可,则需要将申请材料提交给欧盟药品管理局。其审评完毕后,欧盟药品管理局会将审评意见提交给欧盟委员会,最终由欧盟委员会决定是否给该药品颁发全欧盟范围的药品上市许可。
在成功获得某一成员国的药品上市许可后,申请人还可通过互认式程序申请在其他成员国上市其药品。此时,已授予该药品上市许可的成员国即为参考成员国,由该国药品主管当局将该药品的审评报告提交给其他成员国,若各方达成一致,则申请人可获得其他成员国的药品上市许可。经过协调沟通后,若有成员国拒绝同意颁发该药品上市许可,则由欧盟委员会作出最终裁决。
需要注意的是,集中式程序的审评标准极为严格。除了治疗艾滋病、癌症等疾病的药品依照法律规定必须通过集中式程序进行申请,通常也只是实力雄厚的药企研发的具有高技术含量的新药才会考虑此种申请程序。此外,全文本与WEU申请可通过以上任何一种申请程序开展申请,而TUR申请不得通过集中式程序开展申请[8]。
从申请要件来看,全文本申请难度最大,目前尚没有植物药品以全文本方式通过注册。WEU申请难度次之,TUR申请较WEU申请则要容易一些。
2 欧盟成员国TUR申请和WEU申请审评总体状况截至2016年5月,欧盟共有2 629个传统植物药产品(traditional herbal medicinal product,THMP)通过TUR提交了申请,其中654个处于审评中,已批准1 577个,未获批准215个,申请者主动撤回183个。1 292个植物药产品(herbal medicinal product,HMP)通过WEU提交了申请,其中304个处于审评中,已批准768个,未获批准62个,申请者主动撤回66个。主要成员国审评的已受理数、正在审评数、已批准数、不予批准数和申请者主动撤回数见表 1和表 2。
|
|
表 1 欧盟主要成员国TUR申请审评情况 Table 1 TUR registration status in key members of EU |
|
|
表 2 欧盟主要成员国WEU申请审评情况 Table 2 WEU registration status in key members of EU |
TUR申请和WEU申请在总申请量中分别占67%和33%,TUR申请和WEU申请获批率分别为88%和93%。德国、波兰、奥地利、法国等植物药应用大国在TUR与WEU的申请受理与已批准数都位居前列,而TUR申请批准量第一的英国目前只收到了3例WEU申请,其中2例处于审评中,1例获批。这主要是因为“Directive 2004/24/EC指令”实施前,英国的植物药产品是以食品身份销售的,没有药品身份,申请要件较难满足[9]。而德国、奥地利等国在指令实施前就以药品身份对植物药产品进行管理,因此在申请时已有大量的科学文献和丰富的经验为基础。总体来看,因为WEU申请在申请要件上难度大于TUR申请,所以大部分申请者通过TUR进行申请。而因为一些成员国较早地对植物药产品以药品身份进行规制,有丰富的资料和经验积累,所以其获批率略高于TUR申请。
3 已获批植物药产品的组分特点已获批的1 577例TUR申请中,983例为单方药品,594例为复方药品,占比分别为62%和38%。已获批的768例WEU申请中,621例为单方药品,147例为复方药品,占比分别为81%和19%。2种申请方式中,单方药品的获批数均明显高于复方药品获批数,这主要是因为复方药品所需提交的各种材料相比单方药品要更复杂、困难。相比于TUR申请获批复方药品38%的占比,WEU申请获批复方药品占比仅为19%,主要是因为以WEU方式申请的药品无适应症限制,审评中对药品安全性和有效性的要求比TUR方式严格许多。
在已获批复方药品中,以2~3个组方为主,4~9个组方的也占据了一定比例,10个组方以上的极少。仅有10例含维他命或矿物质的药品获批(图 2)。
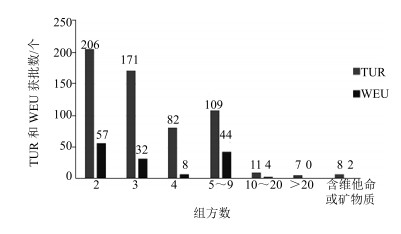
|
图 2 已获批复方药品不同组方数批准情况 Fig.2 Granted status of medicinal combination products |
4 已获批植物药产品欧盟植物药专论应用情况
根据“Directive 2004/24/EC指令”,欧盟植物药品委员会(committee on herbal medicinal products,HMPC)负责起草和发布欧盟植物物质、植物制剂或两者混合物的专论(EU monographs)。欧盟植物药专论主要关注药品安全性和有效性,其建立程序包括指定评估者、征集科学资料、草拟评价报告、公开初稿、预定稿、通过审评意见6个阶段,HMPC认为最终不适合建立专论的则会发布公共声明(public statement)解释不予建立的原因。专论并不具有法律约束力,但是绝大部分情况下,各成员国在审评药品申请中将其作为产品安全性、有效性方面的重要参考依据。HMPC还负责起草欧盟植物药目录(EU list entries),该目录收录的是其安全性、有效性评估结果最好的少数专论,最终由欧盟委员会(European Commission)发布。该目录具有法律约束力,申请者依据该目录进行TUR或WEU申请时,审评方不得要求申请者再提供安全性和有效性方面的证据[10]。
截至2016年5月,共有828个获批的TUR申请和522个WEU申请充分利用了已建立的专论。专论建立率分别为53%和68%,足见专论在促进植物药品注册中发挥了重要作用。
5 已获批植物药产品主要适应症已获批植物药产品中,感冒、精神压力和情绪异常、泌尿及妇科疾病、胃肠道失调、失眠等为主要适应症(表 3)。此外,TUR获批药品的口腔及喉咙不适、增强免疫力等适应症的数量明显高于获批的WEU,而便秘则相反。WEU获批药品的适应症还包括慢性肝炎、肝硬化、失智症、高胆甾醇血等[11]。总体而言,在适应症特点上,TUR植物药偏改善,而WEU植物药则偏治愈。
|
|
表 3 已获批植物药产品主要适应症 Table 3 Main indications of granted herbal medicinal products |
6 关于我国中成药产品以植物药产品身份在欧盟上市的思考及建议
长期以来,有些观点认为中药有几千年的药用历史,足以说明其优越性,不应一味迎合西方的标准,使中药失去本来的面貌。笔者认为类似的观点有失偏颇。中药是我国的宝贵财富,为人民健康做出了巨大贡献。然而中药不良反应事件的发生为中药敲响了警钟。从药品安全、有效、质量可控入手,以科学手段保障用药安全不应只适用于化学药,用在中药产品身上并不矛盾。中药标准化、国际化并不是要否定中药特性,其根本目的在于保障人民用药安全,惠及大众。由此,除去商业利益考量,促进中成药产品以植物药产品身份进入欧盟市场无疑会带动相关中药产品的科学研究,最终有利于中药产品质量的提升。
虽然目前我国中药企业面临难以提供在欧盟15年以上药用历史证明、GMP认证、申请费用成本较高等困难,但是不能因为这些原因就放弃努力。应当从长远利益考虑,逐步增强中药科研水平,促进中药国际化进程。基于本文的分析,笔者提出以下4点建议。
6.1 从TUR申请入手,选择有经验的欧盟合作方目前来看,WEU申请尚不适合中成药的申请,因为绝大部分情况下,WEU申请的前提是之前已经是以药品身份在市场销售10年以上,并且需要提供在国际期刊发表的相关科学文献。而TUR申请要求的是欧盟境内15年以上的药用历史,并不强调其药品身份。之前许多以食品、食品补充剂身份销售的中成药产品都标明了一定的治疗功效。
目前我国获批的2种中成药都是通过TUR申请注册,注册地点都在荷兰。当然,这并不能说明在荷兰申请就容易通过注册,因为目前中药企业已启动申请的数量还很少。此外,英国Phynova公司的中成药产品“缓解关节肌肉疼痛片”成功通过TUR方式获批注册[12],成为英国首个获批的中成药产品。目前已有2家中国中药企业与其签订了合作协议。荷兰SU生物医药公司与德国Diapharm公司签订了战略合作协议,2家公司均致力于中成药在欧盟的上市注册服务[13]。选择有实力、有经验的合作方会给申请工作带来很大帮助。
6.2 从单方药品申请入手逐渐往复方药发展目前已获批的3种中成药皆为单方药品,主要因为单方药品的注册相比复方药品难度低一些。单方药品获批数的增多将成为复方药品申请注册的基础,从统计数据看,复方药品的获批量并不低,这对中成药的欧盟注册是个利好信息,因为大多数中成药是复方药品。虽然仅有10种含维他命或矿物质的植物药品获批,但这同时也说明了该种注册的可行性。不少中成药含有一些矿物质,相关企业、科研机构等可早做研究,为将来的注册申请打下基础。
6.3 促进中药物质进入欧盟植物药专论植物药专论的建立对相关产品申请注册有很大的帮助,应充分重视。有些已建立的植物药专论如甘草Glycyrrhizae Radix et Rhizoma、干姜Zingiberis Rhizome、亚麻子Lini Semen等同时具有欧盟和中国的来源[14],应当充分利用这些已建立的专论。2011年,国家中医药管理局成立中药欧盟注册专家指导组,指导组职责之一便是统筹指导中草药专论的研究和编写。笔者认为,应进一步深化整合相关科研机构、协会、企业的优势资源,加强与HMPC的沟通协调。此外,对于只是不能满足欧盟15年以上药用历史而满足了其他注册申请要件的中成药产品,企业可积极尝试申请注册。因为根据“Directive 2004/24/EC指令”,成员国在收到上述情况的申请时,必须将该申请转交HMPC,由HMPC决定其是否有资格继续接受审评,并且HMPC会考虑是否就该品种建立植物药专论。
6.4 选择合适的适应症在申请注册的初期阶段,宜选择感冒、精神压力和情绪异常等最普通、最常见的适应症作为导向。因为一般来说,患者对于通过植物药产品治疗类似症状接受度较高。其次,可考虑中成药产品擅长的和具有特色的适应症,逐步建立中成药产品的品牌效应。
| [1] | 闫庆松, 于志斌. 中药国际化入世十年回顾及未来畅想[J]. 中国现代中药, 2012, 14(11):52–55. |
| [2] | 高山, 石建伟. 中国中医药产业升级路径选择--基于全球价值链视角[J]. 经济与管理, 2010, 24(12):85–88. |
| [3] | 瞿礼萍, 邹文俊, 姬建新, 等. 中药产品欧盟上市可行途径及法规解析[J]. 中草药, 2014, 45(5):603–607. |
| [4] | CBG-MEB. Public Assessment Report on Diao Xin Xue Kang[EB/OL].[2016-07-11]. http://db.cbg-meb.nl/Pars/h102142.pdf. |
| [5] | CBG-MEB. Public Assessment Report on Danshen Capsule[EB/OL].[2016-07-11]. http://db.cbg-meb.nl/IB-teksten/h114997.pdf. |
| [6] | EMA. Uptake of the traditional use registration scheme and implementation of the provisions of Directive 2004/24/EC in EU Member States[EB/OL].[2016-07-11]. http://www.ema.europa.eu/docs/en_GB/document_library/Report/2011/05/WC500106706.pdf. |
| [7] | European Commission. Directive 2001/83/EC[EB/OL].[2016-07-11]. http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2001:311:0067:0128:en:PDF. |
| [8] | European Commission. Authorisation procedures for medicinal products[EB/OL].[2016-07-11]. http://ec.europa.eu/health/authorisation-procedures_en.htm |
| [9] | MHRA. Public perception of herbal medicines[EB/OL].[2016-07-11]. https://www.gov.uk/drug-safety-update/public-perception-of-herbal-medicines. |
| [10] | EMA. European Union monographs and list entries[EB/OL].[2016-07-11]. http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/general/general_content_001132.jsp&mid=WC0b01ac0580033809. |
| [11] | Peschel W. The use of community herbal monographs to facilitate registrations and authorisations of herbal medicinal products in the European Union 2004-2012[J]. J Ethnopharmacol, 2014, 158: 471–486. DOI:10.1016/j.jep.2014.07.015 |
| [12] | MHRA. Public assessment reports on Phynova Joint and Muscle Relief Tablets[EB/OL].[2016-07-11]. http://www.mhra.gov.uk/home/groups/par/documents/websiteresources/con512962.pdf. |
| [13] | Diapharm. SU BioMedicine and Diapharm collaborate to register and market high quality Chinese Medicine in Europe[EB/OL].[2016-07-11]. https://uk.diapharm.com/company/press/pr/su-biomedicine-and-diapharm-collaborate-to-register-and-market-high-quality-chinese-medicine-in-europe-1/. |
| [14] | 瞿礼萍, 王文珺, 周祯祥, 等. 基于"欧盟草药专论"解析中药欧盟注册关键问题[J]. 中草药, 2014, 45(24):3509–3514. |
 2016, Vol. 47
2016, Vol. 47


